姜黄素对前列腺癌PC-3细胞HSP27 mRNA表达及凋亡的影响△
2015-09-25徐雷刘刚刘朝选
徐雷,刘刚,刘朝选
(牡丹江市第一人民医院 泌尿外科,黑龙江 牡丹江 157011)
·基础研究·
姜黄素对前列腺癌PC-3细胞HSP27 mRNA表达及凋亡的影响△
徐雷*,刘刚,刘朝选
(牡丹江市第一人民医院 泌尿外科,黑龙江 牡丹江 157011)
目的:评价姜黄素对前列腺癌PC-3细胞热休克蛋白27(HSP27)mRNA表达及凋亡的影响,探讨其抗前列腺癌的可能作用机制。方法:体外培养人正常前列腺上皮细胞RWPE-1和前列腺癌细胞LNCaP、PC-3和DU145。采用RT-PCR检测各细胞HSP27 mRNA的表达情况。PC-3细胞随机分为4组,空白对照组:不给药;高剂量组:给予50 μmol·L-1姜黄素2 μL;低剂量组:给予25 μmol·L-1姜黄素2 μL;另设阴性对照组:给予等体积DMSO。采用RT-PCR检测PC-3细胞HSP27 mRNA的表达情况,采用TUNEL法检测PC-3细胞凋亡情况。结果:LNCaP、PC-3和DU145细胞HSP27 mRNA的表达明显升高,与RWPE-1细胞比较,差异具有统计学意义(P<0.05)。给药组PC-3细胞HSP27 mRNA的表达明显降低,且呈剂量依赖性,与空白对照组比较,差异具有统计学意义(P<0.05);给药组可见大量PC-3细胞凋亡,且呈剂量依赖性,与空白对照组比较,差异具有统计学意义(P<0.05)。结论:姜黄素抑制HSP27 mRNA的表达和诱导PC-3细胞凋亡,可能是其抗前列腺癌的机制之一。
前列腺癌;姜黄素;PC-3细胞;热休克蛋白27;细胞凋亡
热休克蛋白27(heat shock proteins 27,HSP27)是热休克蛋白家族的主要成员之一,其在正常组织和细胞中表达水平较低,在不同生物及物理因素的刺激条件下,HSP27出现高表达[1]。研究发现,许多恶性肿瘤中HSP27高表达,其表达上调与恶性肿瘤关系密切[2]。HSP27与临床疾病特别是与肿瘤的关系日益受到重视,但是有关HSP27在前列腺癌发生发展及预后中所起的作用仍存在争议。前列腺癌是威胁男性健康的一种常见的泌尿生殖系统肿瘤,是美国男性中引起死亡的第二大癌症,是55岁以上男性的第三位死因。我国前列腺癌的发病率虽低于欧美国家,但随着我国人口老龄化和饮食结构的改变,近年来其发病率也在不断地上升,且有迅速增加的趋势[3-4]。我国前列腺癌的发病率因何低于欧美国家,许多学者设想可能与其饮食结构有关。有研究证实,黄酮、多酚类化合物被认为是预防治疗前列腺癌很有潜力的药物。姜黄素(Curcumin)是一种从姜黄根茎中提取得到的脂溶性酚类黄色色素,具有广泛的药理作用,如抗炎、抗氧化、抑制血管生成及特有的抗肿瘤活性[6]。本研究采用RT-PCR检测PC-3细胞HSP27 mRNA的表达情况,采用TUNEL法检测PC-3细胞凋亡情况,旨在评价姜黄素对前列腺癌PC-3细胞HSP27 mRNA表达及凋亡的影响,探讨其抗前列腺癌的可能作用机制。
1 材料
姜黄素和DMSO(Sigma公司),人正常前列腺上皮细胞RWPE-1、前列腺癌细胞LNCaP、PC-3和DU145细胞株(中国科学院上海细胞库),F12培养液和胎牛血清(武汉凌飞科技有限公司),TRIzol试剂盒(上海华舜公司),TUNEL细胞凋亡原位检测试剂盒(Bestbio公司),青霉素、链霉素和溴化乙啶等(碧云天生物技术研究所),细胞培养板(Corning 公司)。姜黄素使用DMSO配制成50 mmol·L-1储备液,-20 ℃冰箱保存备用,临用前用F12培养液分别配制成25、50 μmol·L-1溶液。
2 方法
2.1 细胞培养及给药
RWPE-1、LNCaP、PC-3和DU145细胞分别保存在含有10%胎牛血清的F12营养培养基(含青霉素100 U·mL-1和链霉素100 μg·mL-1)。按照细胞密度1×106个细胞/孔接种于6孔板中,37 ℃、5% CO2及饱和湿度下培养24 h。待80%细胞融合后,更换新鲜培养液,PC-3细胞随机分为4组,空白对照组:不给药;高剂量组:给予50 μmol·L-1姜黄素2 μL;低剂量组:给予25 μmol·L-1姜黄素2 μL;另设阴性对照组:给予等体积DMSO,收集培养液用于后续分析。每个实验步骤至少重复4次。
2.2 RT-PCR检测HSP27 mRNA的表达
按照TRIzol试剂盒说明书抽提总RNA,溶于20 μL DEPC-H2O,依次加入2.5 μL DNA酶,2.5 μL 10×buffer,37 ℃水浴30 min后,65 ℃水浴10 min,分光光度法检测RNA浓度。HSP27 PCR引物是:5′-AAGGAAATTCAAAATGCTGTCAA-3′(正向)和5′-ACAGACAAGATCTCCCGGCACTT-3′(反向),GAPDH扩增产物:5′-GGTCAACGGGTAGGT-GTTTG-3′(正向)和5′-GCCTTTGGGCTCTGCATGAA-3′(反向)。HSP27 PCR反应总体积25 μL。使用GeneAm P2400热循环仪,预变性94 ℃ 5 min,变性94 ℃ 30 s,退火58 ℃ 30 s,延伸72 ℃ 30 s,共35个循环,最后72 ℃延伸5 min。1.5%琼脂糖凝胶电泳(110 V,35 mA,30 min),溴化乙锭染色,BandScan 5.0软件进行电泳结果吸光度积分值分析,HSP27 mRNA表达相对含量值(灰度比)=HSP27吸光度积分值/GAPDH吸光度积分值。
2.3 TUNEL检测细胞凋亡
使用TUNEL细胞凋亡原位检测试剂盒检测姜黄素对PC-3细胞凋亡的影响。将细胞用PBS冲洗,-20 ℃甲醇固定15 min,然后PBS冲洗细胞3次,加入50 μL TUNEL反应液,避光37 ℃孵育1 h。PBS冲洗细胞,Hoechst 33258染料37 ℃染色10 min。凋亡指数= TUNEL阳性细胞数/细胞总数。
2.4 数据统计学分析
3 结果
3.1 RT-PCR检测RWPE-1、LNCaP、PC-3和DU145细胞HSP27 mRNA的表达结果
HSP27 mRNA的表达结果依赖于前列腺癌细胞株的恶性程度,恶性程度越高,表达越高。RWPE-1细胞HSP27 mRNA的表达水平为90%,LNCaP、PC-3和DU145细胞HSP27 mRNA的表达水平分别为100%、115%和148%,与RWPE-1细胞比较,差异具有统计学意义(P<0.05)。结果见图1。
3.2 姜黄素对HSP27 mRNA表达的影响
RT-PCR检测各实验组PC-3细胞的HSP27 mRNA表达水平分别为128%、110%、50%、60%。高剂量组和低剂量组与空白对照组比较,差异具有统计学意义(P<0.05)。结果见图2。
3.3 PC-3细胞凋亡情况
姜黄素高剂量组和低剂量组可见大量凋亡PC-3细胞,且高剂量组高于低剂量组,呈剂量依赖性,与空白组比较,差异具有统计学意义(P<0.05)。结果见图3。
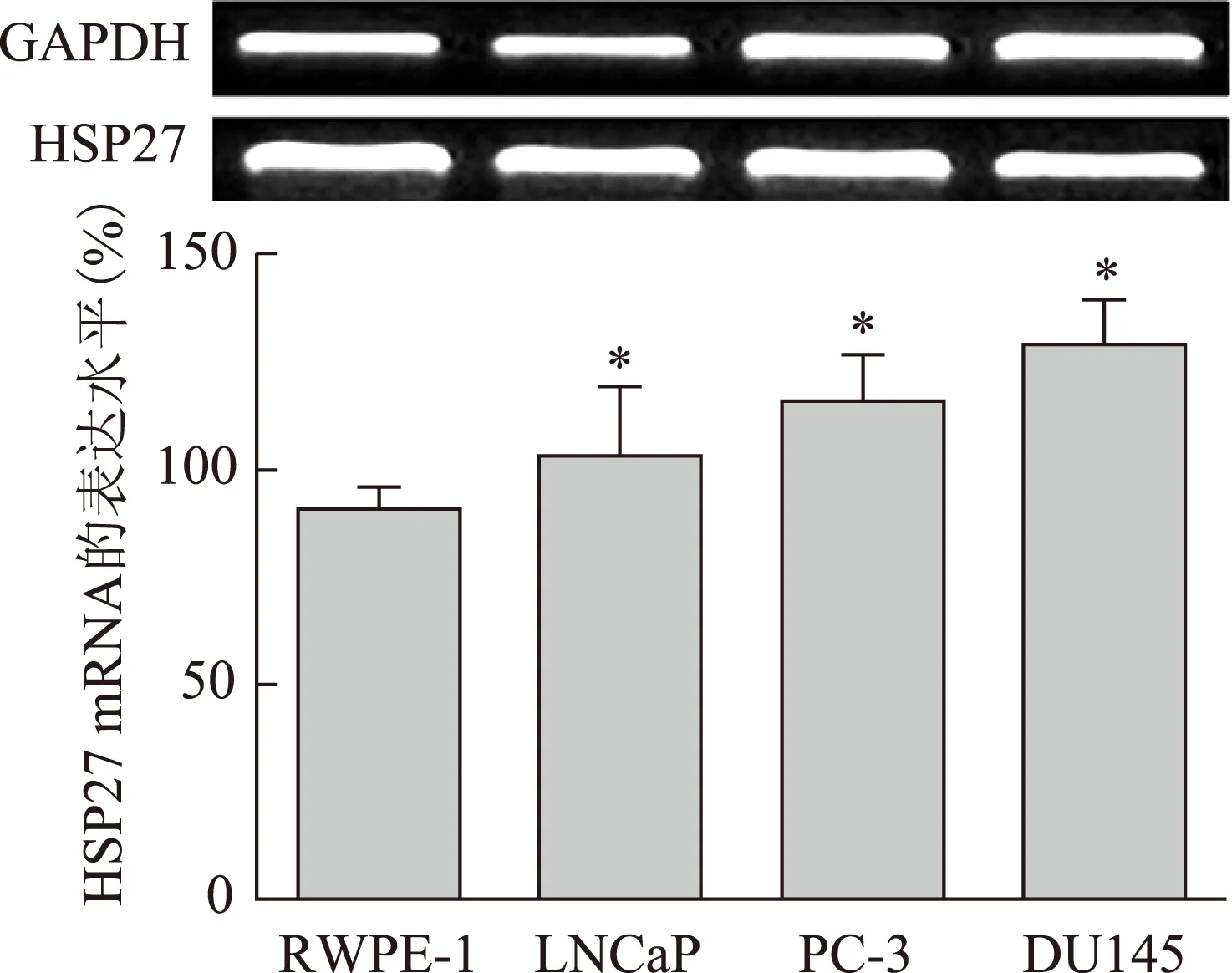
注:与RWPE-1细胞比较,*P<0.05。图1 RT-PCR检测RWPE-1、LNCaP、PC-3和DU145细胞HSP27 mRNA的表达结果
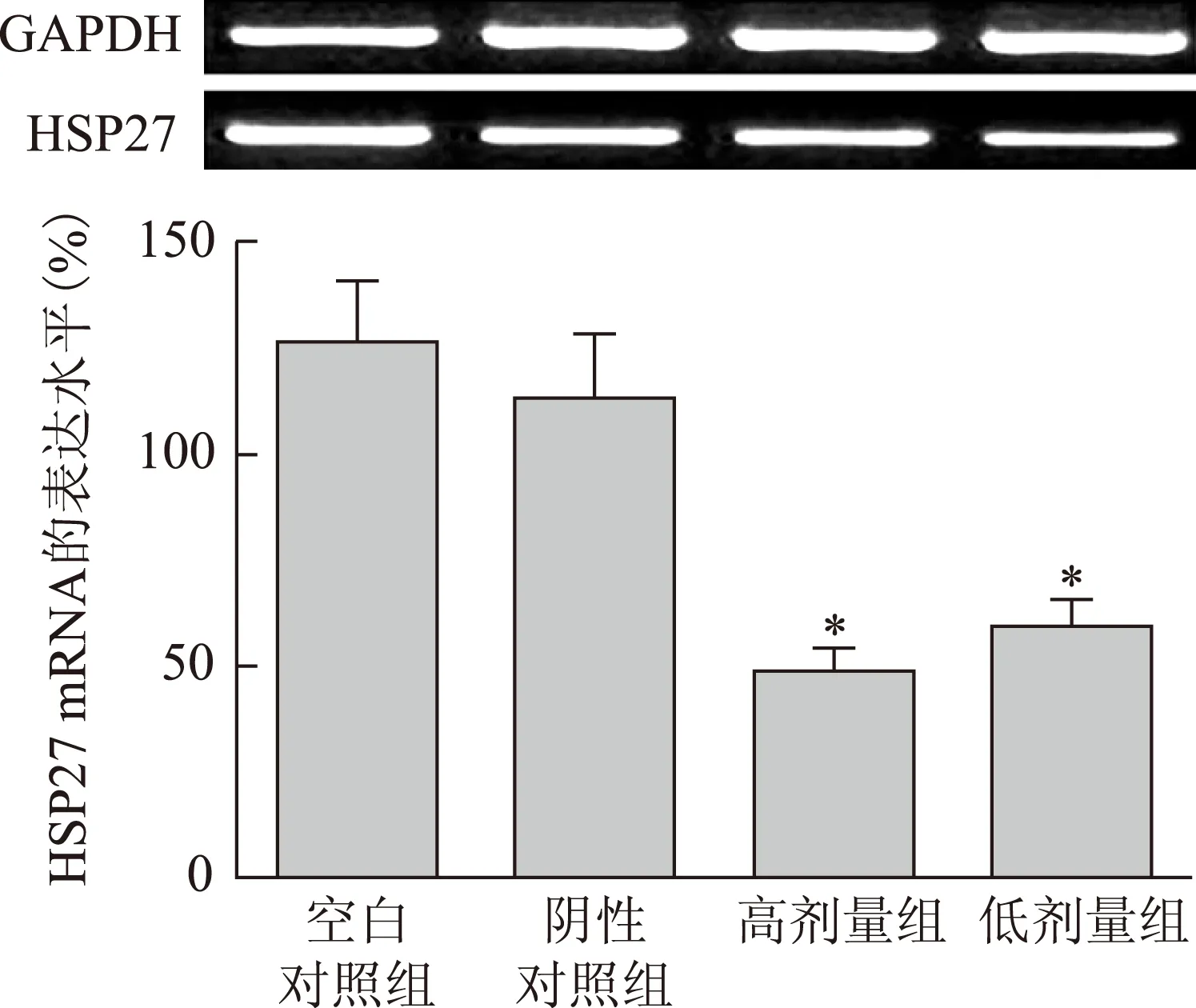
注:与空白对照组比较,*P<0.05;下同。图2 姜黄素对HSP27 mRNA表达的影响
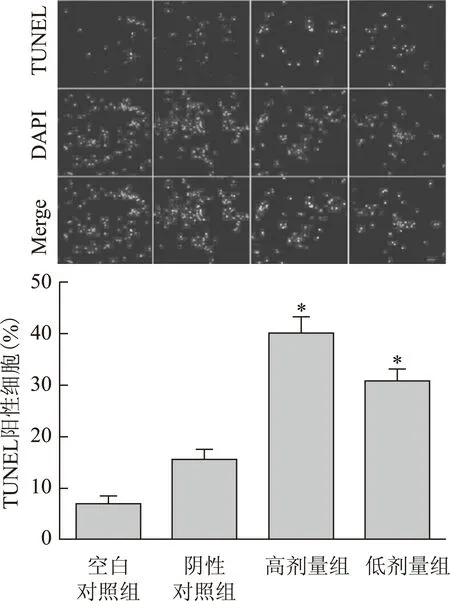
图3 姜黄素诱导PC-3细胞凋亡情况(SP×200)
4 讨论
HSP作为分子伴侣广泛存在于原核与真核细胞体内,参与了细胞凋亡、细胞周期的调控以及细胞信号转导等重要的生物学过程,是生物体内具有广泛和重要生物学功能的蛋白质[7]。Fuller等[8]研究发现,HSP和肿瘤的发生、发展、转移、肿瘤免疫、抗肿瘤治疗以及肿瘤的预后等关系密切。HSP的表达不仅抑制细胞损伤而且对细胞的保护也起着重要作用,例如控制细胞凋亡和肿瘤免疫反应[9]。
HSP27是HSP亚家族成员之一,在多种肿瘤细胞中均有过表达,其主要的生物学功能是防止各种应激因素对细胞的损伤。另外,HSP27还与调节细胞的增殖、分化及细胞凋亡的信号转导等有关[10]。近年来,研究HSP27与肿瘤的关系成为热点。正常组织细胞内HSP27的表达水平很低,应激状态可致胞内HSP27磷酸化并致其寡聚体解聚,HSP27表达上调。HSP27在肿瘤发病中的作用与其对细胞的影响有关,它在细胞凋亡信号通路中可与相关活性蛋白相互作用并抑制凋亡信号的转导,抑制细胞凋亡,参与癌症的发生[11-12]。同时,HSP27高表达能引起肿瘤细胞对柔红霉素、甲氨蝶呤和长春新碱的耐药性[13]。HSP27通过调节肿瘤细胞的增殖分化及细胞凋亡的信号转导,参与肿瘤的发生、侵袭以及转移过程[14]。HSP27的重要作用是控制肌动蛋白和细胞凋亡的动态变化。HSP可通过肿瘤细胞伴侣分子抗原肽在启动危险信号或诱导免疫反应而保护肿瘤细胞。目前HSP27与肿瘤的关系日益受到重视,但是有关HSP27在前列腺癌发生发展及预后中所起的作用鲜见报道。Miyake等[15]报道,HSP27、HSP70、HSP90在前列腺癌细胞表达,但是根据Gleason评分和病理分期,只有HSP27表达具有统计学意义,而且HSP27可作为前列腺癌预后判断的重要指标。Thomas等[16]研究显示,前列腺癌组织中不同细胞HSP27的着色强度有所不同,具有明显的异质性,也就是随着癌组织分化程度的增高,HSP27的表达水平也随之增高。本研究结果显示HSP27的表达与前列腺癌细胞的分级呈正相关,即前列腺癌细胞分级越高,其表达水平也就越高。说明癌细胞的发生、发展、恶变,侵袭力等因素与HSP27的表达水平相关。本研究结果与其相一致。
姜黄素是从中药姜黄中提取的活性成分,具有重要和广泛的药理作用,如抗突变、抗炎和抗肿瘤等多种作用[17-18]。姜黄素对多种肿瘤的发生、发展均有明显抑制效果,具有多靶向的抗肿瘤作用,能够直接或间接地保护机体细胞免受有害因素的损害,维持细胞正常的新陈代谢和生理功能,从而实现保护作用,由于其活性广泛,安全有效,因此极具临床开发前景[19]。目前普遍认为,姜黄素的抑瘤作用机制主要与其诱导肿瘤细胞凋亡有关,它是通过调控抑癌基因、癌基因及其蛋白的表达诱导细胞周期停滞及调控细胞凋亡信号等途径实现的[20]。本研究的目的旨在讨论姜黄素对前列腺癌PC-3细胞凋亡的影响。PC-3细胞来源于人前列腺癌上皮,具有低转移能力,在调节肿瘤进展方面起到很重要的作用,如细胞分化、细胞增殖、黏附、迁移、细胞外周的蛋白水解作用,是良好的实验选择细胞株[21]。故本研究采用TUNEL法检测PC-3细胞的凋亡情况,实验结果显示,姜黄素可以诱导PC-3细胞凋亡,且呈剂量依赖性。同时,RT-PCR技术检测姜黄素对前列腺癌PC-3细胞HSP27 mRNA表达的结果显示,姜黄素可以抑制HSP27 mRNA的表达,而且随着剂量增加,抑制作用增强,具有剂量依赖性。
综上所述,根据HSP27在前列腺癌细胞中的表达,可以判断其恶性程度,为临床制定治疗方案和判断预后提供了重要参考指标;姜黄素可以抑制前列腺癌细胞表达HSP27 mRNA,高浓度的姜黄素抑制作用更强。姜黄素抑制PC-3细胞HSP27 mRNA的表达和诱导PC-3细胞凋亡,可能是其抗前列腺癌的机制之一,然而姜黄素诱导PC-3细胞凋亡的具体作用机制有待深入研究。
[1] 刘世敏,李解方.HSP27表达与前列腺癌关系研究[J].临床和实验医学杂志,2014,13(1):48-51.
[2] 徐庆刚,夏曙霞,冯驰,等.HSP27在前列腺癌组织中的表达及临床研究[J].江西医药,2013,48(12):1120-1122.
[3] 江涛,胡华刚,徐斯凡.SATB-1与前列腺癌的研究进展[J].中国医药导报,2014,11(16):159-161.
[4] 王启林,李瑞乾,金从国,等.蛋白磷酸酶2A的癌性抑制因子在前列腺癌中的表达及意义[J].中国医药导报,2014,11(9):45-47.
[5] 李辉明,魏世平,陶维雄,等.前列腺癌病理分级、临床分期和血清PSA的关系[J].中国临床研究,2014,27(1):37-38.
[6] 阮兴举,刘玉娥,郑政隆.姜黄素对前列腺癌PC-3细胞的增殖和凋亡的研究[J].成都中医药大学学报,2013,36(1):65-66.
[7] 刘世敏,李解方.HSP27在前列腺癌组织中的表达及其临床意义[J].中南医学科学杂志,2013,41(3):247-252.
[8] Fuller KJ,Issels RK,Slosman DO,et al.Cancer and the heat shock response[J].Eur J Cancer,1994,30A(12):1884-1891.
[9] Garrido C,Gurbuxani S,Ravagnan L,et al.Heat shock proteins:endogenous modulators of apoptotic cell death[J].Biochem Biophys Res Commun,2001,286:433-442.
[10] Roeehi P,So A,K0jima S,et a1.Heat shock protein 27 inereases after androgen ablation and plays a cytoproteetive role in hormone refractory prostate cancer[J].Cancer Res,2004,64(18):6595-6602.
[11] 陈霞,袁国跃,王东.热休克蛋白27、转化生长因子-β1在甲状腺乳头状癌中的表达及临床意义[J].江苏大学学报(医学版),2013,23(6):517-519.
[12] 黄琳淋,李光迪.甲胎蛋白异质体3、高尔基体蛋白73 及热休克蛋白27在原发性肝癌中的诊断价值[J].中外医疗,2013(13):26-28.
[13] 郭建波,蔡永清,赵鲁笳,等.大肠癌组织中HSP27和bc-12及p53蛋白的表达及其临床意义[J].中华肿瘤防治杂志,2006,13(5):361-364.
[14] 李伟,江其生.热休克蛋白27与肿瘤关系的研究进展[J].肿瘤研究与临床,2009(2l):430-431.
[15] Miyake H,Muramaki M,Kurahashi T,et al.Expression of potential molecular markers in prostate cancer:correlation with clinicopathological outcomes in patients undergoing radical prostatectomy[J].Urol Oncol,2010,28:145-151.
[16] Thomas SA,Brown IL,Hollins GW,et a1.Detection and distribution of heat shock protein 27 and 90 in human benign and malignant prostatic tissue[J].Br J Urol,1996,77(3):367-372.
[17] 赵雷.姜黄素诱导雄性激素依赖性前列腺癌LNCaP多耐药细胞凋亡[J].中国实验诊断学,2012,16(10):1920-1921.
[18] 马强,王德林,赵修民,等.姜黄素联合多烯紫杉醇诱导PC-3细胞凋亡的实验研究[J].重庆医学,2012,41(7):637-639.
[19] 王磊,刘修恒,陈晖,等.姜黄素对大鼠肾脏缺血再灌注损伤后核因子-κB表达的影响[J].中国医药导报,2013,10(19):31-33.
[20] 胡惠军,陈新来,潘勇权,等.姜黄素对肝细胞生长因子诱导的前列腺癌细胞上皮细胞间质化的逆转作用[J].现代肿瘤医学,2013,21(7):1425-1429.
[21] 张轶庠,张朝霞,黄东龙,等.HSP27在人不同转移性前列腺癌细胞株比较蛋白质组学的初步研究[J].中国现代医学杂志,2012,22(35):19-25.
Effect of Curcumin on Prostate Cancer PC-3Cell HSP27mRNA Expression and Apoptosis
XU Lei*,LIU Gang,LIU Chaoxuan
(Department of Orthopedic Surgery,The First People’s Hospital of Mudanjiang,Heilongjiang Province,Mudanjiang 157011,China)
Objective:To observe the effect of curcumin on prostate cancer PC-3 cell heat shock protein 27 (HSP27) expression and apoptosis,and discuss therapeutic mechanism of curcumin.Methods:RT-PCR of the HSP27 mRNA was implemented by the culture of RWPE-1,LNCaP,PC-3,and DU145 cell lines.Analysis was separately conducted in the control group,control vector group treated by dimethyl sulfoxide,and groups treated with 50 μmol·L-1or 25 μmol·L-12 μL curcumin.TUNEL staining,a way to evaluate PC-3 Cell apoptosis,and the expression of HSP27 mRNA in RT-PCR was observed.Results:Expression of LNCaP,PC-3 and DU145 HSP27 mRNA cells were significantly increased,compared with RWPE-1 cells,the difference was statistically significant (P<0.05).After curcumin treatment,the number of PC-3 Cell apoptosis detected by TUNEL was stronger at a 50 μmol·L-1curcumin concentration compared to that at a 25 μmol·L-1concentration,compared with the control group,the difference was statistically significant (P<0.05),and the HSP27 mRNAexpression detected by RT-PCR was stronger at a 50 μmol·L-1curcumin concentration compared to that at a 25 μmol·L-1concentration,compared with the control group,the difference was statistically significant (P<0.05).Conclusion:Curcumin induces apoptosis in PC-3 and inhibits HSP27 mRNA expression may be one mechanism of its anti-prostate cancer.
Prostate cancer;curcumin;PC-3 cell;heat shock protein 27;cell apoptosis
10.13313/j.issn.1673-4890.2015.9.011
2014-08-15)
*
徐雷,主治医师,研究方向:前列腺癌发生机制及生物学研究;E-mail:leixu1978@126.com