结直肠癌中PAQR3甲基化水平及mRNA表达的研究
2015-09-23宋艳敏李日恒张涛贾佳马芳赵立华河北大学临床学院河北保定07000河北大学附属医院普通外科河北保定07000
宋艳敏,李日恒,张涛,贾佳,马芳,赵立华(. 河北大学临床学院,河北 保定 07000;. 河北大学附属医院普通外科,河北 保定 07000)
结直肠癌中PAQR3甲基化水平及mRNA表达的研究
宋艳敏1,李日恒2,张涛2,贾佳2,马芳2,赵立华2
(1. 河北大学临床学院,河北 保定 071000;2. 河北大学附属医院普通外科,河北 保定 071000)
目的 研究结直肠癌组织中抑癌基因PAQR3 mRNA表达情况及甲基化水平,探讨PAQR3基因异常甲基化与结直肠癌的关系。方法 收集结直肠癌及正常组织标本54组,用逆转录-聚合酶链反应(RT-PCR)检测结直肠癌标本中PAQR3 mRNA表达水平;用甲基化特异性聚合酶链反应(MSP)法检测结直肠癌标本中PAQR3基因甲基化水平,用以分析PAQR3甲基化水平与临床病理资料的关系。结果 54组结直肠癌标本中PAQR3 mRNA表达降低发生率为57.4%(31/54),正常组织PAQR3 mRNA表达降低发生率为18.5%(10/54),表达差异有统计学意义(P= 0.000);癌组织PAQR3基因启动子甲基化发生率为33.3 %(18/54),正常组织PAQR3基因启动子甲基化率为5.6 %(3/54),二者差异有统计学意义(P= 0.000);PAQR3基因甲基化与年龄、分化程度、浸润深度、临床分期、淋巴结转移有关,与性别、部位无关。结论 结直肠癌组织中PAQR3表达降低,与其基因启动子发生高甲基化有关。
PAQR3;结直肠癌;甲基化;MSP
本文引用:宋艳敏, 李日恒, 张涛, 等.结直肠癌中PAQR3甲基化水平及mRNA表达的研究[J].医学研究与教育, 2015, 32(1): 55-60.
近年来,结直肠癌的发生率越来越高,已高居世界肿瘤恶性肿瘤第3位,死亡率第 4位。结直肠癌的早期发现、早期诊断、早期治疗对于结直肠癌患者生命及生活质量的提高具有重要意义。结直肠癌的发生是一个多因素、多步骤共同作用的结果。结直肠癌的发生与基因突变、异常甲基化等密切相关,基因启动子甲基化属于表观遗传学改变,是在DNA甲基化转移酶(DNA Methyltransferase,DNMT)的作用下,将S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)上的甲基基团共价结合到CpG二核糖酸的胞嘧啶的5碳位(5m-C)上的过程,基因在特定环境的刺激下发生甲基化,目的是保护DNA特定位点不受特定酶的影响而发生降解,进一步调节基因表达,此反应是可逆的,是肿瘤发生的早期事件[1-2]。因此检测基因甲基化为结直肠癌的早期诊断以及探讨发生机理提供了依据。通过研究PAQR3甲基化水平与结直肠癌的关系,进一步指导结直肠癌诊断及治疗。
1 材料与方法
1.1材料
1.1.1组织标本
54对结直肠癌组织、正常组织取自河北大学附属医院普通外科,收集标本时间为2013—2014年,纳入标准:患者术前均未接受过放化疗,其中男28例,女26例;直肠癌26例,结肠癌28例;年龄36~82岁,平均年龄59.69岁。术中立即取标本放置于液氮中,并于-80℃低温冰箱内保存,时间不超过6个月。
1.1.2试剂及检测仪器
高速冷冻离心机(德国Thermo Electron LED GmbH Am Kalkberg,Thermo Sorvall ST16R),全波长酶标仪(基因有限公司,EPOCH),全自动凝胶成像仪(中国容智创业,ChampGel 5000),实时荧光定量PCR仪(美国Applied Biosystems公司,7300),普通PCR仪器(美国Applied Biosystems公司,Veriti)。Omega E.Z.N.A.TM总RNA提取试剂盒、Vazyme Hiscript 第一链cDNA合成试剂盒、Vazyme Hiscript qRT PCR荧光定量试剂盒、E.Z.N.A.组织DNA提取试剂盒、QIAGEN EpiTect Fast DNA Bisulfite试剂盒、蛋白酶K、RNaseA均由石家庄市惠友生物科技有限公司提供,引物由上海生工生物工程股份有限公司合成提供,实验中所需的STE裂解液、SDS、氯仿、异戊醇、无水乙醇、Tris-饱和酚、酚/氯仿/异戊醇(25∶24∶1)、氯仿/异戊醇(24∶1)等均由河北大学附属医院中心实验室提供。
1.2方法
1.2.1组织RNA提取、反转录、PCR
1.2.1.1组织RNA提取 取30 mg的组织,液氮研磨,按照Omega E.Z.N.A.TM总RNA提取试剂盒方法提取RNA,取产物2μL于1%的琼脂糖凝胶电泳中,全自动凝胶成像仪下观察并记录结果,酶标仪检测含量(2000)及比值(OD∶1.9-2.0)合适后进行反转录,中途不能及时完成时将产物放置-20 ℃或-80 ℃低温保存,保存时间不超过3个月。
1.2.1.2RNA反转录 各取总RNA 1μL,根据Vazyme Hiscript 第一链cDNA合成试剂盒进行反转录,体系为Oligo dT 1μL,总RNA 1μL,RNase free ddH2O 6μL, 65 ℃预热10 min,冰上骤冷2 min。随后加入2×RT Mix 10μL,Hiscript Enzyme Mix 2μL,25 ℃,5 min;42 ℃,30 min;85 ℃,5 min,产物进行分装稀释,放置于-20 ℃,保存时间不超过6个月,用以进行RT-PCR反应。
1.2.1.3PCR PCR引物根据Primer premier 5.0设计,并通过Pubmed blast检测其特异性,反应体系20μL,PAQR3引物:5′-TCTGTATGCTTTGCTCTGTGGG-3′(F),5′-TTTGCCATTGCTGCGTGAG-3′(R),产物长度 252 bp。内参基因β-actin引物:5′-GTGGACATCCGCAAAGAC-3′(F),5′-AAAGGGTGTAACGCAACTAA-3′(R),产物长度:302 bp。模板cDNA 2μL,Mix 10μL,Rox 2μL,上下游引物2μL,灭菌蒸馏水4μL,反应条件:95 ℃,5 min;95 ℃,10 s ;60 ℃,32 s,40个循环;95 ℃,15 s;60 ℃,60 s;95 ℃,15 s。扩增后的产物进行琼脂糖凝胶电泳,全自动凝胶成像仪下分析。
1.2.2组织DNA提取、亚硫酸氢盐修饰、MSP
1.2.2.1酚/氯仿抽提法提取组织DNA 取30 mg组织研磨,根据酚/氯仿抽提法提取组织DNA,加入15μL的TE缓冲液,轻轻吹打混匀,随即在酶标仪上检测DNA含量,含量在1~2μg/μL(OD:1.8-1.9),取2μL DNA液、1μL 5×loading buffer混匀,在电压20 V,1%琼脂糖凝胶电泳下跑电泳30 min,在全自动凝胶成像仪下分析并记录DNA提取结果。
1.2.2.2亚硫酸氢盐修饰 根据QIAGEN 的EpiTect Fast DNA Bisulfit Kit 试剂盒进行甲基化处理,将DNA1μg、RNase-free water 10μL、Bisulfite Solution 85μL、DNA Protect Buffer 35μL组成的140μL体系混匀,在普通PCR仪上,95 ℃,5 min;60 ℃,20 min;95 ℃,5 min;60 ℃,20 min;20 ℃,30 min进行处理,结束后将体系转移至新的离心管中,加入310μL buffer BL,涡旋混匀后离心;加入250μL的无水乙醇,最大速度涡旋15 s,离心1 min,转移以上液体至MinElute DNA柱子及收集管,离心1 min,弃滤液,加入500μL的Buffer BW,离心1 min,弃滤液;加500μL Buffer BD,室温孵育15 min,离心1 min,弃滤液;加500μL Buffer BW,离心1 min,弃滤液;重复加入500μL Buffer BW,离心1 min,弃滤液;加入250μL的无水乙醇,离心1 min,将柱子转移至新的收集管中,离心1 min,柱子敞开盖子空气风干10 min,以蒸发残余液体;将柱子转移至新的离心管中,加入15μL的Buffer EB,室温静置1 min,离心洗涤DNA,分装稀释,-20 ℃保存,以进行MSP。
1.2.2.3甲基化特异性PCR(Methylation Specific PCR,MSP) 甲基化引物(M):5′-TTGTTGAAGAGCGCGTATTATATC-3′(F),5′-TAAAAAACCCGAAAATCTACTCGTA-3′(R)。产物长度:109 bp。非甲基化引物(U):5′-TTGTTGAAGAGTGTGTATTATATTGA-3′(F),5′-TAAAAAACCCAAAAATCTACTCATA-3′(R)。产物长度:109 bp。MSP反应体系25μL,模板 DNA 2.5μL,Mix 10μL,Rox 2μL,上下游引物4μL,灭菌蒸馏水4μL。反应条件:95 ℃,10 min;95 ℃,10 s;60 ℃,50 s,40个循环;95 ℃,15 s;60 ℃,60 s;95 ℃,15 s。扩增后的产物进行1%琼脂糖凝胶电泳,紫外分析仪分析。
1.3数据统计
根据统计软件SPSS 16.0,计数资料比较采用Fisher’s确切概率法进行统计分析,为双侧检验,结果以P<0.05为差异有统计学意义。
2 结果
2.1结直肠癌组织中PAQR3 mRNA RT-PCR凝胶电泳
PAQR3 mRNA RT-PCR结果显示,癌组织中PAQR3 mRNA水平表达降低,甚至不表达,正常组织中高表达(图1);54组标本中有31个结直肠癌组织中PAQR3 mRNA水平表达降低,10个正常组织中PAQR3 mRNA水平表达降低,差异有统计学意义(P=0.000)(图2)。

图1 组织PAQR3 mRNA 扩增后的凝胶电泳
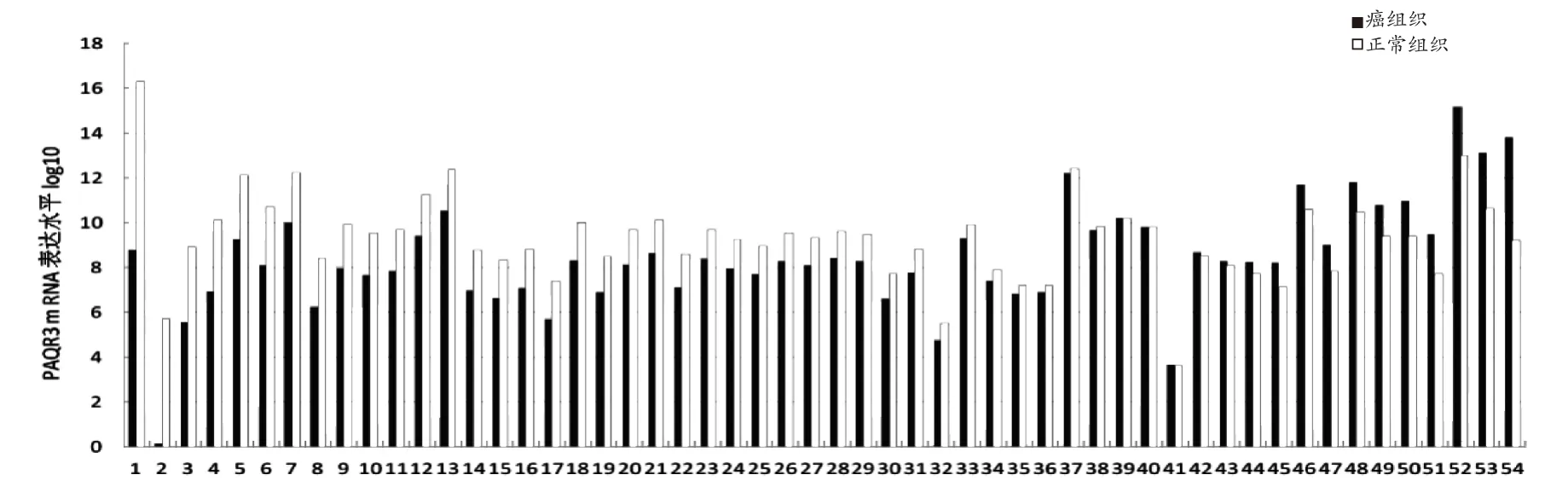
图2 PAQR3在癌组织及正常组织中RT-PCR表达
2.2结直肠癌组织中PAQR3基因甲基化状态
在31组PAQR3 mRNA 表达降低的患者中,有12组结直肠癌组织中PAQR3基因发生部分甲基化,6组发生完全甲基化,13组未发生甲基化(图3),甲基化引物扩增,且非甲基化引物扩增者为甲基化阳性;甲基化引物未扩增,非甲基化引物扩增者为甲基化阴性。在其余23组PAQR3表达未明显下降的结直肠癌患者中,有3组癌组织发生部分甲基化,20组患者未发生甲基化,差异有统计学意义(P=0.000)。

图3 部分结直肠癌组织PAQR3基因MSP电泳
2.3PAQR3基因甲基化与结直肠癌临床资料之间的关系
统计软件通过Fisher’s确切概率法检验进行检测,PAQR3 DNA 甲基化水平与性别、部位无关,与年龄、分化程度、浸润深度、临床分期、有无淋巴结转移差异有统计学意义,见表1。
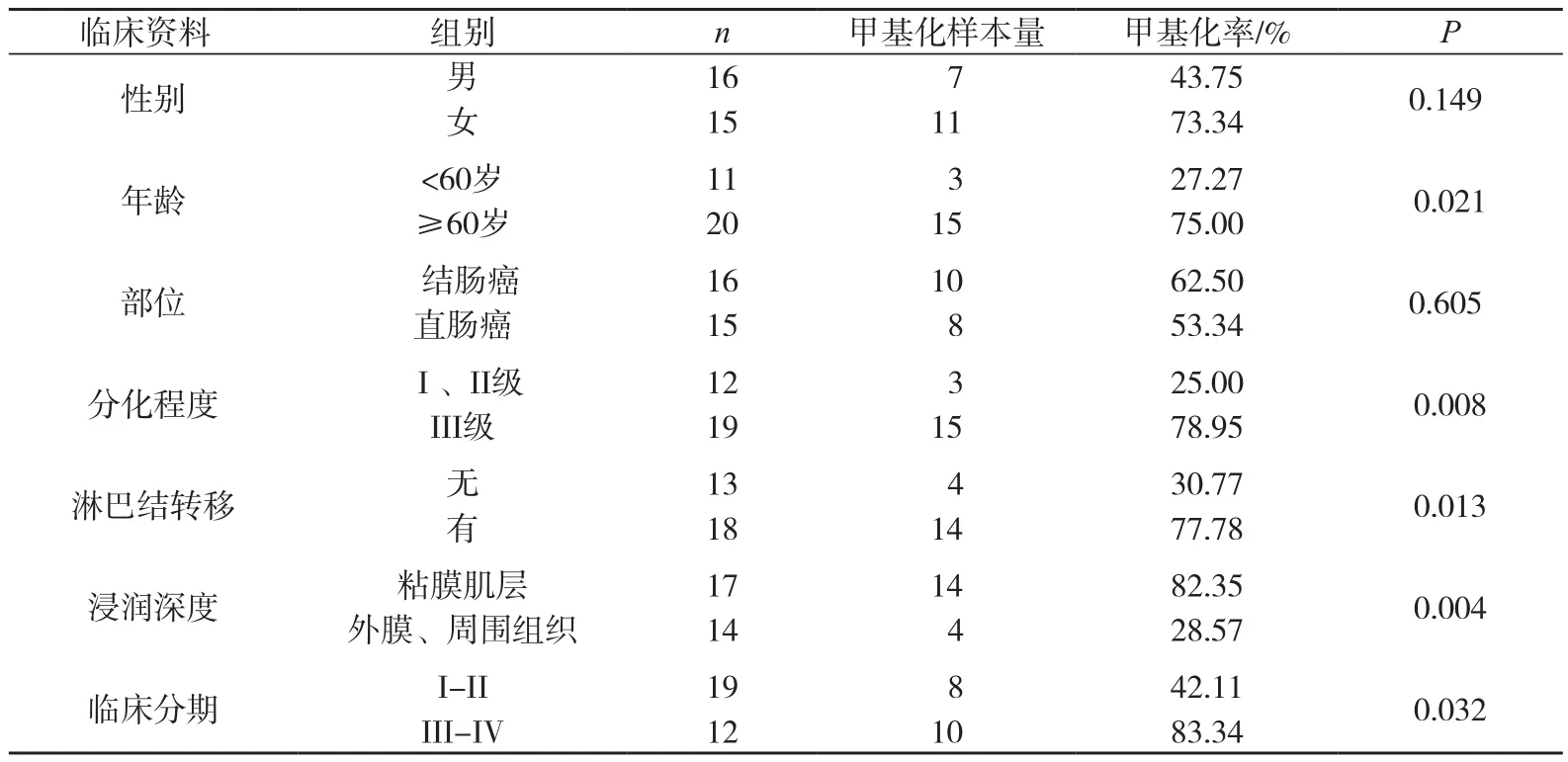
表1 结直肠癌组织中PAQR3基因甲基化水平与临床资料之间的关系
3 讨论
基因甲基化是一个动态可逆的过程,基因异常甲基化是肿瘤发生的早期事件,许多基因甲基化与结直肠癌的发生有关。PAQR3是2009年被陈雁教授发现的,在结直肠癌中发挥抑癌基因的作用,参与了细胞的各种信号通路,影响能量代谢、细胞分裂增殖、分化以及生殖细胞成熟等生物学过程,又名PKTG,可以编码出37 ku,N端朝胞质、C端朝细胞器、位于高尔基体膜上的7次跨膜蛋白,能负性调控Ras/Raf/MEK/ERK信号通路,此信号通路是经典的丝裂原活化蛋白激酶级联信号途径之一,PAQR3竞争性结合于RAF,干扰RAF与下游信号分子、底物的结合[3],感受细胞外信号、控制细胞增殖分化及存活,作用就是将胞外的刺激信号传递至胞内,达到调控细胞增殖、分化、凋亡及细胞恶性转化、癌症的发生、发展等生理过程的目的[4-6]。目前已被证实在结直肠癌组织中发挥抑癌作用,PAQR3表达缺失减少了敲除基因裸鼠的存活时间[7]。人类黑色素瘤A375中,PAQR3过表达能明显抑制细胞的扩增及恶性转化,裸鼠成瘤实验中,通过si-RNA技术使PAQR3重新表达能明显抑制皮下成瘤的作用,其下游被异常激活的ERK活性明显受到抑制[8],除此之外,PAQR3也被证明在胃癌、乳腺癌等肿瘤组织中表达降低,PAQR3能增强乳腺癌细胞SK-BR-3对表柔比星的敏感性[9]。
PAQR3基因沉默的机制仍不清楚,检测结直肠癌组织中基因启动子甲基化水平,来探讨它们之间的关系,研究显示,PAQR3在结直肠癌组织中较正常组织表达降低,发生率为57.4%,MSP显示,PAQR3在结直肠癌组织中发生甲基化的概率为33.3%,DNA 甲基化水平与性别、部位无关,与年龄、分期、分化程度、浸润深度、有无淋巴结转移等差异有统计学意义,随着年龄的增大,分期越高,分化程度越低、淋巴结发生转移者,PAQR3 基因启动子甲基化水平越高;反之,PAQR3基因启动子甲基化水平越低。基因甲基化与年龄有关,随着年龄的增大,机体甲基化水平越高,年龄相关的甲基化水平改变的机制仍不是很明确,但普遍认为是地理环境以及随机抽样所致[10]。PAQR3甲基化水平高与分期、分化程度、浸润深度、有无淋巴结转移有关,是由PAQR3沉默所致。
分析概率低的原因,结直肠癌的形成是一个复杂、涉及多个基因、多种机制的过程,PAQR3的表达降低只是其中的一个因素,而甲基化导致的PAQR3基因表达沉默或缺失只是其中一个因素,所以发生的概率偏低;此外可能受地域、样本量等因素的影响。通过研究证明,PAQR3在结直肠癌中的表达降低及缺失确实与基因启动子甲基化有关,虽然发生率低,但在庞大的结直肠癌基数中,了解这一机制也能为疾病的诊断及治疗提供指导作用。
此外,后续将会检测多个结直肠细胞系中PAQR3的甲基化水平,通过甲基化转移酶抑制剂逆转甲基化[11],探讨逆转后PAQR3表达水平及在裸鼠成瘤方面的影响,进一步为结直肠癌的诊断和治疗提供一些依据。
[1] JAVIER C F, AZUARA D, BERENGUER-LLERGO A, et al. DNA methylation biomarkers for noninvasive diagnosis of colorectal cancer[J]. Cancer Prevention Research, 2013, 6(7): 656-665.
[2] HENRI S T, DANIEL M C, MICHAEL B D, et al. Nutritional factors and gender influence age-related DNA methylation in the human rectal mucosa[J]. Aging Cell, 2013, 12(1): 148-155.
[3] XIE Xiaoduo, ZHANG Yixuan, JIANG Yuhui, et al. Suppressive function of RKTG on chemical carcinogen-induced skin carcinogenesis in mouse[J]. Carcinogenesis, 2008, 29(8): 1632-1638.
[4] FENG Lin, XIE Xiaoduo, DING Qiurong, et al. Spatial regulation of Raf kinase signaling by RKTG[J]. Proc Natl Acad Sci USA,
2007, 104(36): 14348-14353.
[5] CANO E, MAHADEVAN L C. Parallel signal processing among mammalian MAPKs[J]. Trends Biochem Sci, 1995, 20(3): 117-122.
[6] FAN Fengjuan, FENG Lin, HE Jing, et al. RKTG sequesters B-Raf to the Golgi apparatus and inhibits the proliferation and tumorigenicity of human malignant melanoma cells[J]. Carcinogenesis, 2008, 29(6): 1157-1163.
[7] WANG Xiao, LI Xuebing, FAN Fengjuan, et al. PAQR3 plays a suppressive role in the tumorigenesis of colorectal cancers[J]. Carcinogenesis, 2012, 33 (11): 2228-2235.
[8] 陈雁, 谢小多. RKTG 基因功能研究[J]. 细胞生物学杂志, 2009, 31(1): 9-14.
[9] 黄剑波, 罗鑫荣, 孔令泉, 等. PAQR3 对乳腺癌细胞SK-BR-3的表柔比星敏感性的影响[J]. 第三军医大学学报, 2013,35(16): 1658-1662.
[10] LILLYCROP K A, HOILE S P, GRENFELL L, et al. DNA methylation, ageing and the influence of early life nutrition[J]. Proceedings of the Nutrition Society, 2014, 73(3): 413-421.
[11] 高曰文, 朱晨宇, 朱耀明, 等. 盐酸普鲁卡因对人结直肠癌 HT-29 细胞的作用及机制[J]. 肿瘤防治研究, 2011, 38(2): 137-140.
(责任编辑:刘俊华)
The methylation and mRNA expression of PAQR3 in colorectal cancer
SONG Yanmin1, LI Riheng2, ZHANG Tao2, JIA Jia2, MA Fang2, ZHAO Lihua2
(1. College of Clinical Medicine, Hebei University, Baoding 071000, China; 2. Department of General Surgery, Affiliated Hospital of Hebei University, Baoding 071000, China)
Objective To investigate the relationship between the methylation level of PAQR3 and colorectal cancer, the methylation level and mRNA expression of PAQR3 gene in colorectal cancer were detected. Methods 54 colorectal cancers and 54 colorectal normal tissues were collected to detect the expression of mRNA level by reverse transcriptase PCR(RT-PCR), the methylation level of PAQR3 gene were detected by Methylation Specific PCR(MSP), which were used to analyze the relationship between methylation of PAQR3 and clinical data. Results Expression of PAQR3 mRNA in 54 normal tissues were significantly higher than that in 54 colorectal cancer tissues , the expression rates were 18.5%(10/54) and 57.4%(31/54), there was significant difference between cancer and normal tissues(P= 0.000).The PAQR3 gene promoter methylation rate of colorectal cancer and colorectal normal tissues were 33.3%(18/54)and 5.6 %(3/54), there was significant difference between cancer and normal tissues(P= 0.000).There was significant difference in age, differentiation, infiltration, clinical stage and the metastasis of lymph node in colorectal cancer, but not in sex and location.Conclusion PAQR3 expression can be reduced in colorectal cancer, PAQR3 gene promoter hypermethylation may play an important role in oncogenesis of colorectal cancer.
PAQR3; colorectal cancer; methylation; MSP
10.3969/j.issn.1674-490X.2015.01.013
R656.9
A
1674-490X(2015)01-0055-06
2014-11-19
宋艳敏 (1986—),女,河北沧州人,在读硕士。 E-mail: songyanmin1211@sina.com
李日恒 (1972—), 男,黑龙江齐齐哈尔人,副主任医师,博士,硕士生导师,主要从事结直肠及血管外科疾病的基础及临床研究。E-mail: LRH1120@21cn.com
