‘紫梗籽银’桂种子内源抑制物质分析
2015-09-16施婷婷杨秀莲王良桂
施婷婷,杨秀莲,王良桂
(南京林业大学风景园林学院,江苏 南京 210037)
‘紫梗籽银’桂种子内源抑制物质分析
施婷婷,杨秀莲,王良桂
(南京林业大学风景园林学院,江苏 南京 210037)
以‘紫梗籽银’桂(Osmanthusfragrans′Zigengziyin′)种子为试材,对其内果皮、种实内源抑制物质进行提取、生物测定,并采用GC-MS进行鉴定。结果表明:①‘紫梗籽银’桂种子内果皮、种实均含有抑制种子萌发和幼苗生长的物质,且内果皮、种实中各分离相的抑制效果均不相同。其中石油醚相抑制作用最弱,乙酸乙酯相和甲醇相抑制作用较强。②GC-MS 鉴定结果显示,‘紫梗籽银’桂种子内果皮、种实中存在多种抑制物质,包括棕榈酸、油酸、9,12-十八碳二烯酸等发芽抑制物质,主要为脂肪酸类物质。
‘紫梗籽银’桂;种子;内源抑制物质;发芽率;幼苗生长;GC-MS
许多植物的种子都存在休眠现象,而种子的休眠原因也是多种多样的,主要包括了种皮的吸水障碍、种胚的休眠以及种子中存在萌发抑制类物质等原因,其中由种子萌发抑制物引起的休眠是最常见的种子休眠类型之一。植物种子的内源抑制物质种类非常多,除脱落酸(ABA)外,还包括了有机酸、酚类、醛类、不饱和内酯类,以及一些气体类物质,如氢氰酸、乙烯、芥子油、氨等[1]。目前,关于植物种子内源抑制物质的研究已取得了很大进展,如青钱柳(Cyclocaryapaliurus)[2]、四川牡丹(Paeoniadecomposita)[3]、秦艽(Gentianamacrophylla)[4]等。而关于桂花种子内源抑制物质的研究少有研究报道。
‘紫梗籽银’桂是桂花银桂品种群中的一个品种,其花香气清幽淡雅,且每年可开花2~3次,深受人们的喜爱。同时,‘紫梗籽银’桂花后结实率高,果实丰满,性状稳定,是我国重要的园林绿化树种。然而其种子具有明显的休眠习性,这给‘紫梗籽银’桂的苗木生产带来了很多不便。杨秀莲等[5]曾初步探讨了‘紫梗籽银’桂种子的休眠原因,发现‘紫梗籽银’桂种子坚硬的外种皮不是引起休眠的原因,推测种子的休眠是由种子中所含的抑制物质引起。故本研究以‘紫梗籽银’桂为材料,从抑制种子萌发的内源抑制物质入手,分别比较不同有机溶剂相中抑制物质的作用,并通过气相色谱-质谱联用(GC-MS)技术对抑制物质成分进行初步分析。
1 材料与方法
1.1 试验材料
2007年5月底,于南京林业大学校园内采集完全成熟的‘紫梗籽银’桂种子;于南京市蔬菜种子公司购买绿优1号白菜种子(白菜种子纯度95%,净度98%,发芽率85%以上)。
1.2 种子不同部位内源抑制物质的提取
取‘紫梗籽银’桂种子内果皮和种实各10 g置于250 mL容量瓶中,用80%的甲醇溶液200 mL,于1~4 ℃的恒温条件下密闭浸提48 h,然后将所得滤液在35 ℃下减压浓缩后定容至1 g·mL-1(以每mL浓缩液中含有原材料的量计算),最后置于1~4 ℃冰箱中保存备用。
1.3 种子不同部位内源抑制物质的初步分离
参照黄耀阁等[6]系统溶剂法,将‘紫梗籽银’桂种子不同部位内源抑制物质的粗提液分为石油醚相、乙醚相、乙酸乙酯相、甲醇相和水相。即将‘紫梗籽银’桂内果皮和种实2部分烘干(35 ℃),分别取磨碎后过1 mm筛的粉末各15 g,各加入5倍体积的80%甲醇,在1~5 ℃的恒温条件下密闭浸提,24 h后过滤,重复浸提3次,混合3次所得的浸提液,再加入等量石油醚,相同条件下萃取3次,得到石油醚相和水相;然后在水相浸提液加入等量乙醚,相同条件下萃取3次,得到乙醚相和水相;再在水相浸提液中加入等量乙酸乙酯萃取,得到乙酸乙酯相与水相;再将水相浸提液在65 ℃减压蒸干,除去水分得到干物质后,用甲醇溶解过滤,得到甲醇相和水相。最后将各有机相溶液分别置于旋转蒸发器ZFQ85B上进行浓缩蒸发,定容至10 mL,置于1~4 ℃冰箱中备用。
1.4 种子不同部位内源抑制物质各分离物活性的生物测定
将上述所得各分离相(0.2 g·mL-1)和稀释1倍后的各有机相溶液(0.1 g·mL-1)进行生物测定。在直径9 cm的培养皿内分别加入‘紫梗籽银’桂种子内果皮和种实各分离相的提取液3 mL,白菜籽50粒,待各分离相有机溶剂完全挥发(水相除外)后,每个培养皿内再加入蒸馏水3 mL,并以同体积蒸馏水作为对照,每个处理3次重复。置于25 ℃恒温光照培养箱内,进行白菜籽发芽试验,每天记录发芽数,48 h后统计白菜籽的发芽率(以露出胚根为发芽的标准),72 h后测其苗高和根长。
1.5 GC-MS鉴定方法
对‘紫梗籽银’桂种子内果皮和种实甲醇浸提液进行GC-MS鉴定,测定在中国林业科学院林产化学研究所分析测试中心质谱室进行鉴定。参照韩宝瑞等[7]鉴定方法:仪器型号为美国Agelient 6890N/5973N GC-MS(气谱-质谱)联用仪;气谱条件:HP-5MS柱,30 m×0.32 mm×0.25 um;升温程序100~250 ℃(10 min);程序升温10 ℃·min-1;进样1 uL;分流比100∶1;载气为氦气;汽化室温度:260 ℃。质谱条件:离子源EI;源温230 ℃;电离电压 70 eV。由计算机控制的库存信号检查各个成分的质谱图并与标准库谱图核对,以面积归一化法计算出各成分的相对百分含量。
2 结果与分析
2.1 内果皮和种实中各分离相对白菜种子发芽率和幼苗生长的影响
2.1.1 内果皮和种实中各分离相对白菜种子发芽率的影响 由图1可见,除石油醚相外,‘紫梗籽银’桂内果皮和种实的乙醚相、乙酸乙酯相、甲醇相以及水相均对白菜籽的发芽有抑制作用,且方差分析结果表明,‘紫梗籽银’桂内果皮和种实内源抑制物质浸提液中除石油醚相对白菜籽发芽率的影响不显著外,其他各相与对照相比均达到极显著差异。内果皮各分离相浸提液中乙酸乙酯相的抑制作用最强,浸提液0.1 g·mL-1、0.2 g·mL-1抑制率分别达到90.6%、94.8%;而以乙醚相浸提液的抑制活性最弱,仅为8.3%、21.67%;石油醚相对白菜籽发芽基本没有抑制作用,浸提液0.1 g·mL-1处理的白菜籽发芽率比对照降低了3.15%,浸提液0.2 g·mL-1处理的白菜籽发芽率比对照提高了2.08%。相比内果皮,种实各分离相浸提液对白菜籽的发芽抑制作用更大,种实各分离相浸提液中也是乙酸乙酯相的抑制作用最强,浸提液0.1 g·mL-1、0.2 g·mL-1的抑制率分别达到92.7%、95.8%;以水相浸提液的抑制活性最弱,仅为20.8%、28.1%;石油醚相对白菜籽发芽基本没有抑制作用,其浸提液0.1 g·mL-1处理的白菜籽发芽率比对照降低了6.25%,而浸提液0.2 g·mL-1处理的白菜籽发芽率比对照提高了2.08%。据此初步证实‘紫梗籽银’桂内果皮和种实均含有内源抑制物质,而且不同部位提取的不同有机相对白菜籽发芽率的抑制程度各有不同,种实各分离相对白菜籽发芽率的抑制作用的强弱顺序为:乙酸乙酯相>甲醇相>乙醚相>水相>石油醚相,而内果皮各分离相对白菜籽发芽率的抑制作用的强弱顺序则为:乙酸乙酯相>甲醇相>水相>乙醚相>石油醚相。

图1 ‘紫梗籽银’桂内果皮和种实中抑制物对白菜发芽率的影响
图1结果表明:‘紫梗籽银’桂内果皮和种实浸提液的发芽测定结果大致相同,但各有机相对白菜籽发芽的抑制作用不同。‘紫梗籽银’桂内果皮和种实中的抑制物质均主要集中在乙酸乙酯相和甲醇相中,对白菜种子发芽起到明显抑制作用;而其石油醚相均与对照无差异,说明石油醚相中也许不存在抑制物质。
2.1.2 内果皮和种实中各分离相对白菜籽幼苗生长的影响 从图2可以看出,‘紫梗籽银’桂内果皮和种实各分离相对白菜籽幼苗生长的抑制作用差异达到极显著水平。‘紫梗籽银’桂内果皮、种实各相对白菜籽苗高抑制作用的强弱顺序为甲醇相>乙酸乙酯相>水相>乙醚相>石油醚相,而对白菜根长的抑制作用的强弱顺序则为乙酸乙酯相>甲醇相>乙醚相>石油醚相>水相。特别是乙酸乙酯和甲醇相处理的白菜籽苗高生长均为0,对根长的抑制率也都达到了85%以上。同时,各相处理浓度越大,对白菜籽幼苗生长的抑制作用也越强。但通过方差分析和多重比较结果表明,对白菜苗高生长的抑制作用除不同浓度间种实乙醚相差异显著外,其他各相浓度间差异均不显著;对白菜根系生长的抑制作用不同浓度间内果皮乙醚相、水相差异极显著外,其他各相浓度间差异也均不显著。而在相同浓度相同有机相的条件下,种实浸提物对白菜幼苗生长的影响均高于种皮提取物。如内果皮水相0.1 g·mL-1、0.2 g·mL-1处理的白菜苗高生长比对照分别减少了54.3%、60%,白菜菜苗根长分别降低9.7%、24.9%;而种实水相在相同浓度处理下白菜苗高生长量降低了77.2%、81.8%,根长减少了50.1%、59.7%。
由此可以说明,‘紫梗籽银’桂内果皮和种实各分离相对白菜籽幼苗生长也均有抑制作用,且浓度越大,抑制作用越强。其中相同浓度条件下,种实浸提液对白菜籽幼苗生长的抑制作用比内果皮显著。但不管是种实还是内果皮,其甲醇相和乙酸乙酯相对白菜籽幼苗生长的抑制作用最强,表明内果皮和种实的甲醇相和乙酸乙酯相中存在着大量的抑制物质,且这些物质的抑制活性都较强。
2.2 种子不同部位提取的有机化合物种类和相对含量
‘紫梗籽银’桂种子的内果皮、种实提取液经GC-MS分析得到的总离子色谱图见图3、图4。从图中可看出两者离子流色谱图的峰型差异很大,个别物质保留时间也不尽相同,但重现性较好。通过质谱系统检索,按峰面积归一化法计算得出各成分相对百分含量,分析出离子流程图中峰面积和相似度较大、可能具有抑制作用的有机化合物共有9种(表1)。‘紫梗籽银’桂种实中鉴定出的有机化合物主要为脂肪酸类和苯胺类物质,有油酸(4.208%)、棕榈酸(1.817%)、9、12-十八碳二烯酸(1.84%)和2,4-二甲苯胺(21.689%)、3、4-二甲苯胺(4.427%)等;内果皮浸提液中鉴定出的有机化合物也为脂肪酸类物质,可能有抑制作用的也是棕榈酸(4.691%)、油酸(4.022%)、9、12-十八碳二烯酸(2.264%)和2,4-二甲苯胺(24.248 %)、3、4-二甲苯胺(18.506 %)等。由此可知,‘紫梗籽银’桂种子的内果皮和种实中提取的抑制物质种类比较少,主要是一些脂肪酸类和苯胺类物质,且种实中提取的有机物种类多于内果皮。
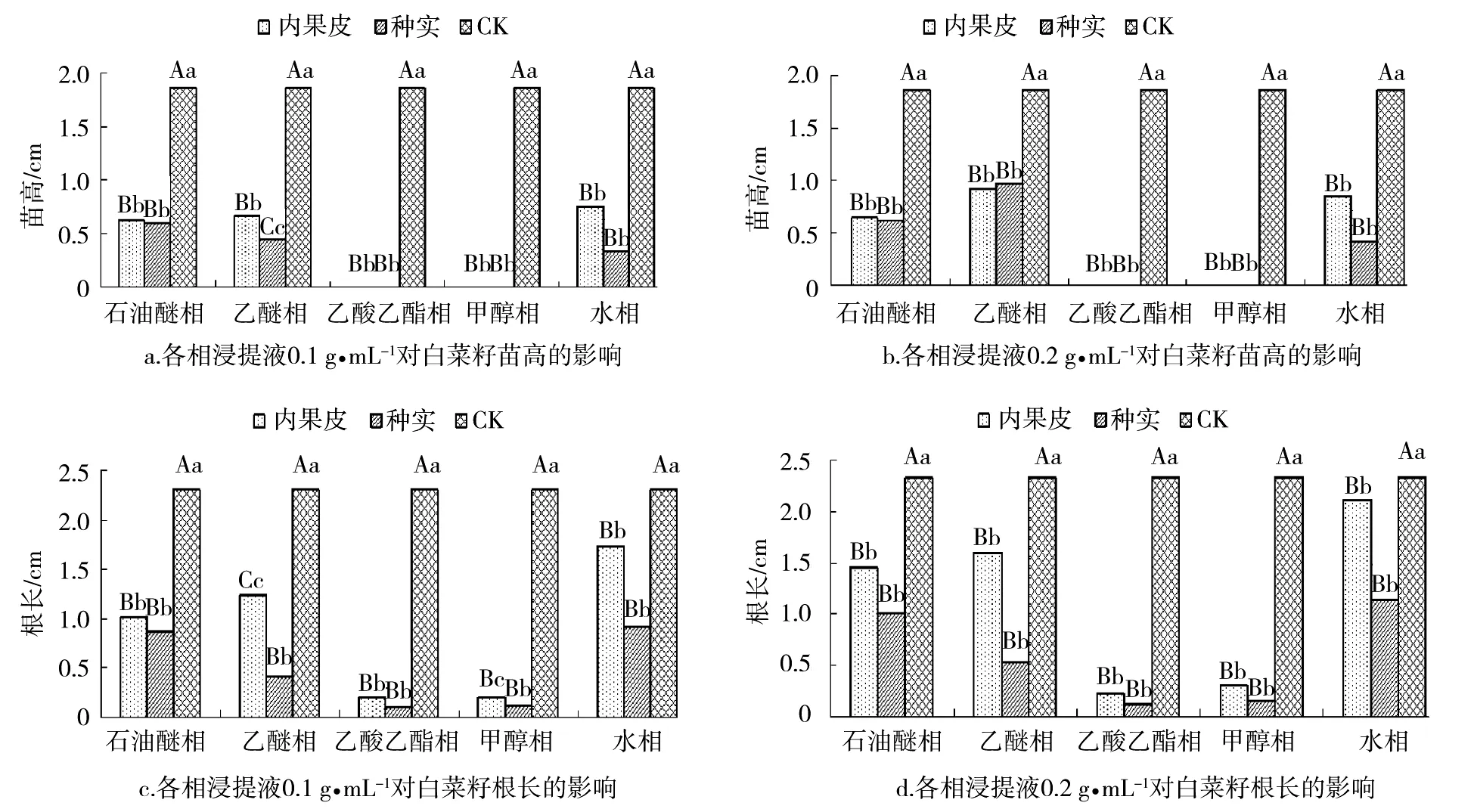
图2 ‘紫梗籽银’桂内果皮和种实中抑制物对白菜籽幼苗生长的影响
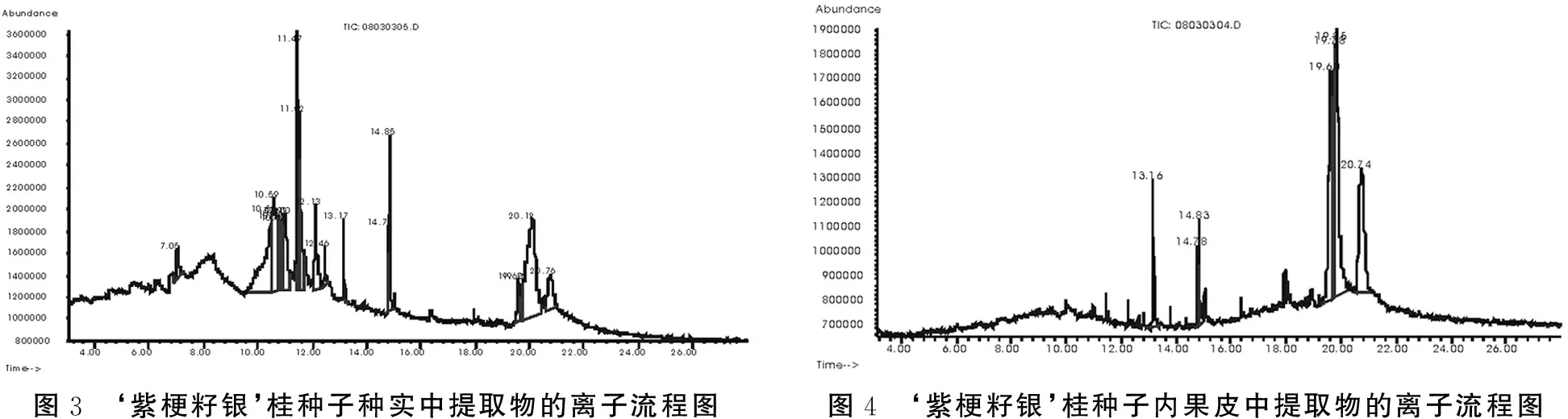
图3 ‘紫梗籽银’桂种子种实中提取物的离子流程图图4 ‘紫梗籽银’桂种子内果皮中提取物的离子流程图

表1 内果皮和种实甲醇浸提液中有机化合物种类及相对含量
3 结论与讨论
‘紫梗籽银’桂种子不同部位浸提液对白菜籽的发芽率以及苗高、根长的生长均有显著的抑制作用。且内果皮和种实浸提液的白菜种子发芽以及幼苗生长测定结果变化趋势大致相同,但各有机相对白菜籽发芽及幼苗生长的抑制作用不同。在相同浓度处理下,‘紫梗籽银’桂内果皮和种实各分离相对白菜籽发芽率以及苗高、根长生长的抑制作用的强度都存在一定差异。其中,无论是‘紫梗籽银’桂的内果皮还是种实部分,其乙酸乙酯相和甲醇相对白菜籽发芽率以及苗高、根长生长的抑制作用均最强烈,尤其是对苗高生长的抑制率达到100%,故认为‘紫梗籽银’桂内果皮和种实的乙酸乙酯相或甲醇相中存在着某些萌发抑制物质,这些物质对种子的萌发及其生长的抑制活性最强。同时,虽然不同浓度间抑制作用的差异不显著(可能是由于浓度梯度比较小),但还是可以看出抑制作用会随着各相处理浓度的增大而增强,这与其他植物[8-9]抑制物研究中的结论相符合。‘紫梗籽银’桂内果皮和种实中各有机相的抑制作用或程度表现不同的原因可能由以下几方面引起:一是内果皮和种实的乙醚相、乙酸乙酯相、甲醇相和水相中萌发抑制物的种类,及其含量存在差异;二是各抑制物的抑制能力不尽相同。许传莲等[10]也曾提出一种植物种子中可能存在多种抑制物质,但起关键作用的可能仅有一种或几种,对白菜种子起抑制作用的质量浓度对该植物种子可能无抑制作用,故‘紫梗籽银’桂种子中所含抑制物对其自身萌发是否存在抑制作用,其自身所含抑制物的质量浓度效应等均有待进一步研究。
植物种子中存在内源抑制物质是导致种子休眠的一个重要原因,相关研究也有许多。紫椴种子中存在壬酸、辛酸、棕榈酸、十五烷酸等发芽抑制物质[11]。青钱柳种子中鉴定到的抑制物中也包括了酸、辛酸、棕榈酸、邻苯二甲酸二乙酯和顺式-9,12-十八碳二烯酸等发芽抑制物质[2]。刘艳[12]指出梭梭种子中的萌发抑制物质主要是有机酸和酚类物质。于海莲等[13]从南方红豆杉种子甲醇浸提液中分离检测到的有机物质主要为有机酸类、酯类、胺类、醇类和酮类等。本试验中,经GC-MS分析鉴定结果显示,‘紫梗籽银’桂内果皮和种实中存在多种有机化合物,这些化合物主要以脂肪酸类(油酸、棕榈酸和十八烯酸)、苯胺类(邻、间二甲苯胺)为主,它们对种子萌发都有抑制作用,但它们的作用机制和作用方式还不清楚。可见种子中的内源抑制物种类具有多样性,因此在考虑内源抑制物对种子休眠的影响时,不能简单地认为是某种抑制物质作用的结果,探究哪一种或几种真正起抑制作用还有待于深入研究。而且本次试验由于受气相色谱数据分析软件的限制,还有一部分含量较高但匹配度低于70%的化合物,至今未能明确其主要成分,其种子萌发是否具有抑制作用还有待进一步分析。
[1]孙佳,郭江帆,魏朔南.植物种子萌发抑制物研究概述[J].种子,2012,31(4):57-61.
[2]尚旭岚,徐锡增,方升佐.青钱柳种子休眠机制[J].林业科学,2011,47(3):68-74.
[3]宋会兴,刘光立,高素萍,等.四川牡丹种子浸提液内源抑制物活性初探[J].园艺学报,2012,39(2):370-374.
[4]郭江帆,孙佳,魏朔南.秦艽种子内源萌发抑制物的初步探究[J].种子,2013,32(7):39-43,49.
[5]杨秀莲,丁彦芬,甘习华.‘紫梗籽银’桂种子休眠原因的初步探讨[J].江苏林业科技,2007,34(6):18-20,45.
[6]黄耀阁,崔树玉,鲁歧,等.西洋参种子抑制物质的初步研究[J].吉林农业大学学报,1994,16(2):9-14.
[7]韩宝瑞,黄耀阁,李向高.西洋参果肉中的六种发芽抑制物质[J].特产研究,2000(1):13-17.
[8]史锋厚,沈永宝,施季森.南京椴种子发芽抑制物研究[J].福建林学院学报,2007,27(3):222-225.
[9]杨勇,刘光立,宋会兴,等.四川牡丹胚乳浸提液对油菜种子萌发与幼苗生长的影响[J].西南农业学报,2013,26(1):89-92.
[10]许传莲,崔树玉,张崇禧,等.人参种子不同后熟期抑制物质的动态分析[J].人参研究,1996(3):26-28.
[11]王海南.紫椴种子休眠机理及休眠解除技术的研究[D].哈尔滨:东北林业大学,2012.
[12]刘艳.梭梭种子内源抑制物质及萌发生理生化变化研究[D].北京:北京林业大学,2007.
[13]于海莲,李凤兰,赵翠格,等.南方红豆杉种子发芽抑制物质的初步研究[J].北京林业大学学报,2009(5):78-83.
The Analysis of Inhibitor Substance for Seeds ofOsmanthusfragrans′Zigengziyin′
SHI Ting-ting,YANG Xiu-lian,WANG Liang-gui
(CollegeofLandscapeArchitecture,NanjingForestryUniversity,Nanjing210037,Jiangsu,China)
WithOsmanthusfragrans′Zigengziyin′ seeds as the test materials,its endocarp and endogenesis inhibitory substance was extracted,bioassayed and then identified by GC-MS.The result indicated that:①there were some substance inhibiting seed germination and seedling growth in both endocarp and endogenesis ofO.fragrans′Zigengziyin′ seeds,and the inhibitory effect of disperse phases in endocarp and endogenesis were different. Among these the inhibition of petroleum ether phase was weakest,while the ethyl acetate phase and methanol phase had higher inhibitory effects.②The GC-MS results show that there were many inhibiting substances in both endocarp and endogenesis,including some germination inhibiting substances,such as Palmitic acid,oleic acid,9,12-octadecaienoic acid,etc,fatty acid are the major ingredients.
Osmanthusfragrans′Zigengziyin′;seeds;inhibitory substance;germination rate;seedling growth;GC-MS
2014-07-05;
2014-08-28
江苏省科技支撑项目(BE2011367);江苏省高校优势学科建设工程基金资助项目(PAPD)
施婷婷(1989—),女,江苏南通人,南京林业大学风景园林学院硕士研究生,从事园林植物应用研究。E-mail:shitingting313@163.com。
王良桂,教授,博导。E-mail:wlg@nifu.com.cn。
10.13428/j.cnki.fjlk.2015.02.023
S685.13
A
1002-7351(2015)02-0103-05
