红菇子实体多糖抑菌活性研究
2015-09-16黄荣城许俊凰
李 云,黄荣城,许俊凰
(韩山师范学院生物系,广东 潮州 521041)
红菇子实体多糖抑菌活性研究
李 云,黄荣城,许俊凰
(韩山师范学院生物系,广东 潮州 521041)
以红菇子实体为原料,采用超声波方法提取水溶性多糖,从中分离纯化了3个组分(R1、R2、R3),研究其对多种敏感菌的抑菌活性。结果表明:组分R1具有明显的抑菌活性,能够抑制细菌,其中对革兰氏阴性菌抑菌活性强于革兰氏阳性菌,对酵母和霉菌无抑制效果;而R2无抑菌活性,R3抑菌活性弱。组分R1对各供试菌株的最小抑制质量浓度分别为金黄色葡萄球菌2.5 mg·mL-1,藤黄微球菌10 mg·mL-1,蜡样芽孢杆菌5 mg·mL-1,枯草芽孢杆菌10 mg·mL-1,大肠杆菌1.0 mg·mL-1,铜绿假单胞菌1.25 mg·mL-1,痢疾志贺氏菌1.25 mg·mL-1;具有较好的耐热性和较宽的pH适用范围,在80 ℃处理30 min和pH 6~10都能维持很好的抑菌活性;其抑菌作用方式是杀菌,对菌体无溶菌作用。
红菇;子实体多糖;抑菌作用
红菇(Russulasp.)是一种著名的野生食药用菌,常与壳斗目等种子植物形成外生菌根,菌根的形成扩大了宿主植物根系的吸收表面积,增强其对营养物质的吸收能力,促进植物体内的水分运输,提高抗旱性和抗逆性,是林木生长的重要因子[1]。红菇主要分布在广东、福建、云南和贵州等地区,目前尚无法人工栽培,野生资源缺乏保护性开发而日渐稀缺。红菇是粤东梅州地区著名土特产,主要分布于蕉岭至大埔一带山地林间,其子实体在民间有悠久的食用历史,不仅味道鲜美,而且因其被认为具有药用保健的功效,倍受消费者推崇。陈新华[2]通过对红菇子实体rDNA 的ITS和28S rDNA序列比较分析,鉴定粤东商品红菇属于灰肉红菇(Russulagriseocarnosa),目前尚未见到分离出经分子鉴定纯培养菌种的报道。
多糖是食药用菌类重要的生理活性物质,食药用菌多糖除具有抗肿瘤,免疫调节,抗炎等生理作用外,还具有抑菌的效果[3]。体外和动物实验证实,红菇子实体多糖具有抗氧化、抑制癌细胞、降血糖和血脂等生物活性作用[4-5],而对红菇多糖抑菌活性的研究较少。本研究以灰肉红菇为原料,采用超声波方法提取水溶性多糖,研究了其对多种敏感菌的抑菌活性及相关性质,为进一步研究了解红菇的价值提供参考。
1 材料与方法
1.1 材料
野生红菇子实体采集于广东省梅州市焦岭县山地林间,子实体于45 ℃烘箱干燥后,粉碎过40目筛,筛粉干燥保藏备用。
敏感菌供试菌株:大肠杆菌(Escherichiacoli)(ATCC 8099)、铜绿假单胞菌(Pseudomonasaeruginosa)(ATCC 15442)、金黄色葡萄球菌(Staphylococcusaureus)(ATCC 6538)、白假丝酵母(Candidaalbicans)(ATCC 10231)、黑曲霉(Aspergillusniger)(ATCC 16404)来自广东省微生物所。枯草芽孢杆菌(Bacillussubtilis)(CMCC63501)、蜡样芽孢杆菌(Bacilluscereus)(CMCC 63301)、大肠杆菌(Escherichiacoli)(ATCC 35218)来自中国医学细菌保藏管理中心。酿酒酵母(Saccharomycescerevisiae)、屎肠球菌(Enterococcusfaecium)、藤黄微球菌(Micrococcusluteus)、痢疾志贺氏菌(Shigelladysenteriae)、灰绿青霉(Penicilliumglaucum)、康宁木霉(Trichodermakoningii)为本实验室分离鉴定保藏。
培养基:牛肉膏蛋白胨培养基用于培养细菌,YPD培养基用于培养酵母,PDA培养基用于培养霉菌。
1.2 方法
1.2.1 红菇子实体多糖的提取和初步纯化 取红菇子实体干粉按文献[6]中方法采用超声波技术提取水溶性多糖。提取上清液采用Sevage法除蛋白,去除蛋白后水相加入4倍体积的95%乙醇,4 ℃沉淀过夜。8000 r·min-1、4 ℃离心10 min,弃上清液,沉淀置于空气中挥发乙醇。沉淀溶解于pH 8、0.2 mol·L-1的磷酸缓冲溶液,60 ℃提取1 h,再次离心取上清液,冷冻干燥制成粗多糖干粉。
粗多糖溶于5 mL蒸馏水中,经0.45 μm微滤膜过滤后,上样于DEAF-52纤维素阴离子层析柱(2.6 cm×40 cm),采用蒸馏水至0.5 mol·L-1的NaCl溶液梯度洗脱,流速1.0 mL·min-1,每10 mL采用自动收集器收集。采用硫酸-苯酚法[7]于490 nm测定收集液中的多糖含量。依据洗脱峰型合并相同组分,蒸馏水中透析48 h脱盐,将透析内液冷冻干燥,得到纯化后多糖。红菇多糖经DEAF-52纤维素阴离子层析柱分离后,收集液分析多糖得到3个组分,分别命名为R1、R2和R3。分离组分分别在260 nm和280 nm波长紫外扫描,未见有核酸和蛋白吸收峰,说明各分离组分不含有蛋白和核酸等杂质。
1.2.2 红菇子实体多糖的抑菌活性的测定
1)采用牛津杯法测定抑菌活性:细菌与酵母指示菌接种于培养基适温培养至对数期(OD600nm=0.6),霉菌收集孢子后溶于无菌水中调整至106~107孢子·mL-1,取指示菌液0.5 mL涂布于平板表面,均匀放置牛津杯,将待测各组分配制成20 mg·mL-1的多糖溶液,每杯中点样100 μL,细菌37 ℃培养24 h,酵母和霉菌28 ℃培养48 h后,测量抑菌圈直径,每样重复3次。
2)最小抑菌浓度(MIC)的测定:将多糖溶液进行稀释,配制成10、5、2.5、1.25、1.0、0.8、0.4 mg·mL-1溶液,进行牛津杯法测定抑菌活性。
3)温度和pH对红菇多糖抑菌的影响:20 mg·mL-1多糖溶液分别置于50、60、80、100、121 ℃保持10 min和30 min,冷却后以大肠杆菌作为指示菌测定抑菌活性。分别用1 mol·L-1的HCl或NaOH调多糖溶液pH值至3~10,30 ℃下保温2 h,以相同pH的无菌HCl或NaOH溶液作为对照,同上述温度处理,测定处理液抑菌活性。
4)红菇多糖抑菌作用方式:按1%接种量将大肠杆菌(ATCC35218)接种于100 mL的牛肉膏蛋白胨液体培养基,于37 ℃,200 r·min-1条件下培养至对数中期(10 h),加入无菌过滤后的50 mg·mL-1的多糖溶液10 mL,继续培养,每隔2 h取样测定OD600nm和活菌数,以加入10 mL无菌水作为对照。
2 结果与分析
2.1 红菇多糖的抑菌作用
红菇多糖分离纯化组分R1、R2和R3抑菌实验结果见表1。在多糖20 mg·mL-1条件下,组分R1展现出很好的抑菌活性,对革兰氏阴性菌的抑制作用强于革兰氏阳性菌,对供试的金黄色葡萄球菌、藤黄微球菌、蜡样芽孢杆菌和枯草芽孢杆菌有抑制作用,对2株大肠杆菌、铜绿假单胞菌和痢疾志贺氏菌有较强的抑制作用;组分R2无抑菌活性;而R3抑菌活性弱,仅对藤黄微球菌和大肠杆菌表现出弱的抑制作用。3种多糖组分均未发现对酵母菌和霉菌有抑制作用。
2.2 红菇多糖最小抑菌浓度
将组分R1稀释后,测定其对不同敏感菌的最小抑制浓度(Minimum inhibition concentration MIC),结果见表2。由表2可知,其最小抑制质量浓度分别为金黄色葡萄球菌2.5 mg·mL-1,藤黄微球菌10 mg·mL-1,蜡样芽孢杆菌5 mg·mL-1,枯草芽孢杆菌10 mg·mL-1,大肠杆菌1.0 mg·mL-1,铜绿假单胞菌1.25 mg·mL-1,痢疾志贺氏菌1.25 mg·mL-1。R1对革兰氏阴性菌的最小抑菌浓度明显低于革兰氏阳性菌。
2.3 温度和pH对红菇多糖抑菌活性的影响
温度对红菇多糖抑菌活性的影响见图1。由图1可知,在50 ℃处理10、30 min抑菌活性变化不大,抑菌圈直径与对照相比变化不大;60 ℃处理10、30 min抑菌活性有所下降,抑菌圈直径分别为15.7、15.3 mm;80 ℃处理10、30 min 后活性下降显著,但仍然保持了较高的抑菌活性;100 ℃处理10 min仅能测到微弱活性,处理30 min活性消失;121 ℃处理后无活性。表明温度对红菇多糖抑菌活性有显著影响,红菇多糖在80 ℃以下能保持较好的抑菌活性。
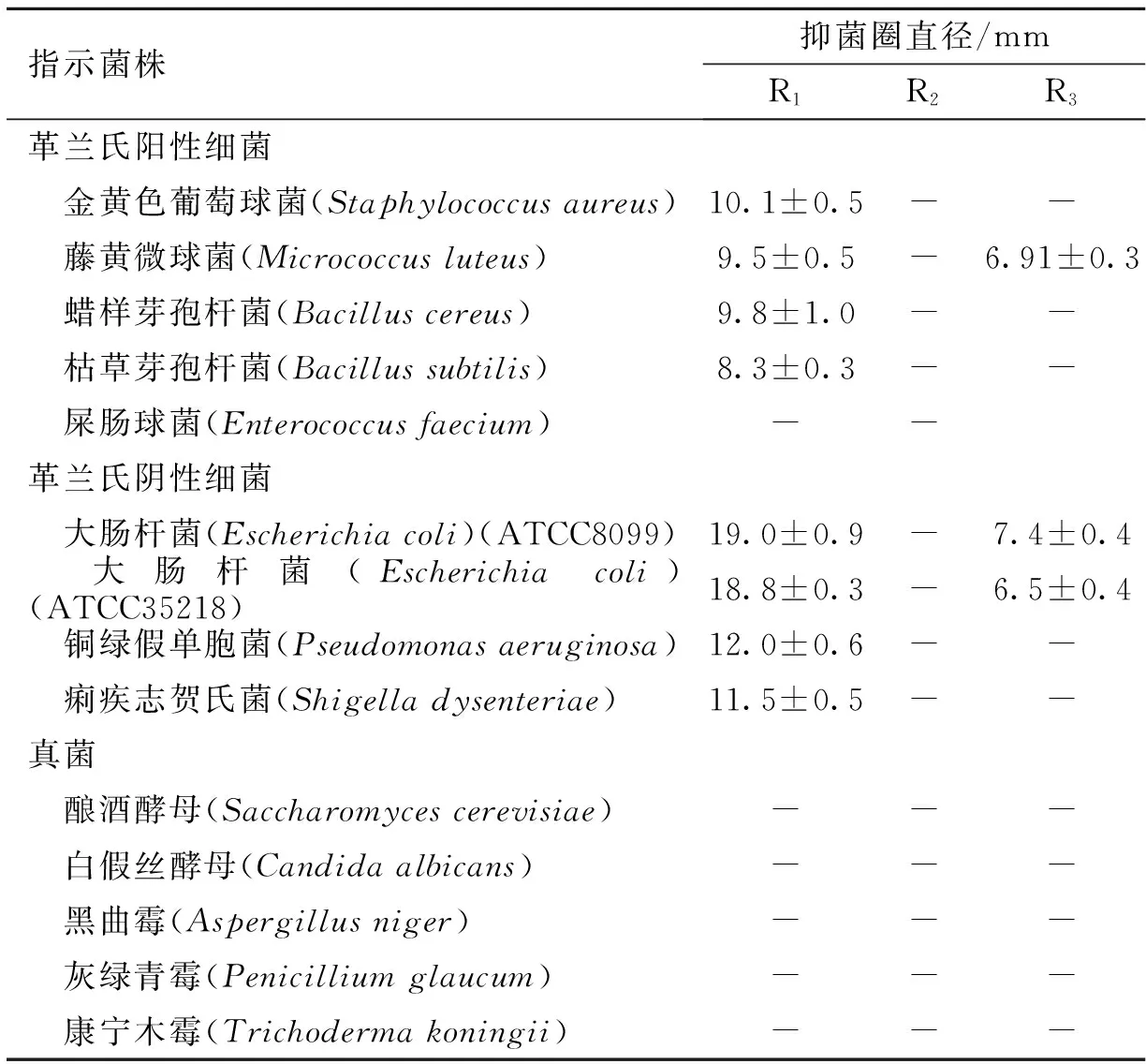
表1 红菇子实体多糖的抑菌作用

表2 红菇子实体多糖的最小抑菌浓度
*:-为无抑菌圈,+为抑菌圈在6~8 mm,++为抑菌圈在8~10 mm,+++为抑菌圈在10 mm以上。
pH对红菇多糖抑菌活性的影响见图2,在pH 6~10范围内表现出较好的抑菌活性,抑菌圈直径均在12 mm以上,pH<5和pH>11时,抑菌活性下降显著,虽然能够测到一定的抑菌活性,但是相同pH的对照也表现出一定的抑菌活性,说明此时的pH对敏感菌产生抑菌作用。以上试验结果表明,红菇多糖在pH 6~10范围内抑菌活性最好。
2.4 红菇多糖的抑菌作用方式
在培养至对数中期的大肠杆菌ATCC35218培养液中加入R1组分溶液,考查红菇多糖的抑菌作用方式,结果见图3。培养10 h时加入红菇多糖后,大肠杆菌的活菌数和OD600nm并没有立即降低,在培养10~12 h内出现小幅增加,12 h后活菌数显著下降,说明菌体生长从开始受到抑制到后期被杀死;但加入多糖后,菌液OD值变化不大,说明敏感菌细胞并未出现破裂溶菌现象。表明红菇多糖的抑菌作用方式是杀菌,对菌体无溶菌作用。

图1 温度对红菇多糖抑菌活性的影响图2 pH对红菇多糖抑菌活性的影响

图3 红菇多糖抑菌活性的作用方式
3 结论与讨论
本文对超声波提取的红菇水溶性多糖进行分离纯化得到3个组分,3个多糖组分表现出不同的抑菌活性,组分R1抑菌活性最好,主要能够抑制细菌,其中对革兰氏阴性菌抑菌活性强于革兰氏阳性菌,对酵母和霉菌无抑制效果;各供试菌株的最小抑制质量浓度分别为金黄色葡萄球菌2.5 mg·mL-1,藤黄微球菌10 mg·mL-1,蜡样芽孢杆菌5 mg·mL-1,枯草芽孢杆菌10 mg·mL-1,大肠杆菌1.0 mg·mL-1,铜绿假单胞菌1.25 mg·mL-1,痢疾志贺氏菌1.25 mg·mL-1。在对敏感细菌的抑制作用方面,红菇多糖表现出较好的耐热性和较宽的pH适用范围,在80 ℃以下和pH 6~10都能维持很好的抑菌活性。
多糖对细菌抑制作用的确切机制尚未完全清楚,从目前研究较多的壳聚糖的抑菌机制看,一般认为可分为3种方式[8-9],大分子量的多糖不能穿过细胞膜,只能与细胞表面相互作用,如和细胞壁或者细胞膜上的受体结合,以改变细胞通透性,导致细胞内容物渗漏,破坏了细菌细胞的完整性使菌体死亡。或者是多糖在细胞周围形成传质阻碍的膜,从而阻碍和改变了细胞的营养运输,导致细胞营养缺乏死亡。小分子水溶性多糖通过受损伤的细胞表面进入细胞内部,干扰菌体的大分子的合成和代谢,从而抑制细菌。本文对红菇多糖抑菌的作用方式研究红菇多糖对敏感菌是杀菌作用,而且对其菌体无溶菌作用,对于红菇多糖的具体抑菌机制,还有待于进一步研究。
[1]李国杰,文华安.中国红菇属分类研究进展[J].菌物学报,2009(2):303-309.
[2]陈新华.广东商品红菇形态和分子鉴定、营养成分分析及其生物活性研究[D].长沙:中南大学,2010.
[3]Stachowiak B,Regula J.Health-promoting potential of edible macromycetes under special consideration of polysaccharides: a review[J].European Food Research and Technology,2012,234(3):369-380.
[4]邱龙新.正红菇子实体多糖的提取技术及抗癌活性研究[J].中国食用菌,2004(6):48-50.
[5]陈旭健,张原琪.红菇多糖的提取及其降血糖、血脂作用研究[J].食品科学,2010(9):255-258.
[6]李云,黄荣城,许俊凰.响应曲面法优化红菇多糖超声波提取工艺[J].食品工业,2012(8):66-69.
[7]张惟杰.糖复合物生化研究技术[M].2版.杭州: 浙江大学出版社,1999.
[8]Vinsova J,Vavrikova E.Chitosan Derivatives with Antimicrobial,Antitumour and Antioxidant Activities-a Review[J].Current Pharmaceutical Design,2011,17(32):3596-3607.
[9]Eaton P,Fernandes J C,Pereira E,et al.Atomic force microscopy study of the antibacterial effects of chitosans on Escherichia coli and Staphylococcus aureus[J].Ultramicroscopy,2008,108(10):1128-1134.
Antibacterial Activity of Polysaccharide Extracted from Fruit Body ofRussulasp.
LI Yun,HUANG Rong-cheng,XU Jun-huang
(DepartmentofBiology,HanshanNormalUniversity,Chaozhou521041,Guangdong,China)
The water-soluble polysaccharide was extracted using ultrasound method from fruit body ofRussulasp.,which was collocted from wild resources in eastern Guangdong province.Three components were sperated and purified from crude polysaccharide using chromatography.The component R1exhibited strong antibacterial activity towards Gram-negative bacteria than Gram-positive bacteria,and had no activity to yeast and mold.Fraction R2didn′t show any antibacterial actility and fraction R3showed weak actility.The minimum inhibitory concentration for each of the tested strains were Staphylococcus aureus 2.5 mg·mL-1,Micrococcus luteus 10 mg·mL-1,Bacillus cereus 5 mg·mL-1,Bacillus subtilis 10 mg·mL-1,Escherichia coli 1.0 mg·mL-1,Pseudomonas aeruginosa 1.25 mg·mL-1,Shigella dysentery 1.25 mg·mL-1.The polysaccharide has good heat resistance and a wide pH range,it can maintain a good antibacterial activity at 80 ℃ for 30 min and pH 6~10.The Antimicrobial mode of action of action of the polysaccharides is sterilization,no cell lysis.
Russulasp.;polysaccharide of fruit body;antibacterial activity
2014-06-18;
2014-08-17
广东省潮州市科技计划项目(2010N09);韩山师范学院青年基金资助(LQ200808)
李云(1977—),男,湖北宜昌人,韩山师范学院生物系讲师,硕士,从事食品微生物和功能食品开发研究。E-mail:fgtmyself@163.com。
10.13428/j.cnki.fjlk.2015.02.022
S759.81;Q949.32
A
1002-7351(2015)02-0098-05
