MiR-126在大鼠心肌缺血再灌注早期的表达及抗凋亡作用
2015-09-15郑华峰陶晶张斌王纯吴淳
郑华峰 陶晶 张斌 王纯 吴淳
MiR-126在大鼠心肌缺血再灌注早期的表达及抗凋亡作用
郑华峰 陶晶 张斌 王纯 吴淳
目的 探讨miR-126在大鼠心肌缺血再灌注(I/R)早期的表达及抗凋亡作用。方法 48只SD大鼠随机分为假手术(Sham)、I/R 2 h、I/R 4 h、I/R 6 h组,每组12只大鼠,比较各组缺血区心肌细胞凋亡蛋白水平及miR-126表达水平。构建重组腺病毒rAAV9-ZsGreen-pre-miR-126载体,24只SD大鼠随机分为:①I/R组:大鼠转染空白病毒后I/R 2 h;②I/R+miR-126组:大鼠转染 rAAV9-ZsGreen-premiR-126后I/R 2 h,再次比较各组缺血区心肌细胞凋亡蛋白水平。结果 与Sham组相比,I/R 2 h、4 h、6 h组大鼠心肌缺血区miR-126表达进行性降低(P<0.05),非缺血区miR-126表达进行性升高(P<0.05);心肌凋亡蛋白BAX及CASPASE-3表达水平升高(P<0.05),抗凋亡蛋白BCL-2表达水平降低(P<0.05)。与I/R组相比,I/R+miR-126干预组心肌凋亡蛋白BAX及CASPASE-3表达水平明显减少,抗凋亡蛋白BCL-2表达水平增加(P<0.05)。结论 在I/R早期大鼠心肌缺血区miR-126表达随再灌注时间延长进行性下降,并伴随心肌细胞凋亡进展;过表达miR-126可减少I/R导致的心肌细胞凋亡,发挥保护心功能的作用。
miR-126;心肌缺血再灌注;心肌缺血区;凋亡蛋白;细胞凋亡
缺血再灌注(ischemia-reperfusion,I/R)损伤可以加重组织、器官的功能障碍和结构损伤。探索I/R损伤的机制,做到既能尽早恢复缺血组织的血流,又减轻或防止I/R损伤的发生,是包括冠心病在内的缺血性疾病治疗中急需解决的重要问题[1,2]。I/R损伤中细胞凋亡是最重要环节之一[3]。1994年Gottlieb等[4]首次报道在兔心肌I/R损伤模型中发现细胞凋亡;随后Fliss等[5]报道持续缺血过程存在细胞凋亡,但I/R过程中细胞凋亡尤为显著。细胞凋亡的水平一定程度上反映I/R损伤的严重程度,抑制I/R过程中细胞凋亡的发生发展,则可能防止或减轻I/R损伤的发生,从而为冠心病的治疗带来新的希望。MicroRNA(miRNA)分子是一类内源性、非编码、单链RNA,通过结合靶基因的mRNA的3非翻译区(3′-UTR),介导靶基因mRNA降解,抑制或增强其蛋白质翻译,从而调控转录后的基因表达[6-8]。目前研究已发现许多miRNAs参与细胞增殖、分化、发育及凋亡等复杂的生物进程[9-11]。 MiR-126是一种来源于Egfl7第7个内含子的保守型内含子miRNA,主要在哺乳动物的内皮细胞(endothelial cells,ECs)及浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs)内表达,参与血管的生成及癌细胞的增殖和迁移[12-14]。Nazari-Jahantigh等[15]观察到大鼠缺血30 min再灌注4 h的心肌组织中miR-126表达下降。以上研究提示,miR-126在I/R早期心肌表达异常,并可能参与I/R过程中的细胞凋亡。
本研究以心肌I/R早期大鼠模型为研究对象,观察I/R早期心肌细胞中miR-126的表达变化及心肌细胞凋亡水平。进一步通过构建重组腺病毒rAAV9-ZsGreen-pre-miR-126载体,过表达rniR-126表达后观察其对心肌细胞凋亡的影响,从而为临床I/R损伤的治疗提供新的思路。
1 材料与方法
1.1试剂和仪器总RNA提取试剂Trizol(Invitrogen,USA)、反转录试剂盒 TaqMan MicroRNA Reverse Transcription Kit(Ambion,Austin,TX),Quanti-Tect SYBR Green PCR Kit(Qiagen,German),QuantiTect SYBR Green PCR Kit(Takara,Japan),PCR扩增引物由Invitrogen广州公司合成,重组腺病毒rAAV9-ZsGreen-pre-miR-126载体及空白对照病毒载体购自苏州吉玛公司,兔抗大鼠CASPASE-3、BAX、BCL-2及GAPDH单克隆抗体购自Abcam。普通 PCR 仪(BIO-RAD,USA),NanoDrop 2000c紫外 分 光 光 度 计(ThermoScientific,USA),LightCycler480荧光定量 PCR 仪(Roche,Germany)等。
1.2 实验动物及分组 SPF级雄性SD大鼠72只,体重220~250 g,由南京大学动物模式研究所提供并在该中心饲养。饲养环境为清洁级,温度维持在20℃~22℃。动物分笼饲养,每笼2只,饲以标准饲料,自由饮水,每周换塾料、消毒笼具2次。动物使用符合南京大学动物管理委员会管理条例。随机分组为(n=15):①Sham组:SD大鼠仅开胸,不进行冠状动脉前降支结扎,6 h后处死;②I/R 2 h组:SD大鼠开胸并进行I/R,2 h后处死;③I/R 4 h组:SD大鼠开胸并进行I/R,4 h后处死;④I/R 6 h组:SD大鼠开胸并进行I/R,6 h后处死;⑤I/R组:大鼠转染空白病毒后I/R 2 h;⑥I/R+miR-126组:大鼠转染rAAV9-ZsGreen-premiR-126后I/R 2 h。
1.3 动物模型制备 参考文献建立心肌缺血再灌注模型[16,17]。行颈部正中切开术分离气管,插气管插管连接动物呼吸机(BL-420生物信号采集处理系统,成都泰盟科技有限公司),同时测定心率(HR)、心律和心电图(ECG)ST段。沿胸骨正中线切开皮肤,从胸骨左缘剪断第3、4两肋骨,用小开心器撑开切口,暴露心脏,在肺动脉圆锥与左心房间找出左冠状动脉前降支,用无创缝合丝线置于左冠状动脉前降支起始部下2 mm处备用,将丝线两端套一小塑料垫片,再穿入一聚乙烯小管以形成环路,稳定10 min后轻轻抽紧丝线两端,推套管紧贴心壁以阻断左冠状动脉血流,以心电图Q导联上ST段弓背上抬 0.1 mV或T波高耸、心尖部心肌颜色变暗红色为完全结扎标志。
1.4 RNA提取步骤 在每1 ml Trizol试剂加入100 mg组织标本中,冰上充分裂解,移液枪轻轻吹打细胞。将裂解后的组织标本加入eppendorf管中,剧烈震荡30 s,静置5 min。加入氯仿0.2 ml,充分混匀后室温静置5 min。在4℃,以12 000 r/min离心15 min,吸去上清后转入新的eppendorf中,加入异丙醇0.5 ml,混勾后放置于4℃冰箱10 min,再次在4℃,12 000 r/min条件下离心10 min,去上清后留取沉淀。加入1 ml 75%已经预冷的乙醇,震荡洗涤沉淀RNA,12 000 r/min离心5 min,吸去上清后空气干燥10 min。加入4℃ DEPC水以充分溶解。
1.5 Quantitative real-time PCR(qRT-PCR)检测大鼠心肌 miR-126、Caspase-3、Bcl-2及 Bax的表达量 按照QuantiTect SYBR Green PCR Kit试剂盒说明书,以合成的cDNA作为模版在LightCycler480Ⅱ荧光定量PCR仪上进行RT-qPCR反应。PCR反应体系为:模版cDNA 1 μl,miR-126特异性引物0.4 μl,10×miScript Universal Primer 2 μl,2×QuantiTect SYBR Green PCR Master Mix 10 μl,miR-126上游引物为 5′-TACCAAAAGTAATAATGTGCTG-3′,下游引物为Qiagen公司试剂盒提供的通用引物;以 U6为作为内参,U6上游引物为 5′-CTCGCTTCGGCAGCACA-3′, 下游 引 物 为 5′-ACGCTTCACGAATTTGCGT-3′,加 RNase-free water 7.4 μl至总体积 20 μl。
按照SYBR premix Ex TaqTMⅡ PCR Kit试剂盒说明书,以合成的cDNA作为模版在LightCycler480Ⅱ荧光定量PCR仪上进行RT-qPCR反应。普通基因反应体系为:模版 cDNA 1 μl,SYBR premix Ex TaqTM Ⅱ PCR Mix 10 μl,正、反向引物(20 μmol) 共 1.6 μl,Caspase-3、Bcl-2 及 Bax 上下游引物见表1,加RNase-free water 7.4 μl至总体积20 μl。反应条件为:95 ℃ 30 s,随后 95 ℃ 5 s,55 ℃30 s,72℃ 15 s,共40个循环。采用 ΔΔCT分析方法计算qPCR仪所得数据[18]。

表1 基因引物信息
1.6 Western blot检测心肌细胞CASPASE-3、BAX及BCL-2蛋白的表达特征 配制组织裂解缓冲液[0.1 mol/L Tris Cl(pH 7.4),EDTA 1 mmol/L,1%的 Triton X-100,0.3 mol/L Aprotinin,1 mmol/L PMSF]。分别将液氮内冻存的各组心肌组织取出120~150 mg,在液氮内研磨成粉末后倒入一塑料管中,加入1 ml溶液悬浮,冰上匀浆3次,每次10 s,超声处理3次。13 000 r/min离心30 min,上清即为所需蛋白。蛋白定量后进行SDS-PAGE电泳并转膜。蛋白转膜结束后,以5%脱脂奶粉TBS配制液封闭后,膜置于含兔抗大鼠CASPASE-3抗体(ab17815,1∶500 稀释)、BAX 抗体(ab32503,1∶1000稀释)及 BCL-2抗体(ab117115,1∶500稀释)溶液中,室温摇床反应 2 h,TBST[154 mmol/L NaCl,10 mmol/L Tris(pH 9.5),0.05%聚山梨酯]洗膜,并将膜置于相应二抗溶液中室温摇床反应2 h,用ECL试剂盒显色,X线胶片显影。用 NIH Image软件对X线胶片上阳性条带实施扫描,测定吸光度值。所有实验至少重复3次。
1.7 统计学方法 统计学分析采用SPSS 17.0。所有计量资料均以±s表示,不同实验组间比较采用两个样本独立t检验。结果判断以P<0.05为差异有统计学意义。
2 结果
2.1 缺血再灌注大鼠建模情况 左冠状动脉前降支结扎部位以下心肌颜色变苍白,搏动减弱,心电图ST段明显抬高(图1)。缺血45 min后解开活结,恢复前降支血流,30 min后可观察到室性早搏、室性心动过速、室颤等再灌注心律失常,发生率为72%。手术大鼠共72只,存活60只,存活率83%。死于心室颤动5只,死于心脏骤停3只,死于腹腔大出血2只,死于麻醉过量1只,死于术后急性左心衰1只。
2.2 I/R大鼠心肌不同区域miR-126表达特征采用qRT-PCR方法检测miR-126的表达,结果发现,在缺血区I/R 2 h、4 h、6 h组miR-126的表达分别为 Sham 组的(0.82±0.18)倍、(0.60±0.15)倍、(0.42±0.08)倍(P<0.05),见图 2A;在非缺血区则随着再灌注时间延长,miR-126表达逐渐升高,I/R 2 h、4 h、6 h miR-126的表达分别是Sham组的(1.38±0.14)倍、(1.89±0.15)倍、(2.43±0.25)倍,与 Sham 组比较差异有统计学意义(P<0.05),见图2B。上述结果提示,在心肌缺血区miR-126的表达量随时间依赖性降低,而非缺血区心肌miR-126的表达量随时间依赖性增加。
2.3 I/R大鼠心肌凋亡调控相关因子BCL-2、BAX及CASPASE-3的表达特征 与Sham组比较,I/R 2 h、4 h、6 h后大鼠心肌缺血区Bcl-2 mRNA表达下调分别为(0.85±0.15)倍(P<0.05)、(0.65±0.11)倍(P<0.05)、(0.43±0.08)倍(P<0.05),见图 3A;Bax mRNA表达上调分别为(1.57±0.11)倍(P<0.05)、(2.46±0.24)倍(P<0.05)、(3.21±0.33)倍(P<0.05),见图3B;Caspase-3 mRNA表达上调分别为(1.31±0.08)倍(P<0.05)、(1.95±0.28)倍(P<0.05)、(2.78±0.38)倍(P<0.05),见图 3C。经 Western blot检测发现,I/R大鼠心肌凋亡调控相关因子BCL-2、BAX及CASPASE-3蛋白的表达与mRNA一致,见图3D。
2.4 转染rAAV9-ZsGreen-pre-miR-126前后大鼠心肌miR-126的特征 I/R组大鼠心肌组织检测到较低水平miR-126表达。与I/R组比较,转染rAAV9-ZsGreen-pre-miR-126 14 d后心肌组织可观察到 miR-126的表达明显升高,见图4A。经qRT-PCR方法检测发现,转染 rAAV9-ZsGreenpre-miR-126后大鼠心肌miR-126的表达量为转染前的(12.21±0.58)倍,见图 4B。
2.5 I/R大鼠转染 rAAV9-ZsGreen-pre-miR-126前后心肌凋亡调控相关因子BCL-2、BAX及CASPASE-3的表达特征 与I/R组比较,转染rAAV9-ZsGreen-premiR-126后大鼠心肌缺血区Bcl-2 mRNA 水平表达增高为(2.67±0.38)倍(P<0.05),Bax mRNA 表达水平下调为(0.46±0.08)倍(P<0.05),Caspase-3 mRNA 表达 水 平 下 调 为(0.62±0.12)倍(P<0.05),见图 5A。经 Western blot检测发现,转染 rAAV9-ZsGreen-pre-miR-126前后I/R大鼠心肌凋亡调控相关因子BCL-2、BAX及CASPASE-3蛋白的表达与mRNA一致,见图5B。
3 讨论
文献报道I/R早期即可出现细胞凋亡,细胞凋亡是I/R损伤过程的重要环节。细胞凋亡的水平一定程度上反映I/R损伤的严重程度,因此抑制细胞凋亡的发生、发展,是减轻I/R损伤的重要手段。本研宄发现,Sham组大鼠心肌形态正常,结构清晰,心肌纤维排列整齐有序;而I/R处理后缺血区大鼠心肌组织细胞浆深染,细胞核不规则,炎性细胞浸润,且上述改变随再灌注时间延长而进展,而非缺血区组织形态未见异常改变,与文献报道一致。Caspase-3是经典的细胞凋亡的指标,当I/R发生时,细胞内凋亡相关信号转导系统传递信号,激活调控细胞凋亡的基因,细胞即按死亡程序自动走向死亡[19,20]。本研究发现,在缺血45 min再灌注2 h后即可观察到心肌缺血区有炎性细胞浸润,抑制凋亡作用的Bcl-2水平降低,促凋亡因子Caspase-3及Bax表达升高,提示I/R 2 h后即可出现细胞凋亡,且随再灌注时间延长Bcl-2水平进一步降低,Caspase-3及Bax水平进一步升高,提示再灌注时间延长缺血区细胞凋亡加重,而非缺血区再灌注未有明显细胞凋亡。
本研究以rAAV9为载体,ZsGreen为焚光标记,pre-miR-126为目的基因在体内转染大鼠心肌。实验观察到rAAV9转染后7 d左右miR-126开始表达,14 d为表达高峰,与文献[21]报道一致。本研究结果提示,rAAV9可以高效、稳定地在心肌表达,且作用安全。
前期研究报道miR-126在I/R损伤中表达异常。Tang等[22]观察到,在大鼠缺血30 min再灌注24 h心肌组织中miR-126表达下降。Ren等[23]则报道,小鼠缺血30 min再灌注24 h时miR-126表达则上调。本研究发现,大鼠缺血45 min再灌注心肌缺血区miR-126表达降低,且在2 h、4 h、6 h呈进行性下降,并伴随细胞凋亡进展。因此我们设想,I/R早期缺血区miR-126降低可能参与了细胞凋亡过程。MiR-126在肿瘤领域被广泛报道参与调节细胞凋亡,在肾脏的I/R研宄中也被报道参与调节细胞凋亡[24-26]。Dong等[27]观察到进行缺血预处理后,再结扎大鼠冠状动脉6 h,之前观察到梗死区miR-126降低的趋势得以改善,梗死区凋亡细胞减少,梗死区面积减少。Cheng等[28]报道将大鼠心肌缺血预适应处理后,心肌组织miR-126的表达增加,抑制miR-126表达后,缺血预适应的心肌保护作用减弱。上述研究一致发现体内过表达miR-126,可明显改善心肌细胞凋亡。这进一步支持我们的设想,即I/R早期在大鼠心肌缺血区,rniR-126表达降低可能与细胞凋亡有关。
综上所述,miR-126在急性心肌I/R损伤中的保护作用可能来自对缺血心肌细胞凋亡的抑制,并且效应具有剂量依赖性,miR-126的抗凋亡效应影响了Caspase-3的激活。其具体的分子机制有待进一步研究。
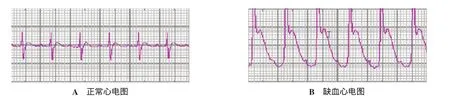
图1 正常与I/R大鼠心电图
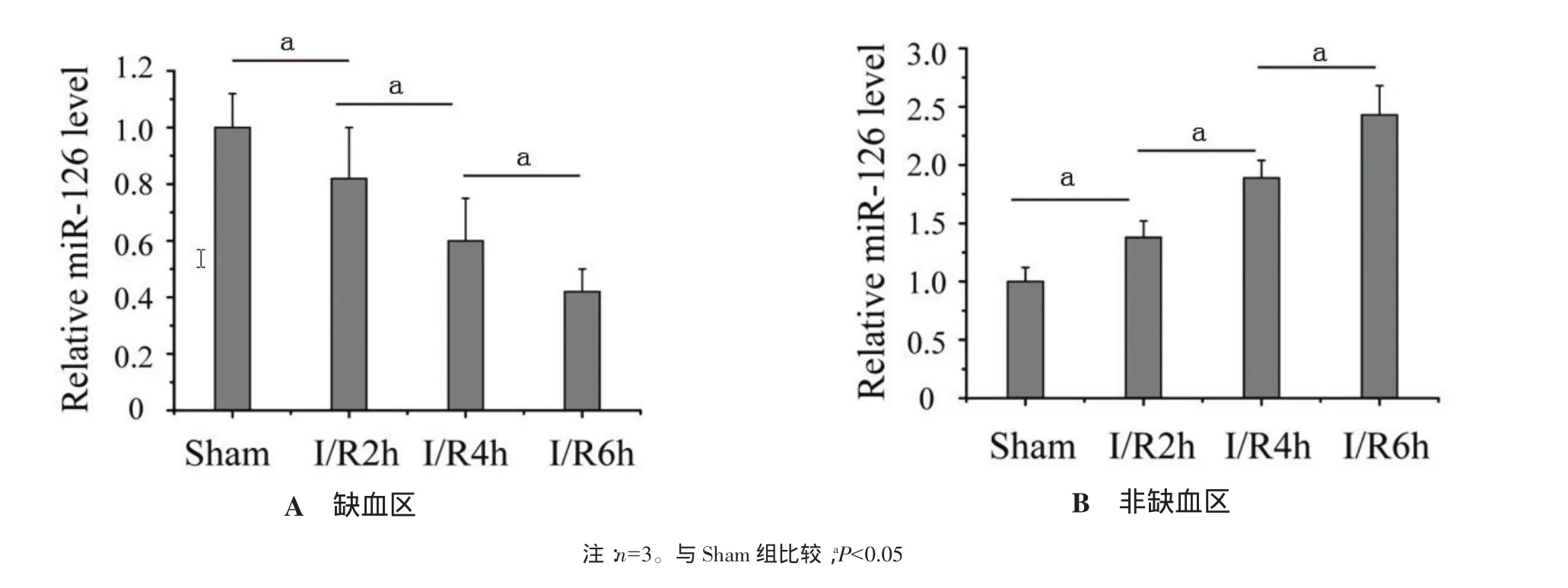
图2 I/R大鼠心肌不同区域miR-126的表达的特征
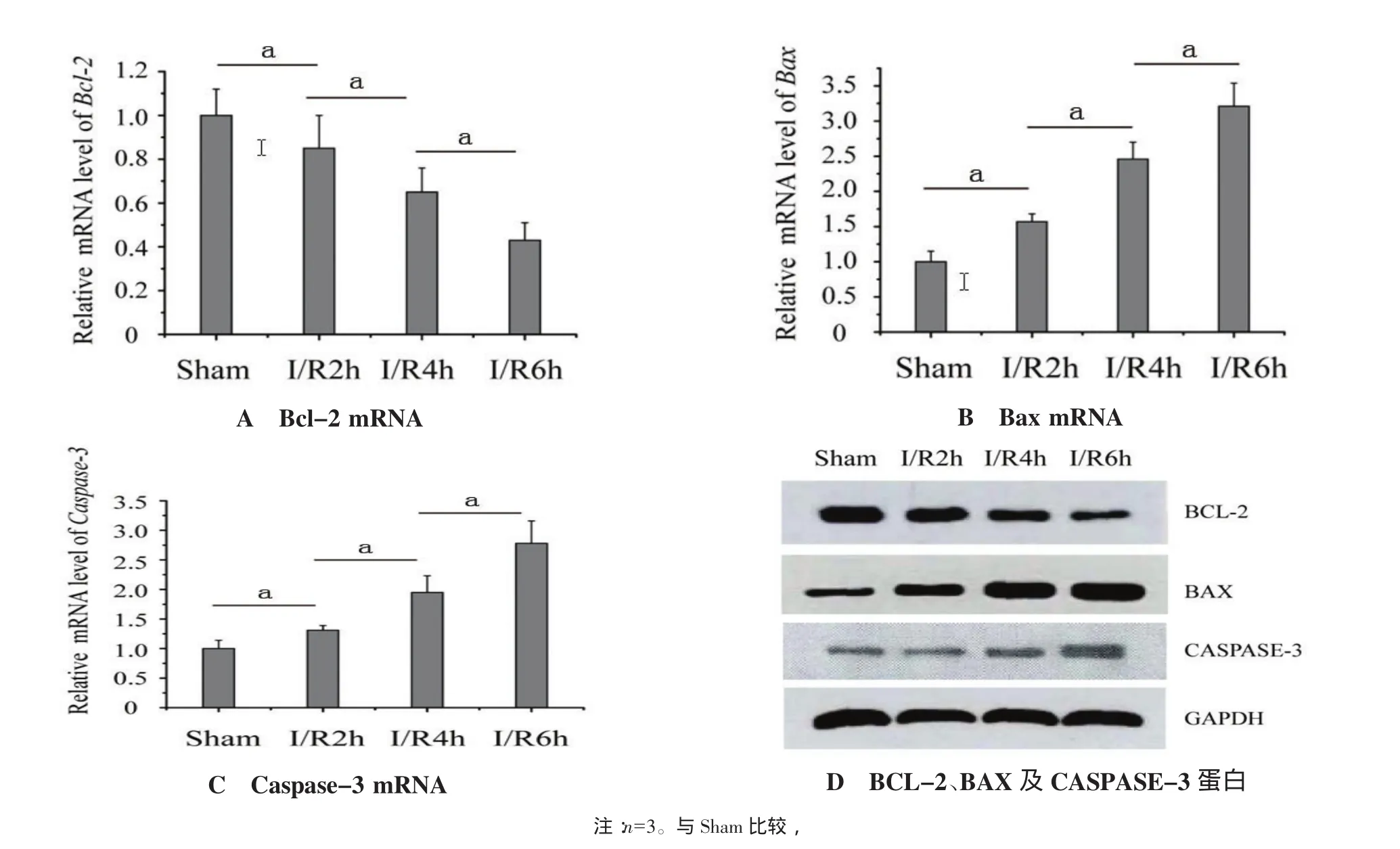
图3 I/R大鼠心肌凋亡调控相关因子BCL-2、BAX及CASPASE-3的表达特征
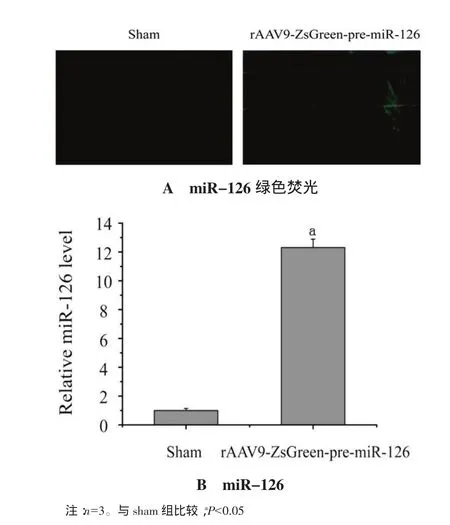
图4 转染rAAV9-ZsGreen-pre-miR-126前后大鼠心肌miR-126的特征
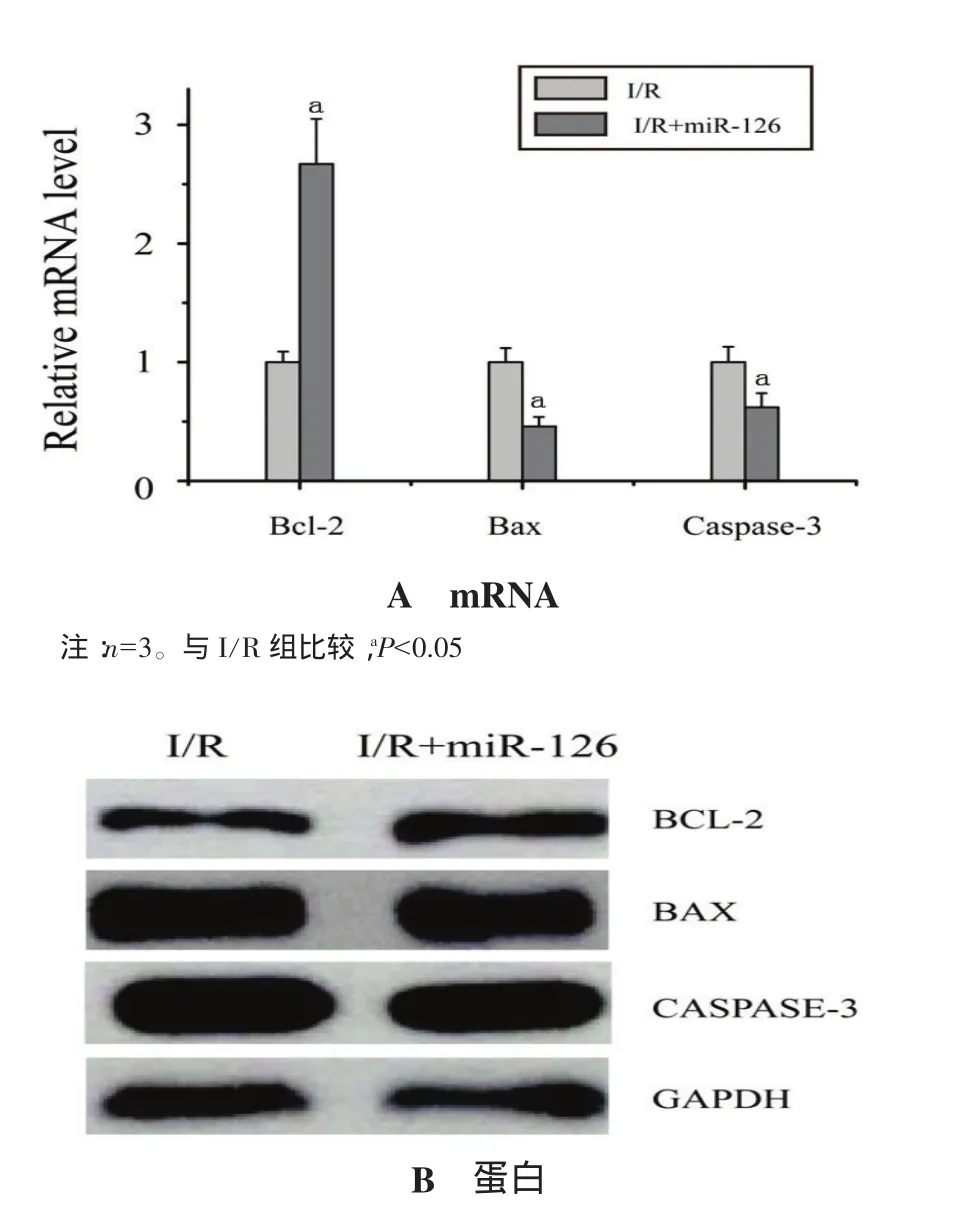
图5 I/R大鼠转染rAAV9-ZsGreen-pre-miR-126前后心肌凋亡调控相关因子BCL-2、BAX及CASPASE-3的表达特征
[1]朱丽,黄鹤.IL-6及TNF-α表达与粥样斑块稳定性及冠心病的相关性分析.中国心血管病研究,2015,13:799-802.
[2]杜闻莹,郑刚.冠心病患者心脏康复研究进展.中国心血管病研究,2015,13:106-109.
[3] ScarabelliTM, KnightR, Stephanou A, etal.Clinical Implications of Apoptosis in Ischemic Myocardium.Curr Probl Cardiol,2006,31:181-264.
[4]Gottlieb RA,Burleson KO,Kloner RA,et al.Reperfusion Injury Induces Apoptosis in Rabbit Cardiomyocytes.J Clin Invest,1994,94:1621-1628.
[5]Fliss H,Gattinger D.Apoptosis in Ischemic and Reperfused Rat Myocardium.Circ Res,1996,79:949-956.
[6]Song JL,Nigam P,Tektas SS,et al.Microrna Regulation of Wnt Signaling Pathways in Development and Disease.Cell Signal,2015,27:1380-1391.
[7] Eulalio A,Mano M.Microrna Screening and the Quest for Biologically Relevant Targets.J Biomol Screen,2015,20:1003-1017.
[8]Philippen LE,Dirkx E,da Costa-Martins PA,et al.Non-Coding Rna in Control of Gene Regulatory Programs in Cardiac Development and Disease.J Mol Cell Cardiol,2015,S0022-2828:00100-00105.
[9]Romaine SP,Tomaszewski M,Condorelli G,et al.Micrornas in Cardiovascular Disease:An Introduction for Clinicians.Heart,2015,101:921-928..
[10]Purvis N,Bahn A,Katare R.The Role of Micrornas in Cardiac Stem Cells.Stem Cells Int,2015,2015:194894.
[11]Schulte C,Zeller T.Microrna-Based Diagnostics and Therapy in Cardiovascular Disease-Summing up the Facts.Cardiovasc Diagn Ther,2015,5:17-36.
[12]Yang X,Chen BB,Zhang MH,et al.Microrna-126 Inhibits the Proliferation of Lung Cancer Cell Line A549.Asian Pac J Trop Med,2015,8:239-242.
[13]Rohde JH,Weigand JE,Suess B,et al.A Universal Aptamer Chimera for the Delivery of Functional Microrna-126.Nucleic Acid Ther,2015,25:141-151.
[14]Qiang L,Hong L,Ningfu W,et al.Expression of Mir-126 and Mir-508-5p in Endothelial Progenitor Cells Is Associated with the Prognosis of Chronic Heart Failure Patients.Int J Cardiol,2013,168:2082-2088.
[15]Nazari-Jahantigh M,Egea V,Schober A,et al.Microrna-Specific Regulatory Mechanisms in Atherosclerosis.J Mol Cell Cardiol,2014,S0022-2828:00342-00343.
[16]O′Connor DM,Naresh NK,Piras BA,et al.A Novel Cardiac Muscle-Derived Biomaterial Reduces Dyskinesia and Postinfarct Left Ventricular Remodeling in a Mouse Model of Myocardial Infarction.Physiol Rep,2015,e12351.
[17]Jiang C,Ji N,Luo G,et al.The Effects and Mechanism of Mir-92a and Mir-126 on Myocardial Apoptosis in Mouse Ischemia-Reperfusion Model.Cell Biochem Biophys,2014,70:1901-1906.
[18]Schmittgen TD,Livak KJ.Analyzing Real-Time Pcr Data by the Comparative C(T)Method.Nat Protoc,2008,3:1101-1108.
[19]Shalini S,Dorstyn L,Dawar S,et al.Old,New and Emerging Functions of Caspases.Cell Death Differ,2015,22:526-539.
[20]Boland K,Flanagan L,Prehn JH.Paracrine Control of Tissue Regeneration and Cell Proliferation by Caspase-3.Cell Death Dis,2013,4:e725.
[21] Pacak CA,Mah CS,Thattaliyath BD,et al.Recombinant Adeno-Associated VirusSerotype 9 Leadsto Preferential Cardiac Transduction in Vivo.Circ Res,2006,99:e3-9.
[22] Tang Y,Zheng J,Sun Y,et al.Microrna-1 Regulates Cardiomyocyte Apoptosis by Targeting Bcl-2.Int Heart J,2009,50:377-387.
[23]Ren XP,Wu J,Wang X,et al.Microrna-320 Is Involved in the Regulation ofCardiac Ischemia/Reperfusion Injury by Targeting Heat-Shock Protein 20.Circulation,2009,119:2357-2366.
[24]Khella HW,Scorilas A,Mozes R,et al.Low Expression of Mir-126 Is a Prognostic Marker for Metastatic Clear Cell Renal Cell Carcinoma.Am J Pathol,2015,185:693-703.
[25]Yang Y,Song KL,Chang H,et al.Decreased Expression of Microrna-126 Is Associated with Poor Prognosis in Patients with Cervical Cancer.Diagn Pathol,2014,9:1001.
[26]Lonvik K,Sorbye SW,Nilsen MN,et al.Prognostic Value of the Microrna Regulators Dicer and Drosha in Non-Small-Cell Lung Cancer:Co-Expression of Drosha and Mir-126 Predicts Poor Survival.BMC Clin Pathol,2014,14:45.
[27]Dong S,Cheng Y,Yang J,et al.Microrna Expression Signature and the Role of Microrna-126 in the Early Phase of Acute Myocardial Infarction.J Biol Chem,2009,284:29514-29525.
[28]Cheng Y,Zhu P,Yang J,et al.Ischaemic Preconditioning-Regulated Mir-126 Protects Heart against Ischaemia/Reperfusion Injury Via Anti-Apoptosis through Its Target Pdcd4.Cardiovasc Res,2010,87:431-439.
The expression and effect of anti-apoptosis of microRNA-126 in rat myocardium during early phase of ischemia reperfusion
ZHENG Hua-feng,TAO Jing,ZHANG Bin,et al.Department of Cardiology,Peking University Shenzhen Hospital,Shenzhen 518036,China
Objective To investigate the expression of microRNA-126 (miR-126)and its protective effects in rat myocardium during early phase of ischemia-reperfusion.Methods 48 SD rats were randomly divided into Sham group(control group),I/R 2 h group,I/R 4 h group,I/R 6 h group(n=12).To compare the expression level of miR-126 and level of cell apoptosis between Sham group and the different I/R time point groups.rAAV9-ZsGreen-pre-miR-126 was successfully constructed and 24 SD rats were divided into two groups randomly(n=12):⑴I/R group:rats were treated with I/R after transfected with rAAV9-ZsGreen by coronary injection.⑵I/R+miR-126 group:rats were dealt with I/R after transfected with rAAV9-ZsGreen-pre-miR-126 by coronary injection.To compare again the expression level of miR-126 and level of cell apoptosis in the two groups.Results MiR-126 was down-regulated in the ischemic area after I/R compared with the Sham group at 2 h,4 h and 6 h,but it was up-regulated in the non-ischemic area(P<0.05).The level of CASPASE-3 and BAX was increased in the I/R group than the Sham group at 2 h,4 h and 6 h after I/R,but the level of BCL-2 was decreased when compared with the Sham group.After tranfected with rAAV9-ZsGreen-pre-miR-126,the level of CASPASE-3 and BAX were decreased in I/R+miR-126 group by comparing with the I/R group,while the level of BCL-2 was increased when compared with the I/R group.Conclusion The expression of miR-126 was downregulated and cell apoptosis was increased in ischemic area at the early phase of I/R.Over-expression of miR-126 can inhibit cell apoptosis and protect cardiac function.
MiR-126;I/R;Ischemic area;Apoptosis protein;Cell apoptosis
WU Chun,E-mail:wuchun2012@163.com
2015-07-16)
518036 广东省深圳市,北京大学深圳医院心内科
吴淳,E-mail:wuchun2012@163.com
10.3969/j.issn.1672-5301.2015.11.020
Q95-33;R542.2
A
1672-5301(2015)11-1041-06
