右美托咪定和肾上腺素辅助臂丛神经阻滞效果比较
2015-09-13林欣沈玲张帆昆山市第一人民医院麻醉科江苏215300
林欣,沈玲,张帆(昆山市第一人民医院麻醉科,江苏215300)
右美托咪定和肾上腺素辅助臂丛神经阻滞效果比较
林欣,沈玲,张帆
(昆山市第一人民医院麻醉科,江苏215300)
目的:探讨右美托咪定和肾上腺素辅助臂丛神经阻滞下上肢手术的效果。方法:肌间沟臂丛神经阻滞的上肢手术30例,随机分为3组每组10例,神经阻滞用药均为0.2%罗哌卡因用生理盐水稀释至20mL,其中对照组C组仅用生理盐水稀释,右美托咪定组D组和肾上腺素组E组分别含有右美托咪定1μg/kg和肾上腺素200μg。比较3组患者术中局麻药起效时间,感觉和运动阻滞持续时间以及患者开始感觉疼痛的时间,以及对脑电双频指数(BIS)值的影响。结果:D组、E组局麻药起效时间,感觉﹑运动阻滞持续时间和患者开始感觉疼痛的时间明显比C组延长(P<0.05),D、E两组比较差异无统计学意义;D组的BIS值在15~60min明显减低(P<0.05),其他两组间比较差异无统计学意义。无1例患者更改麻醉方式。结论:右美托咪定有良好的镇静作用,对肾上腺素使用禁忌者可替代其在局麻药中的作用。
右美托咪定;肾上腺素;臂丛神经阻滞
右美托咪定是高选择性的α-2受体激动剂,有报道认为[1-2],联合局部麻醉药使用可以延长神经阻滞的持续时间,有部分学者认为它对外周血管有收缩作用[3]。肾上腺素作为血管收缩剂,在局麻时使用可减少其血液吸收,降低它的全身性毒性,延长麻醉的持续时间,已广泛应用于临床。本研究比较使用右美托咪定和肾上腺素复合局麻药行臂丛神经阻滞,从麻醉效果来判断右旋美托咪啶必要时是否可以替代肾上腺素。
1 资料与方法
1.1一般资料选择择期臂丛麻醉下拟行上肢手术患者30例,男22例,女8例,年龄20~65岁,体重
60~80kg,ASA分级I~II级。术前无心动过缓及传导阻滞等心血管疾病,未使用血管活性药物,肺、肝、肾及神经系统功能正常。采用随机法将患者分为3组每组10例,对照组(C组)男8例,女2例;右美托咪定组(D组)男7例,女3例;肾上腺素组(E组)男7例,女3例。本研究已经本院医学伦理委员会批准,患者均签署知情同意书。3组间性别构成、年龄、体重、手术时间差异均无统计学意义(P>0.05),见表1,无1例患者更改麻醉方式。
表1 两组患者一般情况比较n=10,±s)

表1 两组患者一般情况比较n=10,±s)
组别年龄(岁)体重(kg)身高(cm)手术时间(min)C组45±1368±9165±775±22 D组40±1565±14169±877±25 E组48±1164±14168±1080±20
1.2方法(1)麻醉方法:3组患者手术前常规禁食,术前30 min肌内注射苯巴比妥钠l00mg、阿托品0.5mg。每组均采用超声引导下肌间沟臂丛神经阻滞,常规皮肤消毒后,采用HITACHI UST-5413超声诊断仪定位,探头频率为12MHz。先在颈总动脉获得横断图像,然后侧移到胸锁乳突肌上,在胸锁乳突肌下方前斜角肌间隙可看到神经结构,将穿刺针刺入目标神经,根据超声下显示局麻药神经包裹情况调整针尖位置与方向。所有患者均采用1%罗哌卡因(瑞典AstraZeneca公司,批号:MFl833)20mL,其中C组仅用生理盐水稀释,D组含1μg/kg右美托咪定(江苏恒瑞医药公司,批号:09081232),E组含200 ug肾上腺素。神经阻滞均由同1位麻醉科医师完成。(2)观察指标:分别记录患者年龄、性别、体重和手术时间等基本情况,给药后每2分钟测试感觉和运动阻滞的程度。感觉阻滞的评估通过针刺手背、第5手指、第3手指分别检测桡神经、尺神经和正中神经的阻滞效果。0分是与对侧肢体相比疼痛无差异,1点是疼痛较轻,2分是完全无痛。运动阻滞的评估:通过桡神经支配的拇指外展,尺神经支配的拇指内收或伸长,正中神经支配的对掌是否能完成。0分是运动强度与对侧无差异,1点是强度下降,2点即有完整的运动阻滞。将BIS传感器贴在额头,在注射药物后的1小时内,每5分钟测定1次。BIS值85~100为清醒状态,65~85为镇静状态,40~65为麻醉抑制状态,低于40可能呈现爆发抑制。
1.3统计学处理应用SPSS 10.0统计软件,计量资料以±s表示,组间同时间点数据比较采用成组t检验,组内各时间点数据比较采用重复测量设计的方差分析。计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1局麻药效果3组患者各指标比较D组,E组局麻药起效时间,感觉和运动阻滞持续时间和患者开始感觉疼痛的时间明显比C组延长(P<0.05),但是D,E两组之间差异无统计学意义。见表2。
表2 3组患者局麻药效果各指标比较(n=10,min,±s)
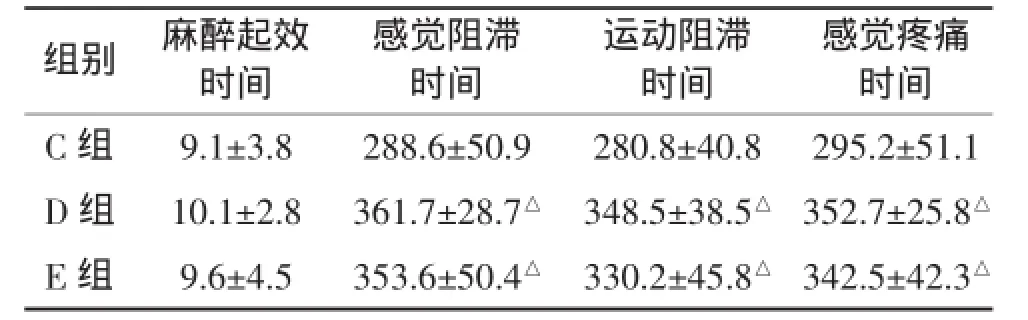
表2 3组患者局麻药效果各指标比较(n=10,min,±s)
与C组同时间比较,△P<0.05
组别麻醉起效时间感觉疼痛时间C组9.1±3.8288.6±50.9280.8±40.8295.2±51.1 D组10.1±2.8361.7±28.7△348.5±38.5△352.7±25.8△E组9.6±4.5353.6±50.4△330.2±45.8△342.5±42.3△感觉阻滞时间运动阻滞时间
2.2脑电双频指数(BIS)的比较C组和E组间比较差异无统计学意义,D组的BIS值在15~60min明显减低,与其他两组相比差异有统计学意义(P< 0.05),见图1。

图1 脑电双频指数(BIS)3组比较
3 讨论
本文结果显示,右美托咪定组延长臂丛神经阻滞的持续时间,和肾上腺素组间差异无统计学意义,3组之间的局麻药起效时间也无明显差异,和Swami等[4]的研究结果相同。其机制可能是α-2肾上腺素能受体的外周血管收缩作用[5],或药物可能直接作用于到周围神经[6-7]。突触后α1和α-2肾上腺素能受体都存在于血管,但它们分布根据动脉或静脉的种类而不同。某些情况下,α-2肾上腺素能受体的缩血管比α1受体更强[8-9]。但也有其他学者认为[3],右美托咪定降低腋路臂丛神经阻滞的起效时间,神经阻滞的持续时间没有差异,考虑是个体差异原因导致[9]。
右美托咪定组给药15~20分钟后,脑电双频指数值开始降低,α-2受体激动剂辅助局麻药的使用具有很好的镇静作用,这一结果和其他学者的观点相吻合。Gaumann等[10]用150μg可乐定辅助利多卡因在臂丛神经中阻滞,给药后30分钟开始发挥镇静作用,并能维持60分钟。其机制尚未完全了解,主要认为是α-2激动剂抑制P物质在背根神经元水平的分泌和传递,通过在蓝斑核的活化发挥镇痛和镇静效果[11]。
右美托咪定过去所有的研究和报道中,常见的并发症有心动过缓和低血压的症状,通过停药或者简单的药物处理即可缓解,未发现其他不良并发症[12-13]。安全性较好,无神经毒性,即使使用高剂量(25~40μg/kg)也不会损坏轴突髓鞘,在动物实验中发现,它甚至可以减少布比卡因导致的急性神经周围炎症反应[2]。
总之,右美托咪定有等同于肾上腺素延长神经阻滞及术后镇痛持续时间的效果。并且由于肾上腺素和右美托咪定对心脏速率相反的作用,认为右美托咪对一些特殊病情的患者是一个更好的选择。
[1]Brummett CM,Norat MA,Palmisano JM,et al.Perineural administration of dexmedetomidine in combination with bupivacaine enhances sensory and motor blockade in sciatic nerve block without inducing neurotoxicity in rat[J].Anesthesiology,2008,109(3):502-511.
[2]Esmaoglu A,Yegenoglu F,Akin A,et al.Dexmedetomidine added to levobupivacaine prolongs axillary brachial plexus block[J].Anesth Analg,2010,111(6):1548-1551.
[3]Abdallah FW,Abrishami A,Brull R.The facilitatory effects of intravenous dexmedetomidine on the duration of spinal anesthesia:a systematic review and Meta-Analysis[J]. Anesth Analg,2013,117(1):271-278.
[4]SwamiSS,KeniyaVM,LadiSD,etal.Comparisonof dexmedetomidine and clonidine(α2 agonist drugs)as an adjuvant to local anaesthesia in supraclavicular brachial plexus block:A randomised double-blind prospective study[J].In-dian J Anaesth,2012,56(3):243-249.
[5]Talke PO,Lobo EP,Brown R,et al.Clonidine-induced vasoconstriction in awake volunteers[J].Anesth Analg,2001,93(2):271-276,1st contents page.
[6]Guo TZ,Jiang JY,Buttermann AE,et al.Dexmedetomidine injection into the locus ceruleus produces antinociception[J].Anesthesiology,1996,84(4):873-881.
[7]Kosugi T,Mizuta K,Fujita T,et al.High concentrations of dexmedetomidine inhibit compound action potentials in frog sciatic nerves without alpha(2)adrenoceptor activation[J]. Br J Pharmacol,2010,160(7):1662-1676.
[8]Brummett CM,Hong EK,Janda AM,et al.Perineural dexmedetomidine added to ropivacaine for sciatic nerve block in rats prolongs the duration of analgesia by blocking the hyperpolarization-activated cation current[J].Anesthesiology,2011,115(4):836-843.
[9]Ruffolo RR Jr.Distribution and fuction of peripheral alphaadrenoreceptors in the cardiovascular system[J].Pharmacol Biochem Behav,1985,22(5):827-833.
[10]Flavahan NA,Cooke JP,Shepherd JT,et al.Human postjunctional alpha-1 and alpha-2 adrenoceptors:differential distribution in arteries of the limbs[J].J Pharmacol Exp Ther,1987,241(2):361-365.
[11]Gaumann D,Forster A,Griessen M,et al.Comparison between clonidine and epinephrine admixture to lidocaine in brachial plexus block[J].Anesth Analg,1992,75(1):69-74.
[12]Rancourt MP,Albert NT,C觝té M,et al.Posterior tibial nerve sensory blockade duration prolonged by adding dexmedetomidine to ropivacaine[J].Anesth Analg,2012,115(4):958-962.
[13]Obayah GM,Refaie A,Aboushanab O,et al.Addition of dexmedetomidine to bupivacaine for greater palatine nerve block prolongs postoperative analgesia after cleft palate repair[J].Eur J Anaesthesiol,2010,27(3):280-284.
R977.1+1
B
1006-2440(2015)02-0164-03
2015-03-02
