可溶性内皮细胞生长因子受体-2水平和冠状动脉慢血流相关性研究
2015-09-13张婷刘一弘谢峻魏钟海吉文庆宋杰徐标南京大学医学院附属鼓楼医院心内科江苏210008
张婷,刘一弘,谢峻,魏钟海,吉文庆,宋杰,徐标(南京大学医学院附属鼓楼医院心内科,江苏210008)
可溶性内皮细胞生长因子受体-2水平和冠状动脉慢血流相关性研究
张婷,刘一弘,谢峻,魏钟海,吉文庆,宋杰,徐标*
(南京大学医学院附属鼓楼医院心内科,江苏210008)
目的:探讨冠状动脉慢血流现象可能存在的发病机制。方法:选取冠脉慢血流者17例为观察组,同期无明显慢血流17例为对照组。慢血流诊断采用TIMI血流帧数评定。所有患者均于冠脉造影术前取静脉血,行可溶性内皮细胞生长因子受体-2(sVEGFR-2)测定。结果:(1)血清sVEGFR-2观察组为0.38±0.7(ng/mL),对照组为0.28± 0.7(ng/mL),两组比较差异有统计学意义(P<0.01)。(2)患者血清sVEGFR-2水平与高密度脂蛋白呈显著负相关,与3支冠脉平均血流帧数显著正相关,结论:冠状动脉慢血流与循环中sVEGFR-2增高有关。
冠状动脉慢血流;可溶性内皮细胞生长因子受体-2;微循环功能障碍;内皮功能;酶联免疫吸附试验
冠状动脉慢血流(coronary slow flow,CSF)是1972年由Tambe等[1]首次提出,指在冠状动脉造影中未发现冠状动脉存在明显病变,而远端血流灌注延迟的现象。此病排除严重的冠状动脉狭窄、痉挛、溶栓治疗后、冠状动脉成型术后、冠状动脉内气体栓塞等。冠状动脉慢血流可引起静息状态下或运动状态下出现心绞痛,甚至急性心肌梗死等。然而目前对于冠脉慢血流发病机制的研究尚无明确定论。传统认为冠脉慢血流与微血管功能失调相关,目前研究多认为内皮细胞功能障碍也是冠脉慢血流的发病机制之一。Ebos等[2]曾在老鼠和人类血浆及内皮细胞的条件培养基中均发现有天然可溶性内皮细胞生长因子受体-2(soluble vascular endothelial growth factor receptor 2,sVEGFR-2)的存在。本研究选取2013年1月—2014年6月冠脉慢血流患者17例,检测其血清中sVEGFR-2水平的变化,探讨冠脉慢血流现象可能存在的发病机制。
1 资料与方法
1.1一般资料冠脉慢血流患者(观察组)17例,男7例,女10例,平均年龄65.0±9.7岁,合并高血压8例,糖尿病3例,有吸烟史4例。同时随机抽取排除慢血流患者17例作为对照组,男8例,女9例,平均年龄63.7±9.9岁,合并高血压6例,糖尿病5例,有吸烟史6例。排除标准:急性心肌梗死、冠状动脉痉挛、冠状动脉扩张、冠状动脉夹层、心肌病、瓣膜病、全身系统性疾病、肿瘤、EF<45%的心力衰竭,严重肝肾功能不全。两组患者在年龄、性别、高血压、糖尿病、吸烟史、血糖、尿素氮、肌酐、胆固醇(Tch)、甘油三酯(TG)、低密度脂蛋白(LDL)等临床资料比较差异无统计学意义,见表1。观察组高密度脂蛋白(HDL)水平较对照组减低,差异有统计学意义,见表1。
表1 两组患者血生化指标比较(±s)
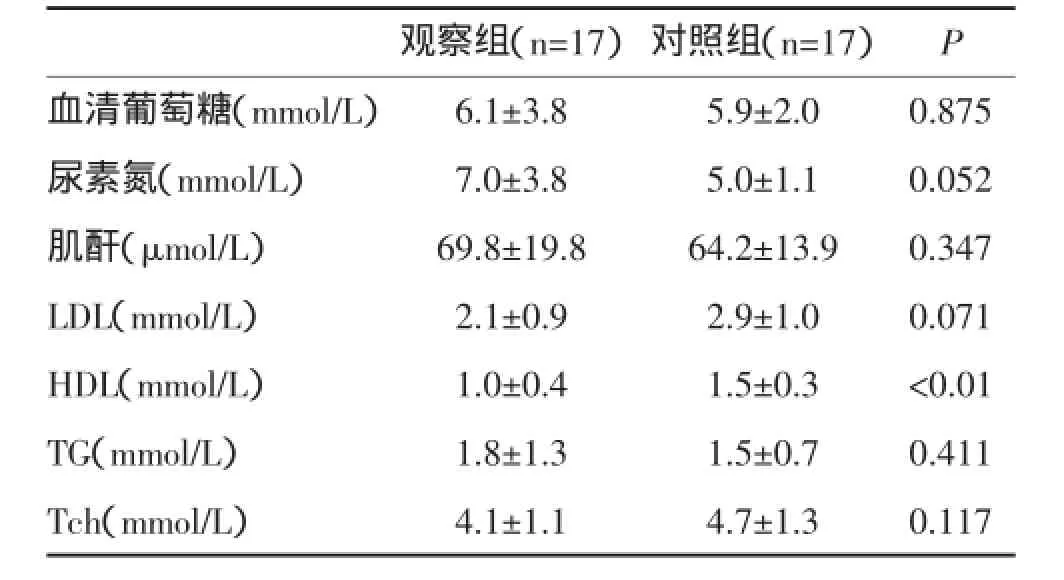
表1 两组患者血生化指标比较(±s)
观察组(n=17)对照组(n=17)P血清葡萄糖(mmol/L)6.1±3.85.9±2.00.875尿素氮(mmol/L)7.0±3.85.0±1.10.052肌酐(μmol/L)69.8±19.864.2±13.90.347 LDL(mmol/L)2.1±0.92.9±1.00.071 HDL(mmol/L)1.0±0.41.5±0.3<0.01 TG(mmol/L)1.8±1.31.5±0.70.411 Tch(mmol/L)4.1±1.14.7±1.30.117
1.2方法(1)冠状动脉慢血流诊断标准:以桡动脉途径行冠状动脉造影,使用TIMI血流帧数(TIMI frame count,TFC)评定冠状动脉血流速度。TFC评定标准:第一帧为造影剂进入某冠状动脉血管起始部并开始显影;最后一帧为造影剂到达各支冠状动脉远端标记:LAD为靠近心尖部的远端分叉处;LCX为钝缘支最远端的分叉;RCA为后降支发出后侧支的第一个分支。TFC是第一帧至最后一帧的帧数。Gibson等[3]的研究中采用30帧/秒的速度测得TFC,研究规定LAD、LCX、RCA正常血流速度分别为(36.2±2.6)帧,(22.2±4.1)帧,(20.4±3.0)帧。如有任一冠脉血流速度大于正常血流速度2个标准差即可定义为冠脉慢血流。但因本实验是以15帧/秒的速度采集图像,故将实际所测帧数乘以2。(2)检测方法:患者均于冠脉造影术前采静脉血3mL。将血液标本以3 000r/min离心10min,取上清液,于-74℃保存待测。使用酶联免疫吸附法(ELISA)测定sVEGFR-2。ELISA试剂盒(武汉华美生物工程有限公司)。
1.3统计学处理采用SPSS21.0软件分析,计量资料用±s表示,差异性比较采用独立样本t检验,计数资料采用χ2检验,相关性采用Pearson线性相关分析。P<0.01为差异有统计学意义。
2 结果
2.1两组患者TFC的比较观察组LAD、LCX、RCA的TFC及三支冠脉平均血流帧数均明显高于对照组,差异均有统计学意义,见表2。
表2 两组TIMI血流帧数比较(±s)
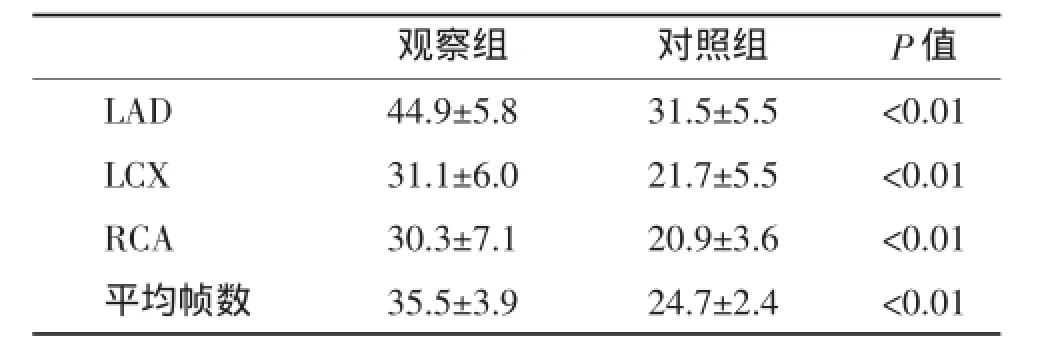
表2 两组TIMI血流帧数比较(±s)
观察组对照组P值LAD44.9±5.831.5±5.5<0.01 LCX31.1±6.021.7±5.5<0.01 RCA30.3±7.120.9±3.6<0.01平均帧数35.5±3.924.7±2.4<0.01
2.2两组患者血清sVEGFR-2水平比较血清sVEGFR-2观察组为0.38±0.7(ng/mL),对照组为0.28±0.7(ng/mL),两组比较差异有统计学意义(P< 0.01)。
2.3患者血清sVEGFR-2水平与高密度脂蛋白、3支冠脉平均血流帧数相关性分析结果显示血清sVEGFR-2与高密度脂蛋白显著负相关,见图1;与3支冠脉平均血流帧数显著正相关,如图2。
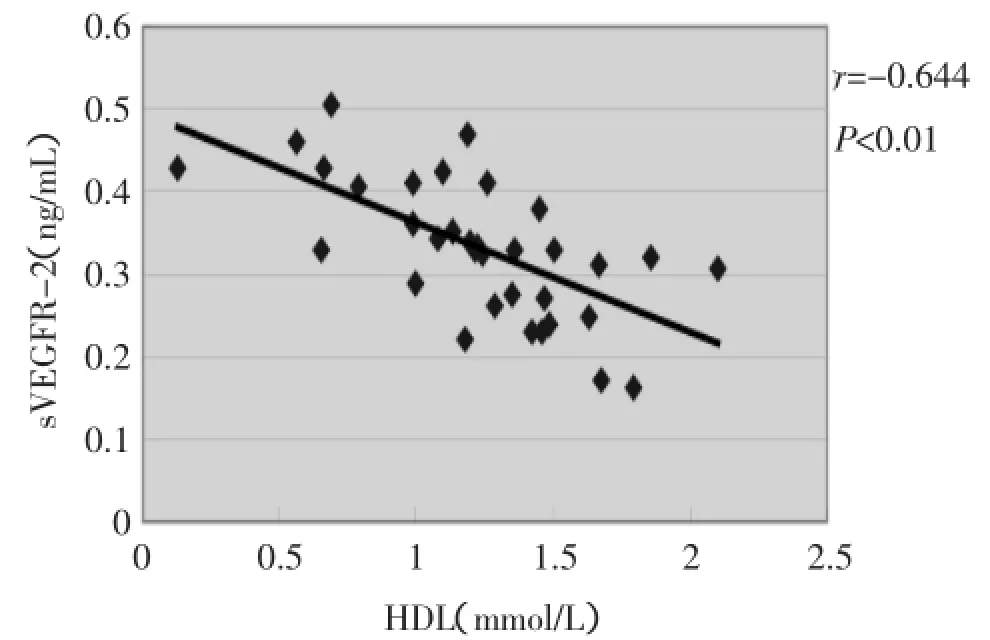
图1 血清sVEGFR-2与HDL水平相关分析
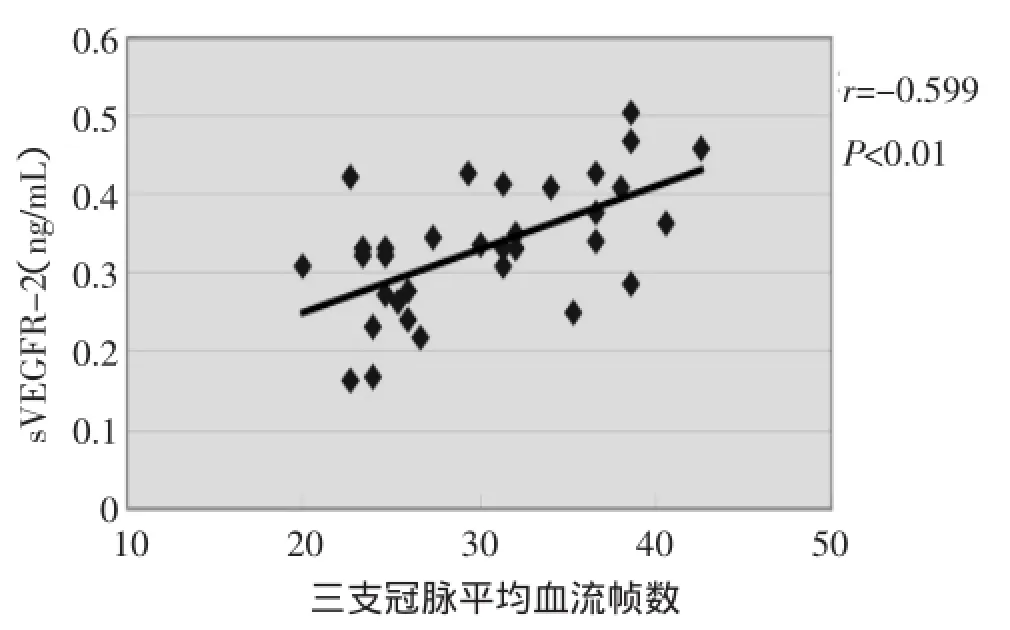
图2 血清sVEGFR-2与三支冠脉平均血流帧数相关性分析
3 讨论
冠状动脉慢血流(CSF)在日常冠脉造影中并不少见,研究显示CSF诱发静息心绞痛或心电图异常改变提示存在心肌缺血的发病率可高达1%~7%[4-5]。Yaymaci等[6]采用正电子发射心肌显像(SPECT)技术证实约83.4%的CSF患者存在心肌缺血。CSF不仅可导致不稳定性心绞痛甚至非ST段抬高型心肌梗塞,亦可导致心律失常、晕厥等症状[7-9]。因此临床对于CSF的重视逐渐加深,对其发病机制的研究也越来越多。
本实验旨在研究血清sVEGFR-2水平与CSF的相关性。sVEGFR-2是除细胞膜型受体外的另一种表达形式。目前研究已知多数细胞因子受体主要表达于细胞表面,即通常所说的膜型受体。但在一些情况下,许多细胞因子受体,可从细胞膜上脱落形成可溶性细胞因子受体或由自身细胞分泌可溶性细胞因子受体,且以前者居多。
内皮细胞可表达的血管内皮生长因子受体包括VEGFR-1和VEGFR-2。在内皮细胞上VEGFR-2表达数量较VEGFR-1高,且有研究表明VEGFR-1在配体刺激下不能有效进行自身磷酸化激活,而VEGFR-2的激活与内皮细胞的增殖、迁移、分化密切相关。确定VEGFR-2是唯一保证其配体血管内皮生长因子诱导内皮细胞迁移、血管生成、血管通透性增加的受体[10-12]。
VEGF为目前公认的最强的血管生成因子,其中VEGF-A是我们最常提及的。正常人血清VEGF水平及内皮细胞表达其受体水平维持在极低水平。如有缺氧或炎症存在时,血清VEGF、VEGFR水平均可明显升高,且VEGF可上调血管内皮细胞VEG-FR-2的表达水平[13]。Kikuchi等[14]实验则证实VEGFA于血管受损的病理状态下可高表达。由此表明内皮受损情况下VEGF-A水平是升高的。同时VEGF作为最强的血管通透性因子,与VEGFR-2结合可增加血管通透性,促使脂质沉积及泡沫细胞形成,从而进一步损害内皮功能促进动脉粥样硬化进展[15]。
本文实验结果示观察组血清sVEGFR-2水平高于对照组,将所有患者血清sVEGFR-2水平与三支冠脉平均血流帧数进行相关性分析,发现sVEGFR-2水平与三支冠脉平均血流帧数显著正相关。前文已述血管内皮受损情况下VEGF可高表达,且目前已有实验证实VEGF-A可以促使VEGFR-2由内皮细胞上的脱落形成sVEGFR-2[16]。故由此推测内皮受损情况下sVEGFR-2也可高表达。但sVEGFR-2水平升高与内皮功能受损是否存在直接相关尚不明确。故本实验仅能提示慢血流可能与循环中sVEGFR-2水平升高有一定相关性。
本实验除了检测血清sVEGFR-2水平外,对慢血流患者基本临床资料进行统计分析,与对照组比较显示差异均无统计学意义。但高密度脂蛋白水平却明显低于对照组,两组间比较有统计学意义(表1)。一般认为血脂水平异常是引起内皮功能受损重要因素之一,近年来对HDL的多项研究则表明HDL可促进胆固醇逆转运、有抗氧化、抗炎、调节内皮功能等抗动脉粥样硬化功能。Benjo等[17]报道HDL水平降低者内皮功能存在明显减退。实验中我们将患者血清sVEGFR-2与HDL水平进行相关性分析,结果提示两者呈负相关,由此推测HDL水平下降、内皮功能受损后sVEGFR-2水平升高,可作为慢血流存在内皮功能受损一项检测标志物。现已明确VEGFR-2脱落增加继发于VEGF升高,而VEGF既可高表达于血管受损情况下,也可发挥自身生物学活性进一步增加血管通透性损伤内皮功能。这也进一步表明冠脉慢血流现象存在内皮功能受损,冠脉慢血流与sVEGFR-2水平升高相关。
综上所述,本研究推测冠脉慢血流可能与循环中sVEGFR-2的升高相关。但因研究样本量仍偏少,且VEGF、VEGFR-2、sVEGFR-2的生物活性作用机制比较复杂,仍需更多样本量探索慢血流发病机制研究及sVEGFR-2于慢血流情况下高表达的详细病理机制。
[1]Tambe AA,Demany MA,Zimmerman HA.et al.Angina pectoris and slow flow velocity of dye in coronary arteries--a new angiographic finding[J].Am Heart J,1972,84(1):66-71.
[2]Ebos JM,Bocci G,Man S,et al.A naturally occurring soluble form of vascular endothelial growth factor receptor 2 detected in mouse and human plasma[J].Mol Cancer Res,2004,2(6):315-326.
[3]Gibson CM,Cannon CP,Daley WL,et al.TIMI frame count: a quantitative method of assessing coronary artery flow[J]. Circulation,1996,93(5):879-888.
[4]Mangieri E,Macchiarelli G,Ciavolella M,et al.Slow coronary flow:clinical and histopathological features in patients with otherwise normal epicardial coronary arteries[J].Cathet Cardiovasc Diagn,1996,37(4):375-381.
[5]Beltrame JF,Limaye SB,Horowitz JD.The coronary slow flow phenomenon——a new coronary microvascular disorder [J].Cardiology,2002,97(4):197-202.
[6]Yaymaci B,Dagdelen S,Bozbuga N,et al.The response of the myocardial metabolism to atrial pacing in patients with coronary slow flow[J].Int J Cardiol,2001,78(2):151-156.
[7]Cutri N,Zeitz C,Kucia AM,et al.ST/T wave changes during acute coronary syndrome presentation in patients with the coronary slow flow phenomenon[J].Int J Cardiol,2011,146(3):457-458.
[8]Ayhan E,Uyarel H,Is覦k T,et al.Slow coronary flow in patients undergoing urgent coronary angiography for ST elevation myocardial infarction[J].Int J Cardiol,2012,156(1):106-108.
[9]Wozakowska-Kaplon B,Niedziela J,Krzyzak P,et al.Clinical manifestations of slow coronary flow from acute coronary syndrome to serious arrhythmias[J].Cardiol J,2009,16(5):462-468.
[10]Rahimi N,Dayanir V,Lashkari K.Receptor chimeras indicate that the vascular endothelial growth factor receptor-1(VEGFR-1)modulates mitogenic activity of VEGFR-2 in endothelial cells[J].J Biol Chem,2000,275(22):16986-16992.
[11]Meyer RD,Rahimi N.Comparative structure-function analysis of VEGFR-1 and VEGFR-2:What have we learned from chimeric systems[J]?Ann N Y Acad Sci,2003,995(2003):200-207.
[12]Gille H,Kowalski J,Li B,et al.Analysis of biological effects and signaling properties of Flt-1(VEGFR-1)and KDR(VEGFR-2).A reassessment using novel receptorspecific vascular endothelial growth factor mutants[J].J Biol Chem,2001,276(5):3222-3230.
[13]Shen BQ,Lee DY,Gerber HP,et al.Homologous up-regulation of KDR/Flk-1 receptor expression by vascular endothelial growth factor in vitro[J].J Biol Chem,1998,273(45):29979-29985.
[14]Kikuchi R,Nakamura K,Maclauchlan S,et al.An antiangiogenic isoform of VEGF-A contributes to impaired vascularization in peripheral artery disease[J].Nat Med,2014,20(12):1464-1471.
[15]Celletti FL,Waugh JM,Amabile PG,et al.Vascular endothelial growth factor enhances atherosclerotic plaque progression[J].Nat Med,2001,7(4):425-429.
[16]Swendeman S,Mendelson K,Weskamp G,et al.VEGF-A stimulates Adam17-dependent shedding of VEGFR2 and crosstalk between VEGFR2 and ERK signaling[J].Circ Res,2008,103(9):916-918.
[17]Benjó AM,Maranh觔o RC,Coimbra SR,et al.Accumulation of chylomicron remnants and impaired vascular reactivity occur in subjects with isolated low HDL cholesterol:effects of niacin treatment[J].Atherosclerosis,2006,187(1):116-122.
R541
B
1006-2440(2015)02-0141-04
徐标,E-mail:xubiao@medmail.com.cn
2015-01-30
