壳聚糖包裹AgInS2的物理表征及生物毒性研究
2015-09-12张晓凡刘丽炜胡思怡张喜和
张晓凡,刘丽炜,邹 鹏,胡思怡,王 玥,张喜和
(长春理工大学理学院,吉林长春 130022)
壳聚糖包裹AgInS2的物理表征及生物毒性研究
张晓凡,刘丽炜*,邹 鹏,胡思怡,王 玥,张喜和
(长春理工大学理学院,吉林长春 130022)
选用天然多糖中唯一的碱性多糖——壳聚糖作为稳定剂和包裹剂,成功合成了水溶性的AgInS2量子点/低分子量壳聚糖纳米复合材料(AgInS2/LCSMS)。利用透射电子显微镜(TEM)、FT-IR傅里叶红外光谱仪、紫外吸收光谱、荧光分光光度计等表征手段对纳米复合材料的形貌、化学组成及光学性质进行了研究。结果表明,AgInS2/LCSMS纳米复合材料的粒径约为5~6 nm,在水相中仍具有较稳定的发光。之后,对AgInS2/LCSMS纳米复合材料的生物相容性进行了研究,对比AgInS2/LCSMS纳米复合材料与AgInS2量子点的细胞活性测试结果发现,AgInS2/LCSMS纳米复合材料的细胞活性比AgInS2量子点有了明显的提高,说明通过低分子量壳聚糖的包裹可以明显提高纳米材料的生物相容性。因此,这类具有较好水溶性和生物相容性的荧光AgInS2/LCSMS纳米复合材料可作为优良的生物荧光标记材料在生物医学检验、细胞以及活体成像研究中有广泛的应用前景。
低分子量壳聚糖;AgInS2量子点;毒性
1 引 言
量子点(Quantum dots,QDs)是一种半径小于或接近于激子玻尔半径,能够接受激发光产生荧光的半导体纳米颗粒,其小尺寸使得准连续的能带演变为类似于分子的分立能级结构,表现出强的量子限域效应,使材料的光学、电学等性质可调谐,从而具有一系列新异的光电性能。目前取得主要研究进展所用的量子点为二元CdSe、PbS等,但其含有毒性重金属Cd、Pb等元素,不符合当前对环保、环境友好型材料的战略要求,限制了其在众多领域的应用。而新型三元Ⅰ-Ⅲ-Ⅵ族半导体量子点AgInS2(AIS)、CuInS2(CIS)不仅具备了量子点所具有的优异性能,而且以其低毒环保的优点,有望取代Cd系量子点在各领域的应用[1]。本实验采用无毒的壳聚糖作为稳定剂和包裹剂,对AgInS2量子点进行包裹,还可以达到降低AgInS2量子点的毒性、提高生物相容性的目的。
壳聚糖是自然界存在的唯一碱性多糖,其学名为β-(1.4)-2-氨基-2-脱氧-D葡聚糖。可由蟹、虾壳中的甲壳素经脱乙酰化反应而制得。其资源丰富,安全无毒,具有独特的分子结构和易于化学修饰、生物可相容性和可再生性等功能。它的胺基极易形成四级胺正离子,有弱碱性阴离子交换作用。壳聚糖在酸性溶液中会溶解,稳定性差[2-3]。将壳聚糖进行交联制成壳聚糖微球[4,5],不但可提高其稳定性及机械强度,而且使其易与介质分离,有利于其在医学、食品、化工等领域的应用[6]。壳聚糖是制备微球的良好材料,在生物医学[7]、药学[8-12]以及固定酶或细胞[13-14]等领域倍受专家青睐。微球能保护包埋物免受外界环境影响,以及屏蔽味道、颜色或气味,降低挥发性和毒性,控制可持续释放等多种作用。近年来,微球已被广泛应用于生物、医药和食品等多个领域[15]。
本文对低分子量壳聚糖微球包裹AgInS2量子点(AgInS2/LCSMS)进行了研究。AgInS2/ LCSMS纳米复合材料不仅具备壳聚糖良好的生物相容性、低毒性、生物可降解性,有抗菌、防腐、止血和促进伤愈合等优点,同时具备新型三元量子点独特的光学性能,如发光性质尺寸可调、斯托克斯位移大、发光效率高、发光稳定性好等[16]。AgInS2/LCSMS纳米复合材料在改善量子点毒性的同时,增强了其在水溶液中的稳定性,使量子点更加符合体内分析的要求。可以将其应用于载药系统、基因载体及生物探针等生命科学领域,并且具有广阔的前景。
2 实 验
2.1 仪器与试剂
仪器:F-4500荧光分光光度计(美国安捷伦公司);UV-3010紫外可见近红外分光光度计(美国安捷伦公司);UB-7型pH计;HS4型加热磁力搅拌器;荧光倒置显微镜(德国莱卡公司);FT-IR傅里叶红外光谱仪(Thermo Scientific Nicolet iS50);高倍透视电镜(FEITecnai G2 S-Twin);酶标仪(Infinite M200 Pro,瑞士,TECAN公司);稳态瞬态荧光光谱仪(FLS980)。
试剂:硝酸银(AgNO3);油胺(Oleylamine);硬脂酸(Stearic Acid);油酸(Oleic Acid);硫粉(Sulfur powber);醋酸铟(Indiumacetate);正十二烷基硫醇(1-Dodecanethiol);十八烯(1-Octadecene);F127;壳聚糖;NaOH(AR);三聚磷酸钠(TPP);醋酸;1-(3-二甲氨基丙基)-3-乙基碳二胺盐酸盐(EDC);PBS缓冲液(Thermo)。其他药品均是分析纯,所有溶液均用HPLC水配制。
2.2 AgInS2(AIS)量子点的制备
将硝酸银和醋酸铟按1:1的摩尔比混合一起放入100 mL三叉瓶中,加入15 mL十八烯、2 mL油酸和2 mL正十二烷基硫醇,搅拌加热至150℃,反应20 min后作为前驱体。将196 mg的硫溶于6mL油胺中,待硫元素全部溶解,取3mL快速注入前驱体中,将反应温度设置为170℃反应20 min获得油性AgInS2量子点。然后再用F127进行转水,得到水性AgInS2量子点。
2.3 低分子量壳聚糖(LCS)的制备
500 mg壳聚糖溶解在10 mL 2%的醋酸溶液中,逐滴加入5 mL 6%的H2O2溶液,在40℃水浴降解。每隔数小时取一定量溶液,用2 mol/L的NaOH溶液调至pH=6.8,过滤杂质。用3~5倍的乙醇析出沉淀,得到低分子量壳聚糖。冷藏24 h后,干燥备用。
2.4 低分子量纳米荧光探针(AgInS2/LCSMS)的制备
我们利用离子交联法来制备壳聚糖微球。离子交联法就是在离子交联剂的作用下,大分子链间通过化学键联结起来,形成网状或体形结构高分子的方法。本实验采用的交联剂为三聚磷酸钠(TPP)。三聚磷酸钠与壳聚糖的交联原理如图1所示。取10 mg已制得的低分子量壳聚糖溶于2%的醋酸溶液中得到溶液A。将已制得的水性AgInS2量子点加入到pH=6.8的PBS缓冲液中,再加入10 mg EDC,在剧烈搅拌和TPP作用下,将PBS溶液缓慢滴加到溶液A中,制得AgInS2/ LCSMS纳米复合材料。

图1 壳聚糖与三聚磷酸钠(TPP)的结合过程Fig.1 Combination of chitosan and the TPP process

图2 AgInS2量子点(a)和AgInS2/LCSMS纳米复合材料(b)的TEM图像,插图为它们的粒径分析测试结果。Fig.2 TEM images of AgInS2QDs(a)and AgInS2/LCSMS nanocomposites(b).Insets are their size test results.
3 结果与讨论
3.1 样品形貌
利用透射电子显微镜(TEM)观察AgInS2量子点、AgInS2/LCSMS纳米复合材料的形貌,结果如图2所示。可以看出AgInS2量子点、AgInS2/ LCSMS纳米复合材料均具有良好的分散性,形貌规则,都为近似球形。图2(a)显示,制得的AgInS2量子点具有均一的粒径分布,约为3~4 nm。由图2(b)得知,AgInS2/LCSMS纳米复合材料的粒径约为5~6 nm。与未包裹的AgInS2量子点相比,AgInS2/LCSMS纳米复合材料的粒径变大,说明壳聚糖已包裹在量子点表面。
3.2 红外光谱
为了更好地证明AgInS2量子点已与壳聚糖复合,我们对壳聚糖(CS)、氧化降解后的低分子壳聚糖(LCS)和包裹AgInS2量子点后的AgInS2/ LCSMS纳米复合材料以及AgInS2量子点进行了KBr压片红外光谱测试,测试结果如图3所示。观察发现,CS、LCS、AgInS2/LCSMS纳米复合材料中均存在壳聚糖的几个特征峰,如3 440.5 cm-1处为形成氢键缔合的O—H伸缩振动吸收峰与N—H振动吸收峰重叠的多重吸收峰,2 880.3 cm-1处为C—H伸缩吸收峰,1 650.7 cm-1处为酞胺特征吸收峰。从CS和LCS对比结果得出, 3 440.5 cm-1处的N—H伸缩振动等主要峰的位置在壳聚糖降解前后都无变化,只是随壳聚糖相对分子质量的降低各峰峰强有所变化,表明降解过程中并没有破坏壳聚糖的结构。从LCS和AgInS2/LCSMS纳米复合材料的对比结果得出,在3 440.5 cm-1处的宽峰是N—H和O—H伸缩吸收峰,峰位置从3 440.5 cm-1移到了3 451.7 cm-1处,而且强度减小。并且,在1 650.7 cm-1和1 590.6 cm-1处分别是壳聚糖的酞胺Ⅰ和酞胺Ⅱ谱带或氨基的弯曲振动,而AgInS2/LCSMS纳米复合材料在此处减弱,是由于壳聚糖的氨基与AgInS2量子点反应掉一部分,氨基减少的缘故[17]。此外,AgInS2/LCSMS纳米复合材料和AgInS2量子点相比,AgInS2/LCSMS纳米复合材料在1 250.9 cm-1等处都出现了AgInS2量子点的特征峰。通过对LCS、AgInS2/LCSMS纳米复合材料和AgInS2量子点对比得知,AgInS2量子点已与壳聚糖成功复合。
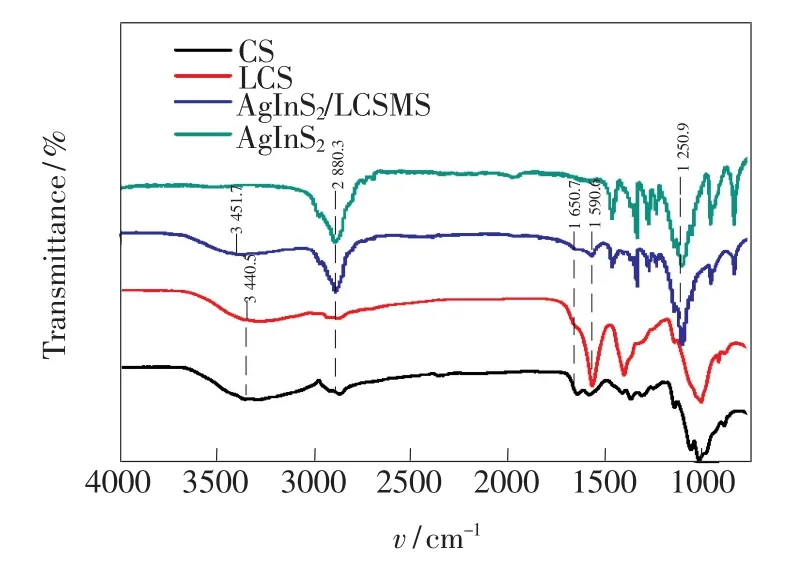
图3 壳聚糖、低分子壳聚糖、AgInS2/LCSMS纳米复合材料、AgInS2量子点的红外光谱。Fig.3 Infrared spectra of CS,LCS,AgInS2/LCSMS,and AgInS2QDs,respectively.
3.3 紫外吸收及发射光谱
图4分别为AgInS2量子点和AgInS2/LCSMS纳米复合材料的紫外吸收光谱和发射光谱。从图4(a)可以看出,AgInS2量子点和AgInS2/LCSMS纳米复合材料的紫外吸收光谱均为宽而且连续的谱带,而且AgInS2/LCSMS纳米复合材料对AgInS2量子点的吸收影响并不显著。之后,利用荧光分光光度计对壳聚糖包裹AgInS2量子点荧光发射强度的影响进行测试研究。设定激发波长为450 nm,激发和发射缝宽都为5 nm。从图4(b)可以看出,壳聚糖包裹AgInS2量子点后的AgInS2/ LCSMS纳米复合材料的荧光强度有所降低,其原因有以下几点:(1)壳聚糖包裹AgInS2量子点后,会造成AgInS2量子点的团聚,而AgInS2量子点间的距离会影响到AgInS2量子点的荧光信号从而导致发光减弱;(2)壳聚糖包裹AgInS2量子点前后pH值发生了变化,包裹修饰后的pH值降低,库伦作用力减小,导致振动剧烈,不稳定,进而发生猝灭,证明壳聚糖已与AgInS2量子点成功复合。
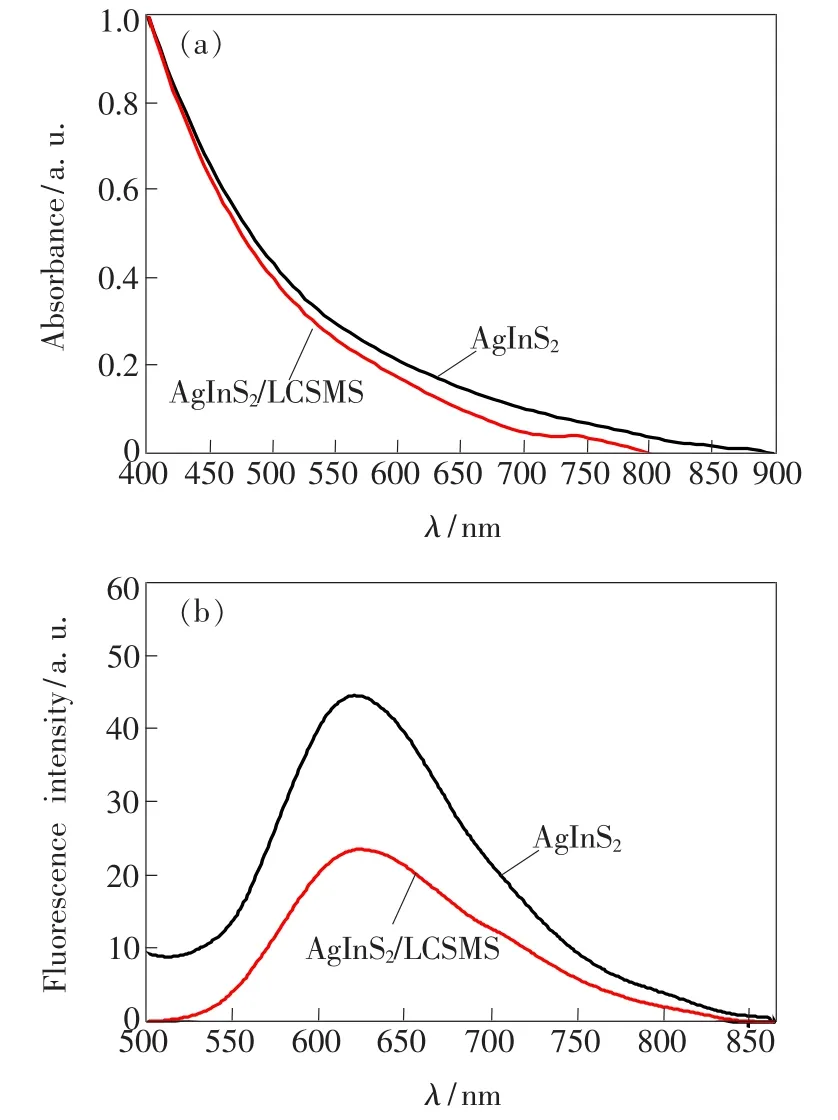
图4 AgInS2量子点、AgInS2/LCSMS纳米复合材料的紫外吸收光谱(a)和发射光谱(b)。Fig.4 Absorption(a)and fluorescence(b)spectra of AgInS2QDs and AgInS2/LCSMS nanocomposites, respectively.
3.4 荧光寿命
荧光寿命是是衡量量子点荧光特性的一个重要物理参量。依据半导体物理理论,不同的晶格电子跃迁会直接影响瞬态荧光发射,量子点是半导体材料,量子点表面态的不同具有不同的电子能级,会表现出不同的晶格缺陷及电子跃迁复合,从而影响荧光衰减过程,宏观体现的就是量子点的荧光寿命值不相同。纳米材料的荧光寿命在纳秒量级,有长寿命和短寿命之分。下面的指数衰减函数较好地拟合了光致发光衰减曲线:
R(t)=A1e(-t/τ1)+A2e(-t/τ2)+A3e(-t/τ3), (1)其中R(t)是延迟时间t时的光致发光强度,A1、A2和A3是振幅,τ1、τ2和τ3是寿命[18-20]。为了获得更多的物理信息,我们利用稳态瞬态荧光光谱仪(FLS980)对所制得的AgInS2量子点及AgInS2/ LCSMS纳米复合材料进行荧光寿命测试。结果如图5所示。
图5为AgInS2量子点、AgInS2/LCSMS纳米复合材料的荧光衰减曲线,其衰减趋势大致相同。该衰减曲线可以用给出的公式拟合,结果见表1。从表中可以看出,与AgInS2量子点相比,AgInS2/ LCSMS纳米复合材料的荧光寿命有所减小。原因之一是壳聚糖包覆后,复合物表面有了声子能量较高的基团,使材料的无辐射跃迁几率明显增加,降低了复合物中量子点的能级寿命;原因之二是壳聚糖的包覆造成了少量量子点的荧光猝灭。同时,寿命变短也是指发光强度衰减到1/e时所需的时间变短,这说明电子在激发态上的布居数有所减少,这个结果与图4 AgInS2/LCSMS纳米复合材料的荧光减弱是一致的。

图5 AgInS2量子点(a)和AgInS2/LCSMS纳米复合材料(b)的荧光衰减曲线Fig.5 Fluorescence decay curves of AgInS2QDs(a)and AgInS2/LCSMSnanocomposites(b)

表1 AgInS2量子点和AgInS2/LCSMS纳米复合材料的荧光寿命指数拟合结果Table 1 Exponential fitting results of the fluorescence lifetime of AgInS2and AgInS2/LCSMS
3.5 AgInS2/LCSMS纳米复合材料的细胞成像
为了进一步检验AgInS2/LCSMS纳米复合材料的生物相容性,我们利用荧光倒置显微镜对注入AgInS2/LCSMS纳米复合材料的细胞进行细胞成像测试,观测AgInS2/LCSMS纳米复合材料所产生的荧光信号。将100μL浓度为3 mg/mL的AgInS2/LCSMS纳米复合材料注入培养好的细胞内,再放回培养箱,4 h后取出,利用pH值为7的 PBS水清洗细胞2次,每次注入2 mL PBS水,最后再加入2 mL PBS水,以便在测试时细胞能够正常存活。利用荧光倒置显微镜进行细胞成像测试,观测AgInS2/LCSMS纳米复合材料所产生的荧光信号。图6为AgInS2/LCSMS纳米复合材料进入细胞后的细胞成像。

图6 AgInS2/LCSMS纳米复合材料荧光倒置显微镜成像Fig.6 Fluorescent inverted microscope images of AgInS2/LCSMS nanocomposites
从图6中可以看出,发出红色荧光信号的是AgInS2/LCSMS纳米复合材料,很多AgInS2/LCSMS纳米复合材料已经顺利进入细胞表层中。通过荧光倒置显微镜可以清楚检测到AgInS2/LCSMS纳米复合材料的荧光信号,而且细胞形态完好仍处于生长状态,AgInS2/LCSMS纳米复合材料也可以正常发射荧光。这表明在AgInS2/LCSMS纳米复合材料进入细胞表层的过程中没有对细胞造成严重损害,AgInS2/LCSMS纳米复合材料本身的特性也未受到影响。

图7 乳腺癌细胞在注入AgInS2量子点、AgInS2/LCSMS纳米复合材料24 h(a)、48 h(b)后的细胞活性。Fig.7 Viability of the breast cancer cells after AgInS2QDs or AgInS2/LCSMSnanocomposites injection 24 h(a) and 48 h(b)
3.6 毒性测试
为了检验该探针是否在生物医学领域具有实用性,我们不仅应该关注它的光学性质,也应该考察其细胞毒性。只有低毒性的探针才有更大的应用价值。我们通过细胞活性(MTT)方法来检测相关纳米材料毒性对细胞的活性影响,利用乳腺癌细胞测其毒性并讨论了AgInS2量子点和AgInS2/LCSMS纳米复合材料在不同浓度与细胞共同培养后经过24 h、48 h对细胞毒性的影响。图7是在细胞中注入同等体积的AgInS2量子点以及包裹同等浓度AgInS2量子点的AgInS2/ LCSMS纳米复合材料在24 h和48 h之后的细胞活性测试。从实验结果可以看出,注入两种纳米材料24 h之后,细胞活性均保持在80%以上;注入两种纳米材料48 h之后,细胞活性仍可保持在60%以上。这说明AgInS2量子点和AgInS2/ LCSMS纳米复合材料对细胞的毒性很低,两种纳米材料均未对细胞造成损伤。而且从图中可以看出,相对于AgInS2量子点,AgInS2/LCSMS纳米复合材料对细胞活性的影响更小。
图8(a)、(b)为AgInS2量子点、AgInS2/ LCSMS纳米复合材料24 h后的细胞形貌,图8(c)、(d)为两种纳米材料注入48 h之后的的细胞形貌。细胞培养的时间越长,量子点和纳米复合材料就会被吸收得越多,所以如果纳米材料有一定的毒性,细胞就会相继死亡。从图8可以看到,在整个观察过程中,细胞形态都正常,没有出现细胞变圆、皱缩、碎裂,说明探针的毒性很小。以上实验结果说明AgInS2/LCSMS纳米复合材料具有很强的生物相容性,其产生的微弱毒性并未对细胞造成损害,可以应用于生物医学检测中。

图8 乳腺癌细胞在注入AgInS2量子点、AgInS2/LCSMS纳米复合材料后的细胞成像。(a)AgInS2量子点, 24 h;(b)AgInS2/LCSMS纳米复合材料,24 h;(c) AgInS2量子点,48 h;(d)AgInS2/LCSMS纳米复合材料,48 h。Fig.8 Images of the cells with AgInS2QDs or AgInS2/ LCSMSnanocomposites injection.(a)AgInS2QDs, 24 h.(b)AgInS2/LCSMS nanocomposites,24 h. (c)AgInS2QDs,48 h.(d)AgInS2/LCSMSnanocomposites,48 h.
4 结 论
利用水溶性的AgInS2量子点与壳聚糖合成了AgInS2/LCSMS纳米复合材料。所制得的AgInS2/LCSMS纳米复合材料的粒径为5~6 nm,分布均匀。壳聚糖的降解并没有破坏壳聚糖的结构。AgInS2/LCSMS纳米复合材料的荧光寿命为21.451 4 ns。所制得的AgInS2/LCSMS纳米复合材料能够进入到细胞内部,对细胞进行荧光标记,并且没有对细胞造成严重的损害。AgInS2/ LCSMS纳米复合材料的细胞活性比AgInS2量子点有了明显的提高,说明通过低分子量壳聚糖的包裹可以明显提高纳米材料的生物相容性。研究结果表明,这类具有较好水溶性和生物相容性的荧光AgInS2/LCSMS纳米复合材料可作为优良的生物荧光标记材料应用在生物医学检验、细胞以及活体成像方面。
[1]Zhong H,Bai Z,Zou B.Tuning the luminescence properties of colloidalⅠ-Ⅲ-Ⅵsemiconductor nanocrystals for optoelectronics and biotechnology applications[J].J.Phys.Chem.Lett.,2012,21(3):3167-3175.
[2]Wang S.The preparation of chitosanmicrospheres[J].Technol.Equip.(工艺与设备),2006(8):13-14(in Chinese).
[3]Ding X B,Sun ZH,Wan G X.Heat sensitive polymer package and synthesis ofmagnetic chitosan[J].J.Polym.(高分子学报),1998(5):628-631(in Chinese).
[4]Jiang W,Li F S,Yang Y,et al.The preparation ofmagnetic chitosan composite microspheres and performance research [J].J.Mater.Sci.Eng.(材料科学与工程学报),2004,22(5):660-662(in Chinese).
[5]Park JH,Im K H,Lee SH,et al.Preparation and characterization ofmagnetic chitosan particles for hyperthermia application[J].J.Magn.Magnet.Mater.,2005,293:328-333
[6]Zhang H Z,Sun X M,Li BH.The preparation ofmagnetic chitosanmicrosphere and its adsorption on abscisic acid[J]. J.Wuhan Univ.(武汉大学学报),2007,53(6):669-673(in Chinese).
[7]Zhang C,Qu G,Sun Y,et al.Biological evaluation of N-octyl-O-sulfate chitosan as a new nano-carrier of intravenous drugs[J].Eur.J.Pharm.Sci.,2008,33(4-5):415-423.
[8]Grenha A,Remunán-López C,Carvalho E L S,et al.Microspheres containing lipid/chitosan nanoparticles complexes for pulmonary delivery of therapeutic proteins[J].Eur.J.Pharm.Biopharm.,2008,69(1):83-93.
[9]Sinha V R,Singla A K,Wadhawan S,etal.Chitosanmicrospheres as a potential carrier for drugs[J].Int.J.Pharm., 2004,274(1-2):1-33.
[10]Pedro A S,Cabral-Albuquerque E,Ferreira D,etal.Chitosan:An option for developmentof essential oil delivery systems for oral cavity care?[J].Carbohyd.Polym.,2009,76(4):501-508.
[11]Genta I,CostantiniM,Asti A,et al.Influence of glutaraldehyde on drug release and mucoadhesive properties of chitosan microspheres[J].Carbohyd.Polym.,1998,36(2):81-88.
[12]Lorenzo-Lamosa M L,Remunán-López C,Vila-Jato JL,et al.Design ofmicroencapsulated chitosanmicrospheres for colonic drug delivery[J].J.Control.Release,1998,52(1-2):109-118.
[13]Gu Y H,Wang L,Tan TW,et al.Preparation of uniform-sized chitosanmicrospheres and application as carriers for protein drugs[J].Chin.J.Biotechnol.(生物工程学报),2006,22(1):150-155(in Chinese).
[14]Taqieddin E,Amiji M.Enzyme immobilization in novel alginate-chitosan core-shell microcapsules[J].Biomaterials, 2004,25(10):1937-45.
[15]El-Hameed M D A,Kellaway IW.Preparation and in vitro characterisation ofmucoadhesive polymericmicrospheres as intra-nasal delivery systems[J].Eur.J.Pharm.Biopharm.,1997,44(1):53-60.
[16]Shirasaki Y,Supran G J,Bawendi M G,et al.Emergence of colloidal quantum-dot light-emitting technologies[J].Nat. Photon.,2013,7(1):13-23.
[17]Zhao J Y.The Preparation of Chitosan Nano Fluorescent Probes,Characterization and Application[D].Hangzhou:Zhejiang University,2006(in Chinese).
[18]Tuan V D.Biomedical Photonics Handbook[M].Florida:CRC Press,2003:921.
[19]Qu JL.Theory and Experimental Research of Fluorescence Lifetime Imaging Microscopy[D].Xi'an:Xi'an Institute of Optics and Precision Mechanics,Chinese Academy of Sciences,1998(in Chinese).
[20]Periasamy A,Sharman K K,Ahuja R,etal.A single green fluorescent protein fluorescence lifetime imaging in living cells [J].SPIE,1999,3604:6212-6218.

张晓凡(1990-),女,河北沧州人,硕士研究生,2013年于长春理工大学获得学士学位,主要从事生物光子学与纳米光子学方面的研究。
E-mail:xiaofan0931301@163.com

刘丽炜(1979-),女,吉林长春人,博士,博士生导师,2013年于长春理工大学获得博士学位,主要从事纳米光子学与生物光子学方面的研究。
E-mail:
llw_cust@163.com
Physical Characterization and Biological Toxicity of Chitosan-capped AgInS2Quantum Dots
ZHANG Xiao-fan,LIU Li-wei*,ZOU Peng,HU Si-yi,WANG Yue,ZHANG Xi-he
(School ofScience,Changchun University ofScience and Technology,Changchun 130022,China) *Corresponding Author,E-mail:liulw@cust.edu.cn
The water-soluble AgInS2quantum dots/low molecular weight chitosan nanocomposites (AgInS2/LCSMS)were successfully synthesized.Natural polysaccharide in alkaline polysaccharide——Chitosan was used as stabilizer and capped agent.The structure,chemical composition,and optical properties of AgInS2/LCSMS nanocompositeswere studied by transmission electron microscopy(TEM), Fourier transform infrared spectroscopy(FT-IR),fluorescencemicroscope,fluorescence spectrophotometer,and UV-Vis absorption spectroscopy,etc.The results show that the particle diameter of AgInS2/ LCSMSnanocomposites is about5-6 nm,and they are still have a relatively stable luminescence in the water phase.In addition,we studied the biological compatibility of the AgInS2/LCSMSnanocomposites. Compared with pure AgInS2quantum dots,the cell activity of AgInS2/LCSMSnanocomposites has an obvious improvement.It shows that lowmolecularweight chitosan wrapping can obviously improve the biocompatibility of the nanometermaterials.Therefore,this kind of AgInS2/LCSMS fluorescentnanocompositeswith good water solubility and biological compatibility show significant value for potential applications in biomedicine test,biolabel,cell and in vivo imaging studies.
low molecular weight chitosan;AgInS2quantum dots;toxicity
O482.31
:ADOI:10.3788/fgxb20153610.1118
1000-7032(2015)10-1118-08
2015-06-15;
2015-08-12
国家自然科学基金(11204020);吉林省国际纳米光子学与生物光子学重点实验室支撑项目(20140622009JC);国防预研究基金(62201070711)资助项目
