Aβ1~42及二氮嗪预处理对神经细胞Na+-K+-ATP酶β亚基蛋白表达的影响
2015-09-12夏春凤李艳菊马国诏段瑞生朱梅佳
朱 瑾 夏春凤 李艳菊 马国诏 段瑞生 朱梅佳
(山东大学附属省立医院神经内科,山东 济南 250021)
过度氧化应激与自由基毒性作用在AD的发病中起着重要作用。Aβ产生大量的自由基,可直接氧化酶蛋白氨基酸残基,使酶失活,影响Na+-K+-ATP酶活性,引起神经细胞内Na+的聚集,K+的流失,细胞的离子失衡,内环境的紊乱。已有研究表明单唾液酸四已节苷脂(GM1)可以通过维持中枢神经细胞膜上的Na+-K+-ATP酶的活性〔1~4〕,起到维持细胞内外离子平衡、减轻神经细胞水肿、防止细胞内Ca2+聚集的作用;还可以对抗兴奋性氨基酸的神经毒性作用,减少自由基对神经细胞的损害,起到神经保护作用。而ATP敏感钾通道(ATP,KATP通道)开放药物二氮嗪可降低Aβ寡聚体聚集,用二氮嗪预处理能够抵抗Aβ1~42的神经毒性〔5〕。但二氮嗪的预处理是否影响Aβ对Na+-K+-ATP酶β亚基蛋白的表达,目前尚未报道。因此,本研究旨在探讨Aβ1~42及二氮嗪预干预对神经细胞Na+-K+-ATP酶β亚基蛋白表达的影响。
1 材料与方法
1.1 实验材料 Wistar种系的大乳鼠(出生24 h内),雌雄不限,由山东大学实验动物中心提供;Aβ1~42、二氮嗪、多聚赖氨酸均购自美国Sigma公司;胎牛血清、B27 supplement及Neurobasal培养基均购自美国Gibco公司;DMEM高糖培养基购自海克隆公司;Na+-K+-ATP酶β亚基抗体购自美国Santa Cruz公司;DyLight 488,山羊抗鼠 IgG购自Abbkine公司;山羊抗鼠IgG/辣根酶标记购自中杉公司;二甲基亚砜(DMSO)购自上海生博医学生物工程科技有限公司。
1.2 实验方法
1.2.1 大鼠皮层海马神经细胞培养 选用Wsitar大鼠新生24 h的胎鼠,75%酒精消毒,在无菌条件下,用显微镊子分离出大脑皮层及海马置于D-Hank液中,剥除脑膜,然后将脑组织剪成碎块,0.125%胰酶(37℃)消化10 min,用含10%胎牛血清的DMEM培养液终止消化,吸管吹打均匀后200目不锈钢筛网过滤,1000 r/min离心10 min,加入含10%胎牛血清的DMEM培养液,吸管吹打成单细胞悬液,加到多聚赖氨酸包被的12孔板,接种密度6×105个/ml,培养皿的接种密度 2×106个/ml,37℃、5%CO2孵育箱中培养,第二天换含2%B27 supplement的Neurobasal的培养液,以后每2 d换液1次,第7天加药处理。
1.2.2 分组及药物处理 Aβ1~42人工重组蛋白质0.1 mg,溶于 10 μl DMSO 中,再用 100 μl磷酸盐缓冲液稀释(pH7.4),配成浓度为221 μmol/L,即为原液。将原液置于37℃恒温箱内孵育48 h进行老化处理,4℃备用。二氮嗪(2 mg)溶于200 μl的DMSO中,终浓度为1 mmol/L,4℃备用。实验分为四组:空白对照组、单独 Aβ1~42干预组、二氮嗪预处理 1 h 后 Aβ1~42干预组、单纯二氮嗪预处理组,每组又分为24 h及72 h两个亚组。细胞培养第7天,二氮嗪预处理1 h后Aβ1~42干预组加入二氮嗪(50 μmol/L)预处理 1h 后加入 Aβ1~42(2 μmol/L)作用;单独Aβ1~42干预组加入等量的磷酸盐缓冲液预处理1 h后,加入等量Aβ1~42;单独二氮嗪预处理组为加入二氮嗪预处理1 h后加入等量培养液;对照组加等量磷酸盐缓冲液和培养液。分别在孵育24、72 h后进行免疫荧光及免疫印迹检测。
1.2.3 免疫荧光检测各组Na+-K+-ATP酶β亚基的蛋白表达培养加药后的细胞爬片,用4%的多聚甲醛固定15 min,0.2%Triton孵育30 min,用封闭液室温封闭60 min,去封闭液后加入稀释的鼠抗大鼠Na+-K+-ATP酶β亚基抗体一抗(1∶50)4℃过夜,次日磷酸盐缓冲液(PBST)洗3×5 min,加二抗室温60 min,PBST 洗3×5 min,二脒基-2-苯基吲哚(DAPI)染核后防荧光淬灭封片剂封片,用PBS代替一抗作为阴性对照,荧光显微镜观察染色结果。
1.2.4 Western印迹检测各组Na+-K+-ATP酶β亚基蛋白的表达 Aβ1~42作用神经细胞24 h及72 h后提取细胞并用PBS洗涤3次后晾干,加入适量的蛋白裂能液(RIPA)裂解液苯甲基磺酰氟溶液(PMSF)(100∶1)冰浴中裂解细胞,刮勺收集细胞,4℃离心后,一组进行蛋白浓度测定,用二喹啉甲酸(BCA)法蛋白定量,另一组加1/3的loading buffer(4×),100℃水浴10 min,-80℃冻存。次日灌胶,取相应蛋白量上样,行10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,然后电转移至聚偏氟乙烯(PVDF)膜上,5%脱脂牛奶封闭后加入一抗稀释液,鼠抗大鼠Na+-K+-ATP酶β亚基抗体一抗(1∶100)于4℃孵育过夜,次日用TBST缓冲液洗3×10 min,加入辣根过氧化物酶标记的二抗(辣根过氧化物酶标记的山羊抗鼠IgG抗体)于室温孵育1 h,再用TBST缓冲液洗3×10 min,加入发光剂(ECL)显色,以β-actin作为内参,用图像分析软件Band Scan进行光密度积分值分析。
1.3 统计学方法 应用SPSS17.0软件行单因素方差。
2 结果
2.1 免疫荧光检测24 h、72 h、神经细胞Na+-K+-ATP酶β亚基荧光强度 单独Aβ1~42作用神经细胞24 h后,Na+-K+-ATP酶β亚基荧光染色强度较对照组没有明显改变;经二氮嗪预处理后Aβ1~42作用24 h后,Na+-K+-ATP酶β亚基的荧光染色强度也没有明显改变。单独Aβ1~42作用神经细胞72 h后,Na+-K+-ATP酶β亚基荧光染色强度较对照组显著降低;经二氮嗪预处理后Aβ1~42作用72 h后,与单独Aβ1~42干预组相比较有所增强;单独二氮嗪干预组Na+-K+-ATP酶β亚基荧光染色强度与对照组和Aβ1~42+二氮嗪组没有明显改变。见图1。
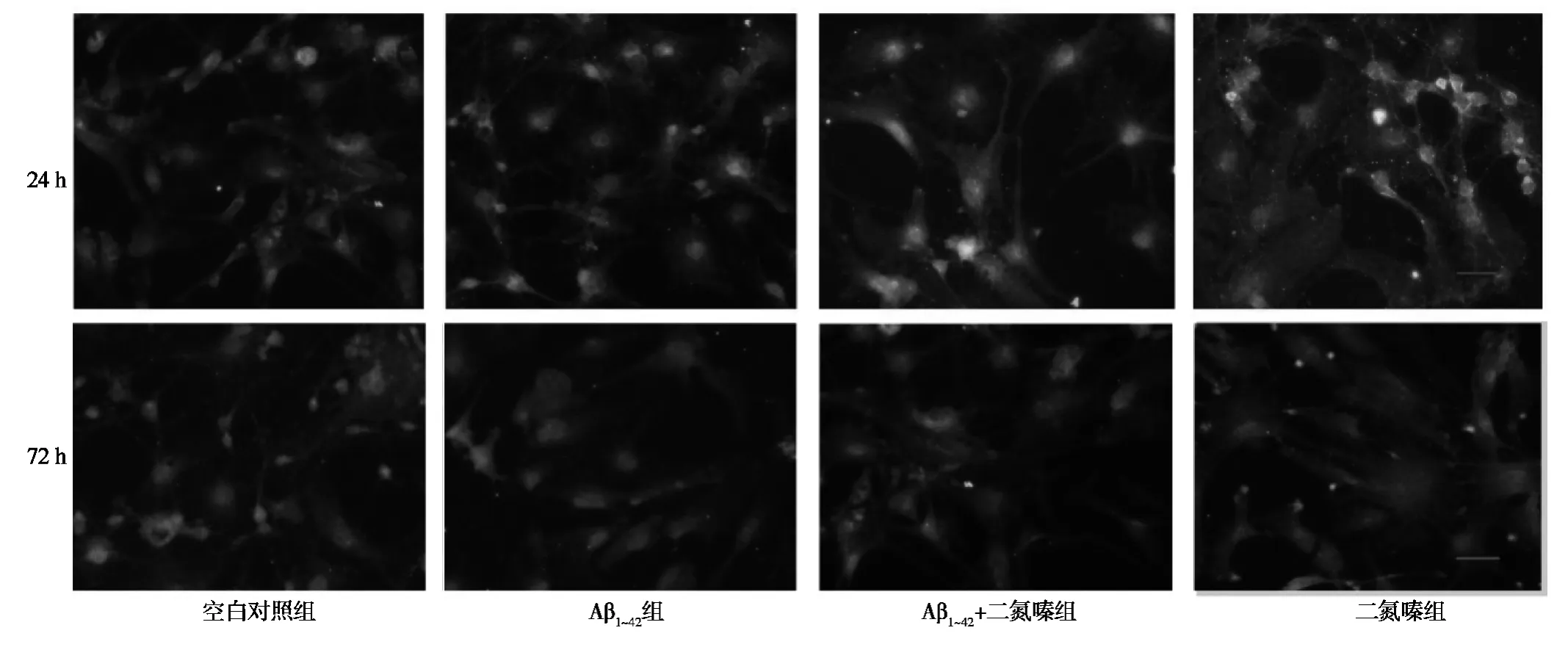
图1 免疫荧光染色观察各组细胞培养24 h、72 h后Na+-K+-ATP酶β亚基荧光强度变化(×400)
2.2 蛋白电泳检测24 h、72 h神经细胞Na+-K+-ATP酶β亚基蛋白表达变化 单独Aβ1~42作用神经细胞24 h后,Na+-K+-ATP酶β亚基蛋白表达与对照组比较没有明显改变;二氮嗪预处理神经细胞1 h协同Aβ1~42作用24 h后及单独二氮嗪组Na+-K+-ATP酶β亚基的蛋白表达明显低于对照组及单独Aβ1~42组(P<0.01)。单独Aβ1~42作用72 h后,Na+-K+-ATP酶 β 亚基蛋白表达较对照组降低(P<0.05);二氮嗪预处理1 h协同Aβ1~42共同作用72 h后,与单独Aβ1~42干预组相比,增加了Na+-K+-ATP酶β亚基蛋白表达量(P<0.05);单独二氮嗪干预组Na+-K+-ATP酶β亚基蛋白表达明显低于以上各组(P<0.01)。见图2。
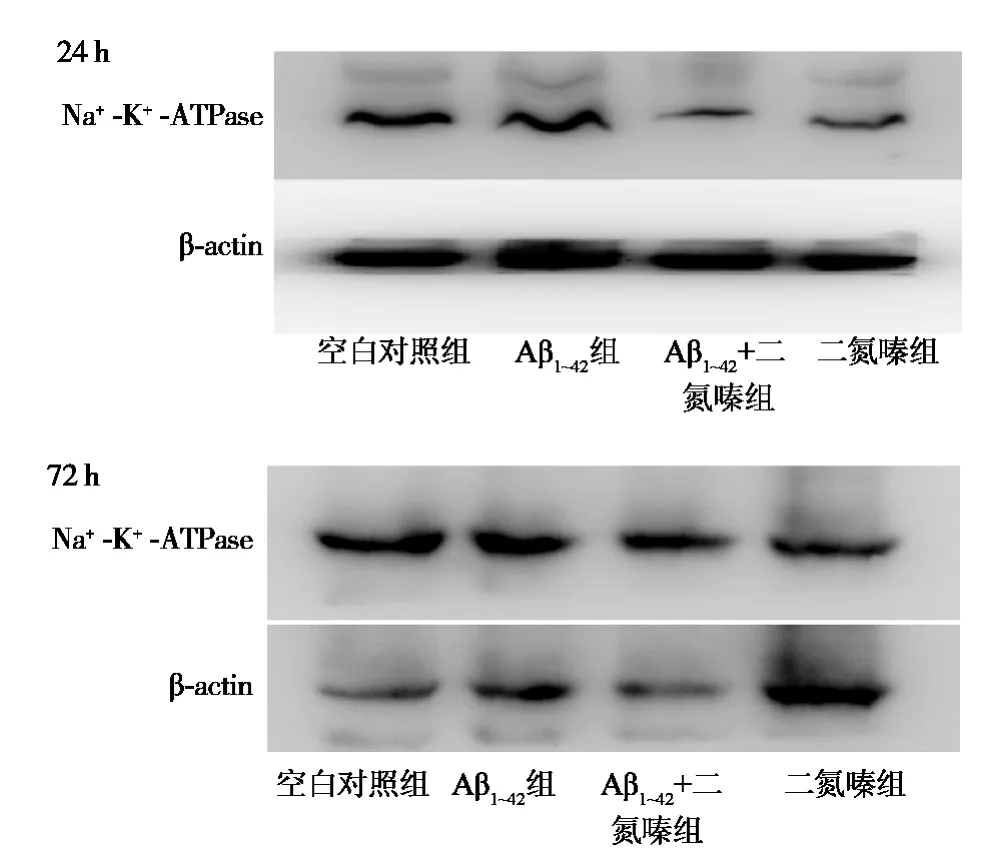
图2 免疫印迹检测各组处理24 h、72 h Na+-K+-ATP酶β亚基蛋白表达的变化
3 讨论
老年炎性斑内的大量Aβ沉积在AD发病机制中起到重要作用。而Aβ的神经毒性机制也极其复杂,与过度氧化应激、Ca2+的超载、谷氨酸浓度的增高等有着一定的关系。
本研究提示Aβ对Na+-K+-ATP酶β亚基有影响,其机制可能与启动细胞的氧化应激反应、神经细胞的凋亡级联反应有关〔6〕。Aβ本身或通过多种途径可以产生、诱导活性氧(ROS),使神经细胞质中自由基浓度升高,它的增加使脂质过氧化,形成脂质过氧化物,蛋白被氧化修饰,线粒体功能失调〔7〕,使有氧呼吸链电子传递形成短路,减少ATP生成;还可经自由基链式反应的作用,使细胞膜受到损害〔8〕,继而影响ATP酶,使其活性下降。谷胱甘肽(GSH)在抗氧化物及自由基的损伤中有重要作用,是大脑的主要抗氧化剂,氧自由基攻击Na+-K+-ATP酶中富含的赖氨酸、脯氨酸、半胱氨酸等,减少GSH的合成,加重氧化应激〔9〕;还能导致细胞内 Na+、Ca2+增加,K+降低,影响跨膜Na+浓度梯度的重建,进一步影响Na+-Ca2+交换,加重Ca2+浓度的升高。Aβ还会直接导致细胞内Ca2+的升高〔10〕,Ca2+超载也会引起细胞内环境失衡,从而导致离子通道开放,谷氨酸大量释放到突触间隙或直接影响谷氨酸转运体(GLT)-1和谷氨酸-天冬氨酸转运体(GLAST)的活性功能,从而导致突触间隙谷氨酸浓度的异常增高及线粒体功能失调〔11〕,刺激N-甲基-D-天冬氨酸(NMDA)受体过度兴奋〔12〕,细胞代谢紊乱。
二氮嗪在有神经细胞毒性物质Aβ1~42长时间如72 h存在时,首先Aβ1~42启动了细胞线粒体介导的过度氧化应激反应和细胞凋亡级联反应,二氮嗪预开放线粒体ATP敏感钾离子通道,它的开放对维持线粒体膜电位的极化状态有极其重要的作用。K+主要自细胞质流向线粒体内,离子的跨膜转运形成线粒体膜电位的升高〔13〕,细胞膜超极化或复极化,抑制电压依赖性钙通道的开放,减少Ca2+通过L型通道内流,以及Na+-Ca2+交换的逆转〔14〕,有益于减少细胞线粒体内钙超载,增强细胞在代谢应激条件下的活性。线粒体膜电位升高在一定程度上可以减少细胞内氧自由基的生成,减少了氧化应激反应,产生自身保护作用,保护了神经细胞活性,维持了细胞的ATP正常代谢,促进了细胞膜上Na+-K+-ATP酶的生理功能,增强向细胞内转运K+的功能,从而增加了Na+-K+-ATP酶β亚基蛋白表达水平;还使线粒体基质体积增加,能够激活脂肪酸氧化及电子转移,促进ATP的生成,有利于神经细胞的存活〔15〕。
但是,二氮嗪在有神经细胞毒性物质Aβ1~42较短时间如24 h存在时,一方面,有研究表明,当胞内ATP水平低到某一临界值时,KATP通道被激活发挥作用〔16〕。另一方面,Aβ1~42作用导致细胞线粒体介导的氧化应激反应,同时还没有启动细胞凋亡级联反应。因此,即使当二氮嗪预开放 KATP通道,钾离子主要自细胞质流向组织间液,还没有流向线粒体内。可能24 h细胞的氧化应激反应主要发生在细胞间质,而不是线粒体内。因此,Aβ1~42和二氮嗪共同作用24 h,并没有明显地影响到 Na+-K+-ATP酶β亚基的生理作用,可能是二氮嗪与Aβ1~42共同作用对Na+-K+-ATP酶β亚基的影响呈现时间依赖性。
另有研究证实二氮嗪作用神经细胞可导致ROS的产生,在健康细胞中此作用可能不明显〔17〕,当单独二氮嗪作用神经细胞时,产生氧化应激反应,影响Na+-K+-ATP酶活性。另外,二氮嗪是KATP通道开放剂,开放了KATP通道后,可促进神经细胞胞膜超极化,线粒体内膜去极化,K+主要由细胞质外流到组织间液,从而在一定程度上抑制了Na+-K+-ATP酶将2个K+泵入细胞内的生理作用。因此,24 h和72 h蛋白电泳显示单独应用二氮嗪明显降低了Na+-K+-ATP酶β亚基的蛋白表达水平。
1 纪 慧,田 华,刘 富,等.葛根素对血管性痴呆小鼠脑组织AchE及Na+-K+-ATP酶活性的影响〔J〕.齐齐哈尔医学院学报,2013;34(21):3121-3.
2 马立峰,郭 艾,于浩森,等.钠钾ATP酶α亚基表达和细胞生长相关性的研究进展〔J〕.中华损伤与修复,2013;8(6):68-71.
3 Marshall WS,Bryson SE.Transport mechanisms of seawater teleost chloride cells:an inclusive model of a multifunctional cell〔J〕.Comp Biochem Physiol A Mol Integr Physiol,1998;119(1):97-106.
4 Kreutz F,Scherer EB,Ferreira AG,et al.Alterations on Na+-K+-ATPase and acetylcholinesterase activities induced by amyloid-β peptide in rat brain and GM1 ganglioside neuroprotective action〔J〕.Neurochem Res,2013;38(11):2342-50.
5 付庆喜,马国诏,车峰远,等.二氮嗪预处理对Aβ1~42作用神经细胞KATP各亚基表达的影响〔J〕.山东大学学报(医学版),2011;49(9):24-9.
6 Zeng XW,Wang T,Jiang LL,et al.Diazoxide and cyclosporin a protect primary cholinergic neurons against beta-amyloid(1~42)-induced cytotoxicity〔J〕.Neurol Res,2013;359(5):529-36.
7 Nelson TJ,Alkon DL.Oxidation of cholesterol by amyloid precursor pro-tein and β-amyloid peptide〔J〕.J Biol Chem,2005;280(8):7377-87.
8 Singh RB,Hryshko L,Freed D,et al.Activation of proteolytic enzymes and depression of the sarcolemmal Na+-K+-ATPase in ischemia-reperfused heart may be mediated through oxidative stress〔J〕.Can J Physiol Pharmacol,2012;90(2):249-60.
9 Vitvitsky VM,Garg SK,Keep RF,et al.Na+and K+ion imbalances in Alzheimer's disease〔J〕.Biochim Biophys Acta,2012;1822(11):1671-81.
10 Lawton JS,Hsia PW,Damiano RJ Jr.The adenosine-triphosphate-sensitive potassium-channel opener pinacidil is effective in blood cardioplegia〔J〕.Ann Thora Surg,1998;66(3):768-73.
11 Tickler AK,Wade JD,Separovic F.The role of Aβ peptides in Alzheimer's disease〔J〕.Protein Pept Lett,2005;12(6):513-9.
12 Roselli F,Tirard M,Lu J,et al.Soluble β-amyloid1-40 induces NMDA-dependent degradation of postsynaptic density-95 at glutamatergic synapses〔J〕.J Neurosci,2005;25(48):11061-70.
13 Ding F,Shao ZW,Yang S,et al.Role of mitochondrial pathway in compression-induced apoptosis of nucleus pulposus cells〔J〕.Apoptosis,2012;17(6):579-90.
14 Jahangir A,Terzic A.KATP channel therapeutics at the bedside〔J〕.J Mol Cell Cardiol,2005;39(1):99-112.
15 Gross GJ.The role of mitochondrial KATP channels in cardioprotection〔J〕.Basic Res Cardiol,2000;95(4):280-4.
16 Liu J,Yin F,Zhang X,et al.Geniposide,a novel agonist for GLP-1 receptor,prevents PC12 cells from oxidative damage via MAP kinase pathway〔J〕.Neurochem Int,2007;51(6-7):361-9.
17 O'Rourke B.Evidence for mitochondrial K+channels and their role in cardioprotection〔J〕.Circ Res,2004;94(4):420-32.
