抗乳腺癌新药palbociclib
2015-09-12刘恕徐军崔毅宿央央
刘恕,徐军,崔毅,宿央央
(药渡经纬信息科技(北京)有限公司,北京 100085)
抗乳腺癌新药palbociclib
刘恕,徐军,崔毅,宿央央
(药渡经纬信息科技(北京)有限公司,北京 100085)
Palbociclib是2015年2月3日获美国食品药品监督管理局加速批准的乳腺癌新药,联合来曲唑作为以内分泌治疗为基础的初始方案,用于治疗绝经期女性雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)的绝经期女性晚期乳腺癌。Palbociclib是首个口服、靶向性CDK4/6抑制剂,阻止细胞周期从生长期(G1期)到DNA复制期(S1期)的转变,从而抑制肿瘤增殖,其上市为晚期乳腺癌患者提供了新的治疗选择。介绍palbociclib的化学合成、临床前药理学研究、临床研究及专利保护情况等,为抗乳腺癌新药研发提供参考。
palbociclib;细胞周期蛋白依赖性激酶4/6抑制剂;乳腺癌
Palbociclib(商品名为Ibrance,1)是由辉瑞公司(Pfizer)研发的治疗乳腺癌新药,于2015年2月3日获美国食品药品监督管理局(FDA)加速批准上市。Palbociclib为全球首个细胞周期蛋白依赖性激酶(CDK)4/6抑制剂,与来曲唑联合作为以内分泌治疗为基础的一线疗法,用于治疗未曾接受过系统治疗的雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)的绝经期女性晚期乳腺癌[1]。
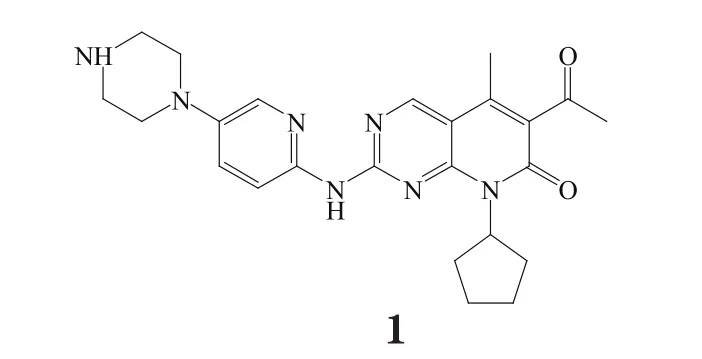
Palbociclib的英文名为6-acetyl-8-cyclopentyl-5-methyl-2-{[5-(piperazin-1-yl)pyridin-2yl]amino} pyrido[2,3-d]pyrimidin-7(8H)-one;分子式为C24H29N7O2;CAS登记号为571190-30-2。
Palbociclib为胶囊剂(75 mg、100 mg或125 mg),推荐起始剂量为125 mg(qd,po),与食物同服,服用21 d后停药7 d。建议根据个体安全性和耐受性中断和/或剂量减低给药。
1 合成方法
1.1 方法1
以4-氯-2-甲硫基嘧啶-5-甲酸乙酯(2)和环戊胺(3)为原料,经碱性条件下的胺化反应、LiAlH4还原反应、MnO2 氧化反应、格氏试剂甲基溴化镁存在下的亲核加成反应以及4- 甲基吗啉-N- 氧化物(NMO)/ 四丙基高钌酸铵(TPAP)氧化反应,5 步反应以51%的收率实现了化合物2 中甲酸乙酯到甲基酮的转变,生成了中间体8。中间体8 在NaH 的作用下先与膦酰基乙酸三乙酯(9) 发生Witting-Horner 反应, 再经分子内环化反应以92% 的收率得到中间体10,10 在引发剂过氧化二苯甲酰(BPO)作用下与N- 溴代丁二酰亚胺(NBS)发生溴代反应,随后在氧杂吖丙啶(12)作用下发生氧化反应生成亚砜13。13 与化合物14 发生胺化反应后再与锡试剂16 发生Still 反应,最后,在酸性条件脱除保护基,即以8.4% 的总收率得到palbociclib 的盐酸盐(见图1)[2-3]。
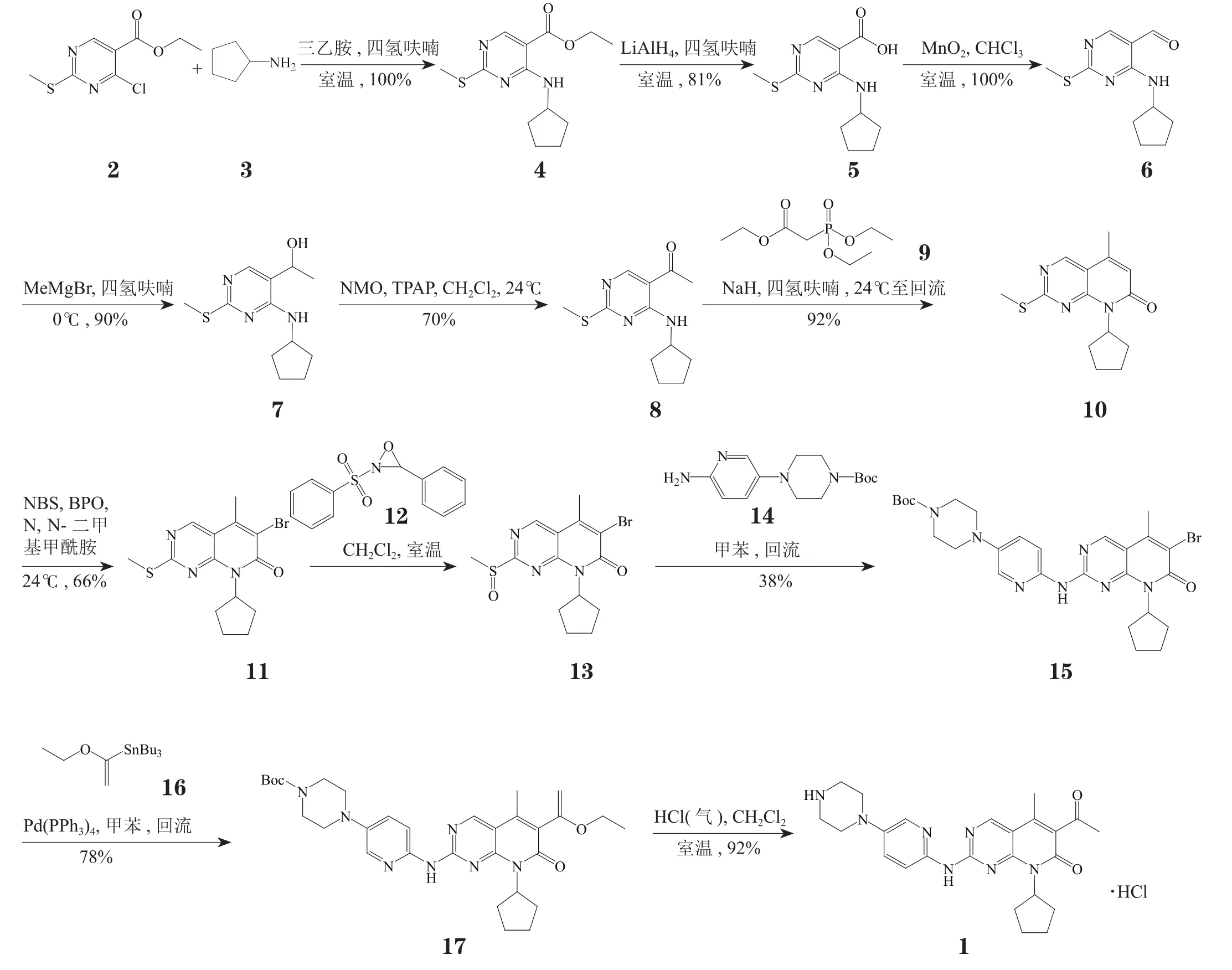
图1 Palbociclib的合成方法1Figure 1 Palbociclib synthesis: route 1
1.2 方法2
以5-溴-2,4-二氯嘧啶(18)和环戊胺(3)为起始原料,经碱性条件下的胺化反应、Heck反应、醋酸酐条件下的分子内环化反应以及NBS溴代反应,4步以51%的收率得到中间体22。22在异丙基溴化镁作用下与化合物14发生胺化反应,随之与化合物23经Heck反应得到中间体24。酸性条件下脱除24中的保护基,最终以35%~37%的总收率得到palbociclib(见图2)[4-5]。
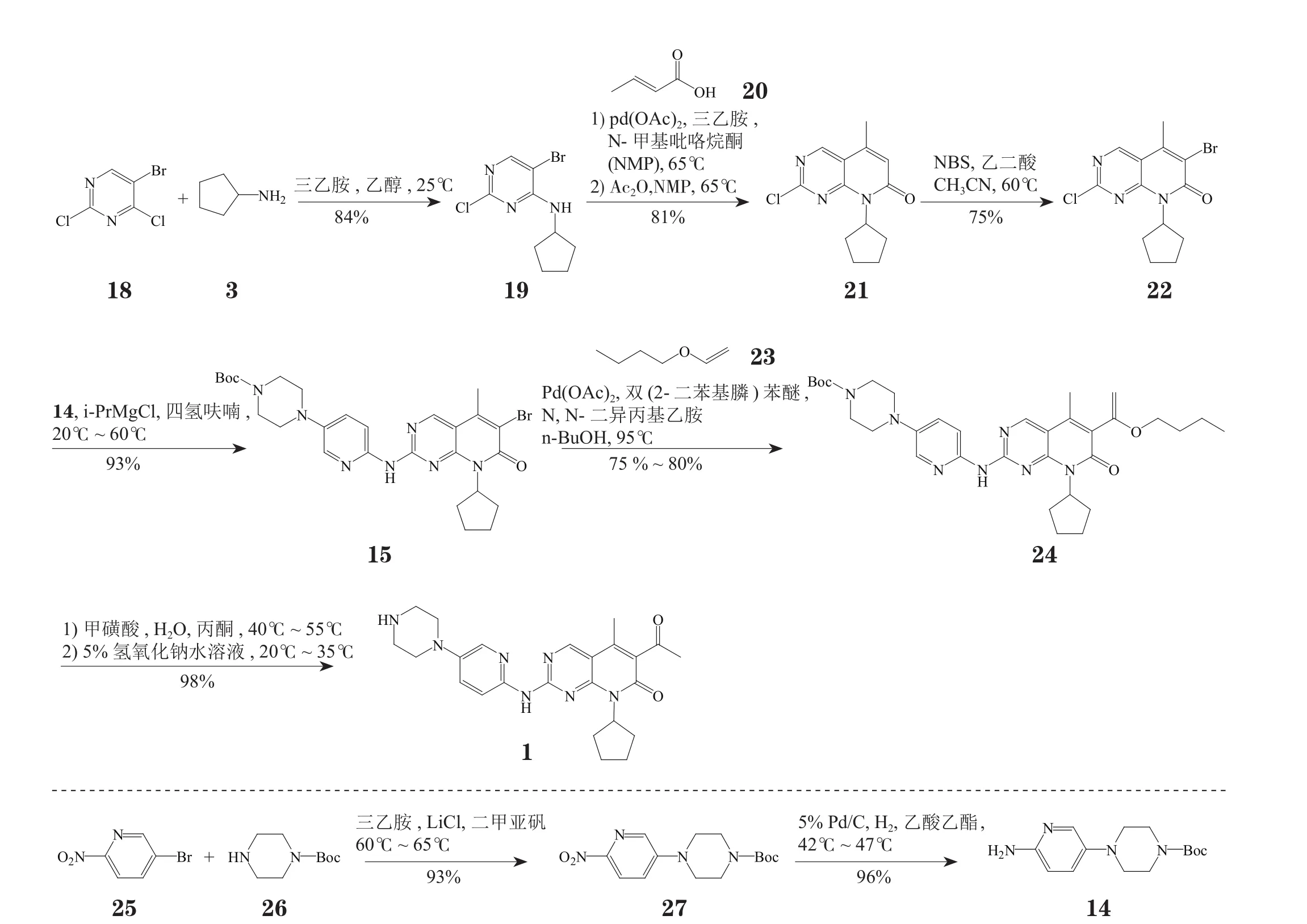
图 2 Palbociclib 的合成方法2Figure 2 Palbociclib synthesis: route 2
2 临床前药理学研究
CDK4/6 激酶是细胞周期的关键调节因子,可触发细胞周期从生长期(G1 期)到DNA 复制期(S1 期)的转变。在雌激素受体阳性(ER+)乳腺癌中,CDK4/6激酶处于过度活跃状态。Palbociclib 为选择性CDK4/6抑制剂,通过抑制CDK4/6 对成视网膜母细胞瘤蛋白(retinoblastomaprotein,Rb)的磷酸化作用,从而阻止肿瘤细胞进入细胞周期循环,抑制肿瘤细胞的增殖或诱导肿瘤细胞的凋亡[6-7](见图3)。Palbociclib 的体外药效学、体内和体外药代动力学参数、药物相互作用及安全性评价数据见表1[8]。
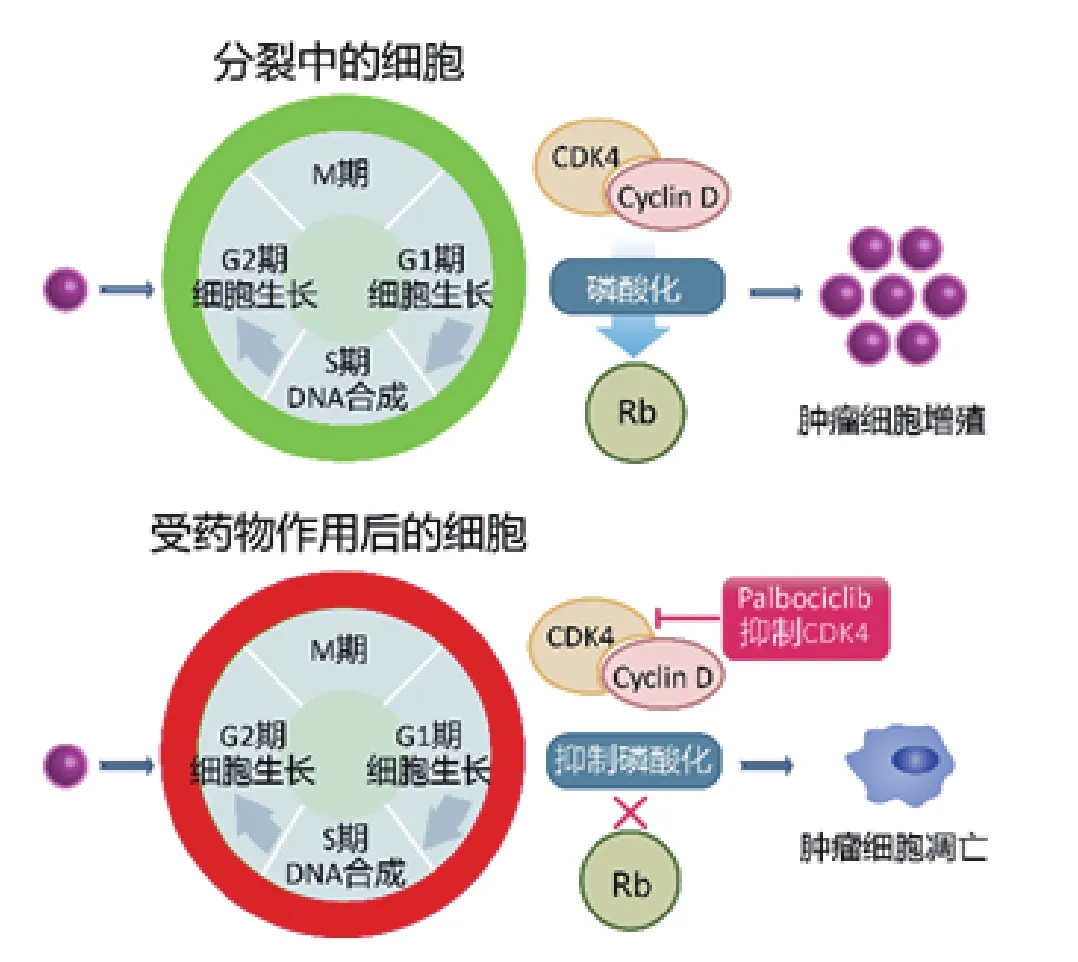
图 3 Palbociclib 的作用机制Figure 3 Acting mechanism of palbociclib
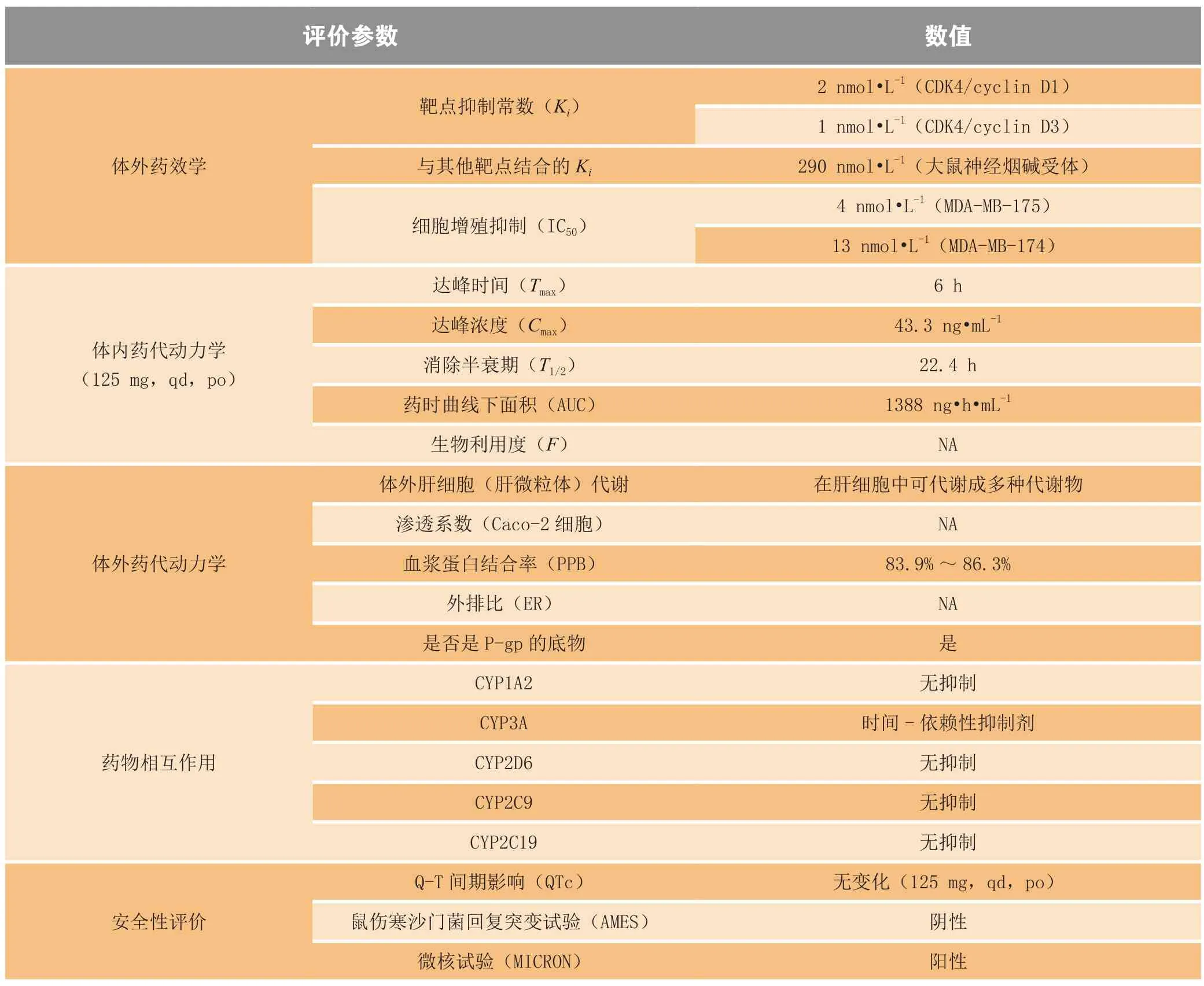
表1 Palbociclib的临床前药理学数据Table 1 Preclinical pharmacology data of palbociclib
3 临床研究
Palbociclib的获批是基于一项随机开放的多中心Ⅱ期临床试验结果[8],这项研究共纳入165名未接受其他治疗的ER+/HER2-晚期乳腺癌患者,主要比较了palbociclib联合来曲唑治疗或来曲唑单独治疗的疗效与安全性,无进展生存期(progression-free survival, PFS)作为首要终点指标(P=0.000 4)。结果显示,palbociclib+来曲唑联合治疗组患者(n=84)的中位PFS为20.2个月(95% CI为13.8~27.5个月),而来曲唑单独治疗组(n=81)患者的中位PFS仅为10.2个月(95% CI为5.7~12.6个月),两组比较的风险比为0.488(95% CI为0.319~0.748)。研究显示,在安全性方面,palbociclib +来曲唑联合治疗组常见的不良反应为中性粒细胞减少,其中有48%的患者出现了3度中性粒细胞减少;其他常见的不良反应还包括白细胞减少、贫血和疲劳等。
PALOMA-3是首项关于CDK4/6抑制剂palbociclib治疗HR+/ HER2-晚期乳腺癌的随机、双盲、多中心Ⅲ期临床研究,该研究入组了521例转移性乳腺癌患者,随机分为“氟维司群+安慰剂组(对照组)”或“氟维司群+palbociclib(治疗组)”,因研究提前达到主要研究终点PFS期而被提前终止[9]。结果显示,治疗组和对照组的PFS期分别为9.2、3.8个月(P<0.000 001);临床获益率分别为34%和19%(P=0.000 4),随访中死亡病例仅28例,未达总生存(OS)分析事件数。该研究值得关注的是治疗组的血液学副反应,表现为中性粒细胞减少(发生率达79%),其中3、4级毒性反应发生率分别为53%和9%;贫血和血小板减少症发生率分别为26%和19%,显著高于对照组。因此,治疗组方案推迟或剂量降低率分别22%和32%,而对照组分别仅1%和2%,但中断治疗比例两组相似(2.6%和1.7%)。
4 专利布局
4.1 Ibrance®化合物专利的全球布局
Ibrance®作为辉瑞公司首个上市的CDK4/6抗癌新药,早在2003年就以PCT申请对其化合物专利进行了战略市场保护(公开号WO03062236A1),并陆续在欧州(EP)、美国(US)、日本(JP)、中国(CN)等药品主流市场获得专利授权(见表2)。
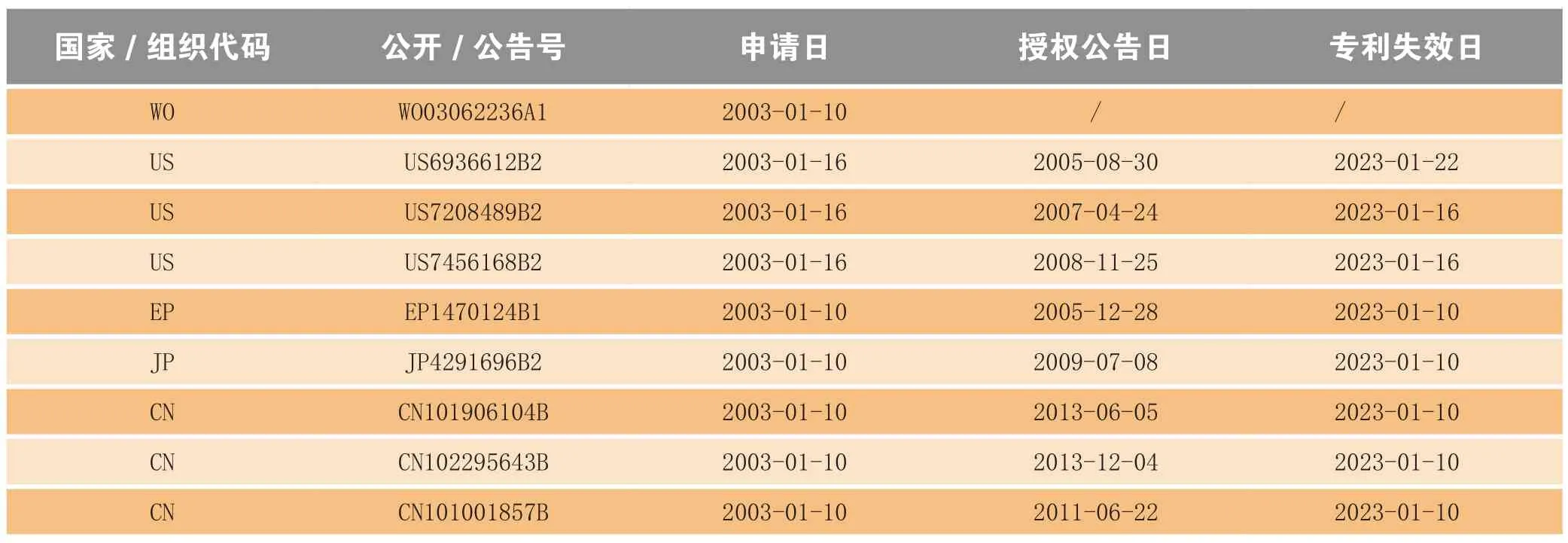
表2 Ibrance®化合物专利的全球布局Table 2 Worldwide patent portfolio of compound in Irbance®
4.2 Ibrance®外围专利的全球布局
在研发过程中,辉瑞公司陆续申请了Ibrance®的外围专利(见表3,以专利族统计)。从申请日来看,从2003年开始布局化合物专利到2004年申请药用盐类及晶型专利,至2005年进行适应证保护,基本为Ibrance®上市扫清了障碍。值得注意的是,2014年,辉瑞公司对Ibrance®的原料药(API)形式进行了晶型保护(公开号WO2014128588A1)。另外,尚未出现制剂专利申请,是否为Ibrance®的市场保护产生实质性效果,尚有待观察。
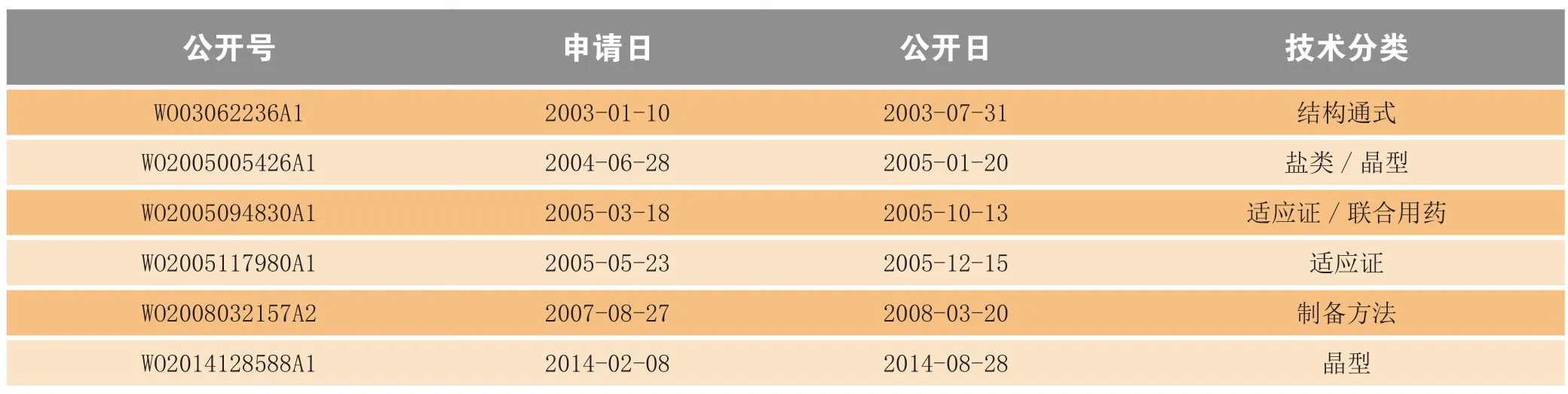
表3 Ibrance®外围专利的全球布局Table 3 Worldwide surrounding patent portfolio of Ibrance®
4.3 Ibrance®在中国的专利申请情况
辉瑞公司选择性地将上述专利申请引进中国(见表4),其中化合物专利已获得授权,具有对该药的绝对保护。具体来说,辉瑞公司通过放弃较大保护范围先使得Ibrance®的结构式获得授权(公告号CN101001857B),再采用分案方式对其结构母核(结构通式)进行了保护,以实现专利对产品保护的最大覆盖。另外,对其磺酸盐及晶型亦有专利保护。值得注意的是,基于API为非盐形式(free base),而作为PCT申请的针对于API的申请尚未丧失进入中国的权利(公开号WO2014128588A1),需继续跟踪以评估其潜在风险。
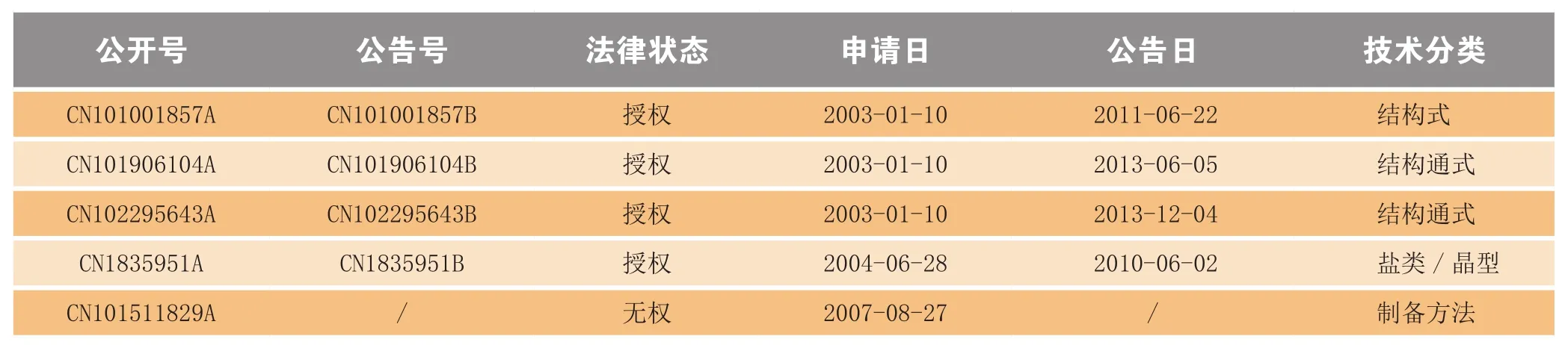
表4 Ibrance®在中国的专利保护情况Table 4 Patent protection of Ibrance®in China
5 Palbociclib同靶点药物
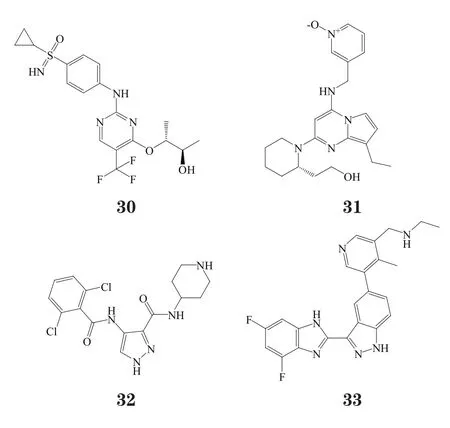
目前,有多个CDK4/6抑制剂处于不同研发阶段(见表5)[10-11]。其中,2个药物处于Ⅲ期临床,4个药物处于Ⅱ期临床,1个药物处于Ⅰ期临床,3个药物在Ⅰ或Ⅱ期临床停止研究。
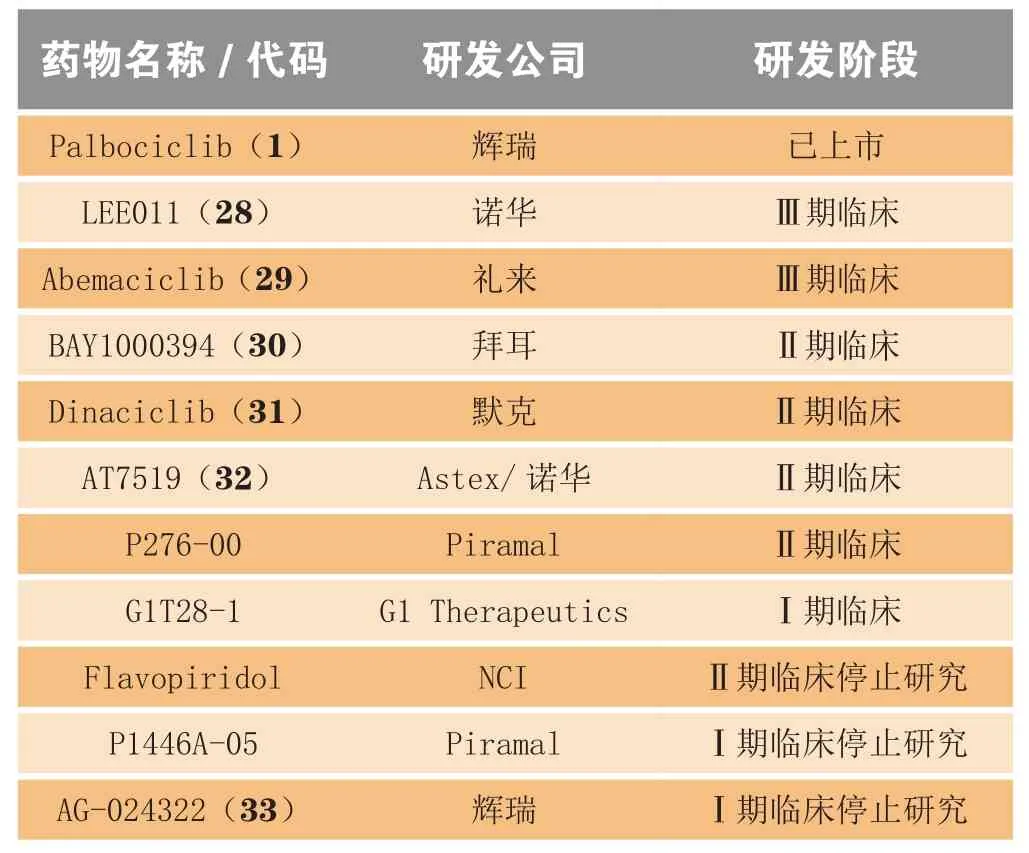
表5 处于不同研发阶段的CDK4/6抑制剂Table 5 CDK 4/6 inhibitors in different development
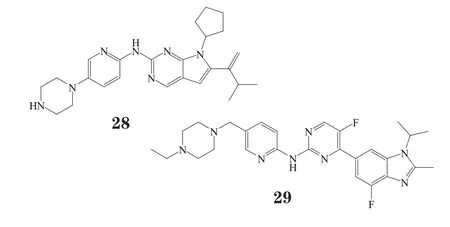
5.1 LEE011
诺华与Astex公司合作开发的LEE011(ribociclib)[12],目前正开展全球Ⅲ期临床研究。首个Ⅲ期临床试验MONALEESA ONALEESA-2始于2013年12月,评估LEE011 +来曲唑相比安慰剂+来曲唑用于ER阳性、HER2阴性的晚期或转移性乳腺癌绝经期女性患者的疗效。第二项Ⅲ期试验MONALEESA ONALEESA-7始于2014年11月,评估LEE011与他莫昔芬和戈舍瑞林或与非甾体芳香酶抑制剂和戈舍瑞林联用,用于ER阳性、HER2阴性的晚期乳腺癌绝经前女性患者的疗效。预计2016年诺华将向监管机构提交LEE011用于ER阳性、HER2阴性绝经期女性乳腺癌患者的上市申请,2018年提交其用于绝经前女性乳腺癌患者的上市申请。
5.2 Abemaciclib
礼来公司的abemaciclib[12]目前正处在Ⅲ期临床研究阶段。该Ⅲ期临床试验始于2014年8月,以评估abemaciclib联合氟维司群对未接受过化疗的、绝经期乳腺癌女性患者的治疗效果。Abemaciclib的Ⅰ期数据显示,其联合用药对肿瘤的疾病控制率可达72.2%,肿瘤病灶面积缩小≥ 30%,且没有患者因不良反应中途退出。礼来公司指出,由于其他CDK4/6类药物的毒性作用只能间歇给药,而abemaciclib可持续给药,这是abemaciclib的竞争优势。
6 结语
Palbociclib是一种口服的高选择性的CDK4/6抑制剂,通过抑制细胞周期从G1期进展到S1期从而阻断细胞DNA合成。Palbociclib作为2015年第一个获得美国FDA加速批准的抗乳腺癌新药,与来曲唑联合用药可显著改善ER+/HER2-女性绝经后乳腺癌患者的无进展生存期,为晚期乳腺癌患者提供了新的治疗选择。
[1]Pfizer Inc. IBRANCE®(palbociclib): US prescribing information.2015[EB/OL]. ( 2015-02-12)[2015-08-01]. http://www.accessdata. fda.gov.
[2]Barvian M, Booth R J, Quin III J, et al. 2-(pyridine-2-ylamino)-pyrido [2,3d]pyrimidin-7-ones: WO03062236A1 [P]. 2003-07-31.
[3]Sharpless N E, Roberts P J, Wong K, et al. Cyclin dependent kinase inhibitors and methods of use: WO2010132725A2 [P]. 2010-11-18.
[4]Chekal B P, Ide N D. Solid forms of a selective CDK4/6 inhibitor: WO2014128588A1 [P]. 2014-08-28.
[5]Beylin V G, Blackburn A C, Erdman D T, et al. Isethionate salt of a selective CDK4 inhibitor: WO2005005426[P]. 2005-01-20.
[6]Finn R S, Dering J, Conklin D, et al. PD 0332991, a selective cyclin D kinase 4/6 inhibitor, preferentially inhibits proliferation of luminal estrogen receptor-positive human breast cancer cell lines in vitro [J]. Breast Cancer Res, 2009, 11 (5): R77.
[7]Fry D W, Harvey P J, Keller P R, et al. Specific inhibition of cyclindependent kinase 4/6 by PD 0332991 and associated antitumoractivity in human tumor xenografts[J]. Mol Cancer Ther, 2004, 3 (11):1427-1438.
[8]Finn R S, Crown J P, Lang I, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study[J]. Lancet Oncol, 2015, 16(1): 25-35.
[9]Turner N C, Ro J, André F, et al. Palbociclib in hormone-receptorpositive advanced breast cancer[J]. N Engl J Med, 2015, 373(3): 209-219.
[10]Sánchez-Martínez C, Gelbert L M, Lallena M J, et al. Cyclin dependent kinase (CDK) inhibitors as anticancer drugs[J]. Bioorg Med Chem Lett, 2015, 25(17): 3420-3435.
[11]Vidula N, Rugo H S. Cyclin-dependent kinase 4/6 inhibitors for the treatment of breast cancer: a review of preclinical and clinical data [J]. Clin Breast Cancer, 2015 Jul 26. doi: 10.1016/j.clbc.2015.07.005. [Epub ahead of print].
[12]Dukelow T, Kishan D, Khasraw M, et al. CDK4/6 inhibitors in breast cancer[J]. Anticancer Drugs, 2015, 26(8): 797-806.
Palbociclib—a New Drug Approved for Advanced Breast Cancer
LIU Shu, XU Jun, CUI Yi, SU Yangyang
(Pharmacodia(Beijing) Co., Ltd, Beijing 100085, China)
Palbociclib was approved by the U.S. Food and Drug Administration (FDA) on Feburary 3rd, 2015 in combination with letrozole for the treatment of postmenopausal women with estrogen receptor positive (ER+), human epidermal growth factor receptor 2 negative (HER2-) advanced breast cancers as initial endocrine-based therapy. Palbociclib is an oral CDK4/6 inhibitor which block sprogression of the cell from growth period (G1phase) into the DNA replication period (S1phase) of the cell cycle and thus inhibits the proliferation of tumor cells. Its marketing provides a new treatment option for patients with advanced breastcancer. The chemical synthesis, preclinical pharmacology, clinical trialsand patent portfolio of palbociclib were introduced in this article, so as to provide references for research and development of new breast cancer drugs.
palbociclib; CDK4/6 inhibitor; breast cancer
R979.1
A
1001-5094(2015)08-0603-07
