社区2型糖尿病合并下肢血管病变的危险因素分析
2015-09-11宋炜等
宋炜等
[摘要] 目的 探讨社区2型糖尿病(T2DM)合并下肢动脉粥样硬化性病变(LEAD)的危险因素。 方法 选取2014年1~12月红星医院管辖的德茂社区站的200例50岁以上且糖尿病病程≥5年的2型糖尿病患者作为研究对象,开展问卷调查、体格检查,检测空腹血糖(FPG)、糖化血红蛋白(HbA1c)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、尿酸(UA)及凝血四项并进行双下肢血管超声检查。采用Logistic回归分析筛选T2DM合并LEAD的主要危险因素。 结果 LEAD组的年龄、SBP、脑卒中及冠心病发生率、LDL-C与HbA1c%水平显著高于无LEAD组,差异有统计学意义(P<0.01)。LEAD组的腰围、BMI、吸烟史以及FPC、TG、TC、UA水平显著高于无LEAD组,差异有统计学意义(P<0.05)。LEAD组的HDL-C水平显著低于无LEAD组,差异有统计学意义(P<0.05)。Logistic回归分析显示,年龄、HbA1c、LDL-C及收缩压是T2DM合并LEAD的独立危险因素。 结论 年龄、HbA1c、LDL-C及收缩压与社区T2DM合并LEAD的发病密切相关。
[关键词] 社区;2型糖尿病;下肢血管病变;危险因素
[中图分类号] R587.2 [文献标识码] A [文章编号] 1674-4721(2015)08(a)-0024-04
下肢动脉粥样硬化性病变(lower extremity ather-osclerotic disease,LEAD)是糖尿病最严重的慢性并发症之一,糖尿病合并LEAD不仅是糖尿病患者截肢的重要原因,也导致心血管死亡危险性增加[1]。目前,普遍认为LEAD危险因素主要与高龄、吸烟、2型糖尿病、高血压、高脂血症等有关[2],但人们对LEAD疾病的知晓率和治疗率也很低,特别是社区2型糖尿病患者对LEAD的危险因素缺乏认识。本研究通过对本院管辖的德茂社区T2DM患者合并LEAD的危险因素进行分析,旨在为社区T2DM合并LEAD患者的干预提供依据。
1 资料与方法
1.1 一般资料
选取2014年1~12月红星医院管辖的德茂社区站的200例50岁以上且糖尿病病程≥5年的2型糖尿病患者作为研究对象,其中男性127例,女性73例;年龄50~75岁,平均(63.8±9.3)岁;糖尿病病程5~17年,平均(11.3±6.1)年。
1.2 研究方法
1.2.1 问卷调查 对200例下肢动脉病变高危的糖尿病人群开展“爱丁堡跛行问卷”、吸烟史、糖尿病史、心脑血管病史、糖尿病家族史等调查。
1.2.2 体格检查 测量血压、身高、体重、腰围(肋骨下缘与髂嵴连线中点水平的周径),计算体重指数(body mass index,BMI)。下肢动脉体格检查包括股动脉听诊、胫前及胫后动脉、足背动脉触诊等。
1.2.3 踝肱指数(ABI)检测 患者采取平卧位安静休息10 min,用袖带血压计分别测定双侧肱动脉和双侧踝动脉的收缩压,踝动脉收缩压的测定方法:将袖带置于踝骨上方,将听诊器耳件置于足背动脉或胫后动脉,充气致动脉搏动消失后缓慢放气,以听到或测到的第1次搏动为踝动脉收缩压。右侧ABI=右踝收缩压高值/双上肢收缩压高值,左侧ABI=左踝收缩压高值/双上肢收缩压高值。ABI正常参考值为1.00~1.40,ABI≤0.90被定义为ABI异常。
1.2.4 实验室指标测定 所有患者禁食至少10 h,次晨抽静脉血,采用贝克曼AU680全自动生物化学分析仪检测空腹血糖(FPG)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)及尿酸(UA);采用免疫法检测糖化血红蛋白(HbA1c);应用赛科希德SF8100检测凝血四项。
1.2.5 双下肢动脉超声检查 应用东芝SSA-640A便携式彩色多普勒超声诊断仪探查下肢各血管,观察各动脉血管内膜有无增厚及斑块形成。
1.2.6 相关疾病诊断标准 T2DM诊断符合2013年中国2型糖尿病防治指南关于T2DM的诊断标准[3]。LEAD诊断符合老年人四肢动脉粥样硬化性疾病诊治中国专家建议(2012)[1],即有下肢缺血症状或体征(间歇性跛行、下肢静息痛、足温低或足部皮肤发绀)、股动脉闻及杂音、足背动脉或胫后动脉搏动减弱或消失;静息ABI≤0.90,超声多普勒检查显示下肢动脉硬化狭窄或闭塞性病变。高血压的诊断标准参照2010版《中国高血压防治指南》[4]。血脂异常的诊断参照2007年《中国成人血脂异常防治指南》[5]。冠心病的诊断标准包括以下几点: ①具有典型心绞痛症状及心肌缺血心电图改变或运动平板试验和(或)24 h动态心电图检查证实有心肌缺血。②具有明确的心肌梗死病史。③具有冠状动脉血运重建病史。④经冠状动脉造影显示某一支或多支冠状动脉管腔狭窄≥50%。脑卒中(包括缺血性及出血性脑卒中)诊断标准为具有明确的缺血性或出血性脑卒中病史或经头颅CT证实。
1.3 统计学处理
采用SPSS 13.0统计学软件对数据进行分析,计量资料以x±s表示,采用t检验,计数资料采用χ2检验,多因素分析采用Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 T2DM患者LEAD检出情况
200例T2DM患者中筛查出LEAD 91例,其中男58例,女33例;年龄57~75岁;病程5~17年。91例LEAD患者中,6例足温低或行走时存在下肢无力症状,2例有间歇性跛行症状,91.2%的糖尿病合并LEAD患者无症状。
2.2 两组临床特征的比较
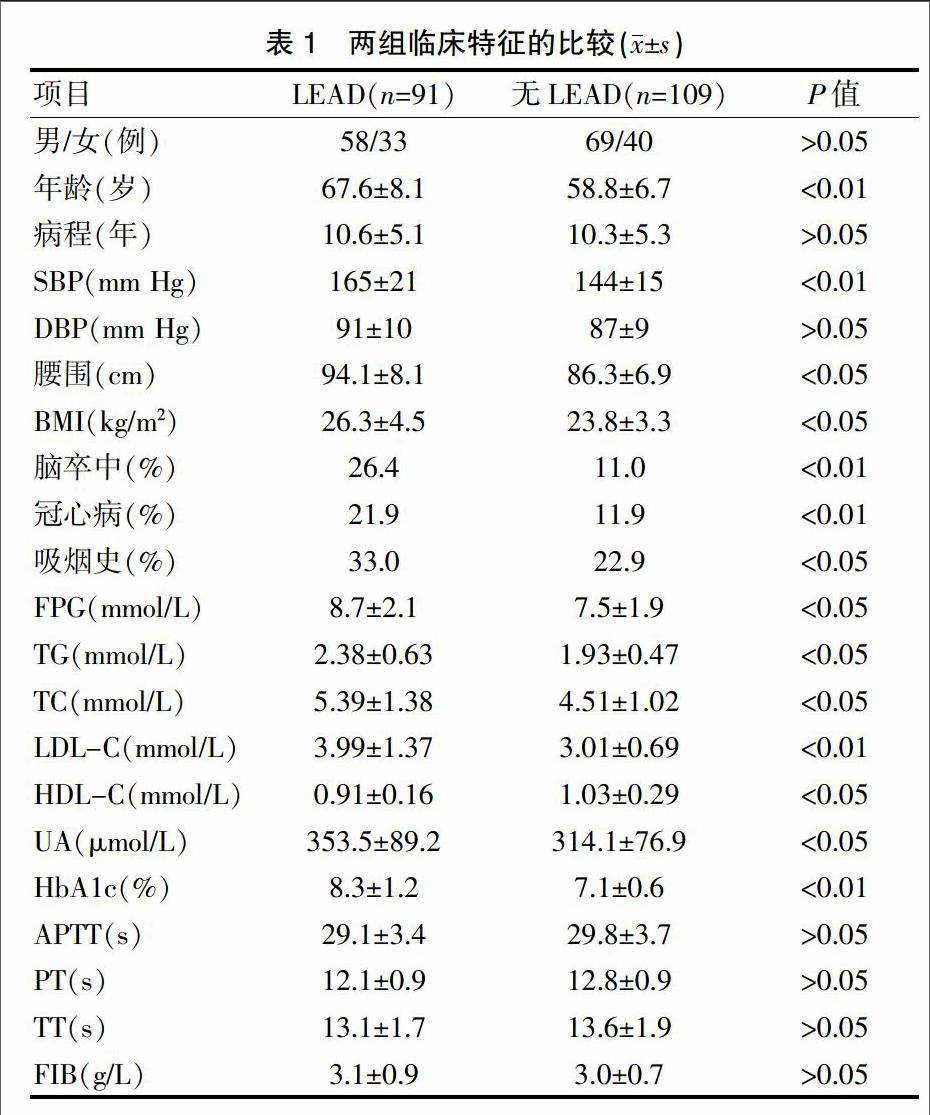
两组的性别、病程、DBP、凝血四项指标比较,差异无统计学意义(P>0.05)。LEAD组的年龄、SBP、脑卒中及冠心病发生率、LDL-C与HbA1c%水平显著高于无LEAD组,差异有统计学意义(P<0.01)。LEAD组的腰围、BMI、吸烟史以及FPC、TG、TC、UA水平显著高于无LEAD组,差异有统计学意义(P<0.05)。LEAD组的HDL-C水平显著低于无LEAD组,差异有统计学意义(P<0.05)(表1)。
2.3 T2DM合并LEAD危险因素的Logistic回归分析
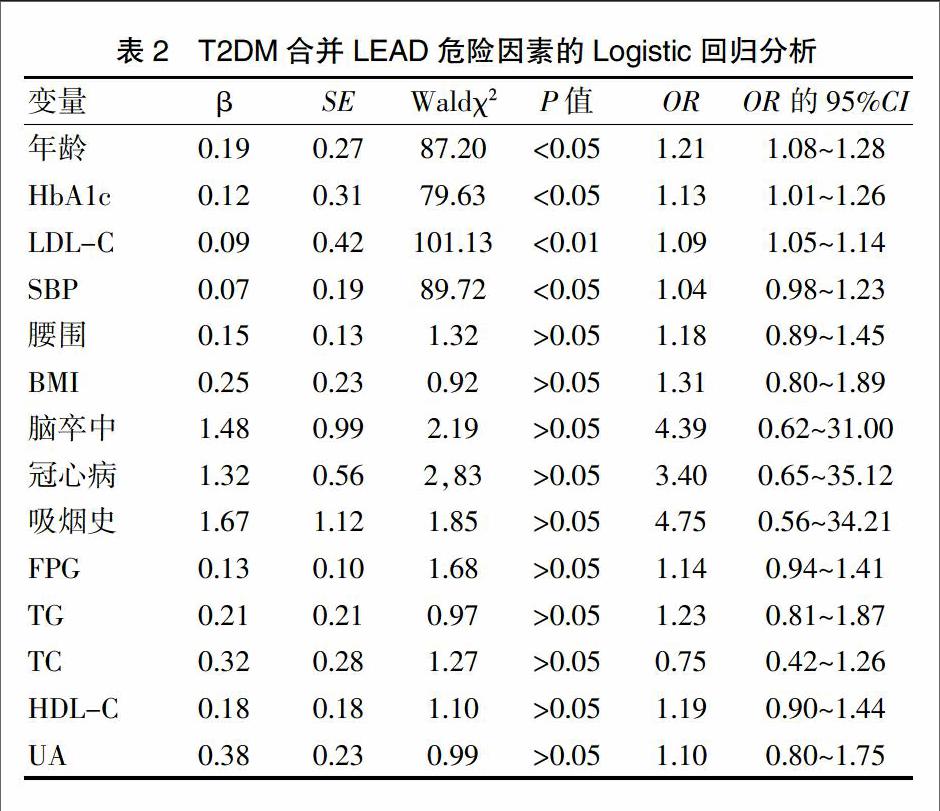
以年龄、BMI、腰围、收缩压、脑卒中、冠心病、FPC、HbA1c、TC、LDL-C、TG、HDL-C和UA等为自变量,以是否有LEAD为因变量进行多因素回归分析,结果显示年龄、HbA1c、LDL-C及收缩压是LEAD的独立正相关因素(OR=1.21、1.13、1.09、1.04,P<0.05或P<0.01)(表2)。
3 讨论
本研究选取糖尿病病程相对较长(糖尿病病程多为5年以上)的50岁以上患者进行研究,结果显示,T2DM合并LEAD的年龄较单纯糖尿病无LEAD者大,且血糖控制较差。
年龄是T2DM患者发生LEAD的独立相关因素,而且是众多危险因子中最强的致病因素。LEAD的病理基础是动脉粥样硬化,随着年龄的增长,动脉粥样硬化的程度也逐渐加重。国内一项大样本针对自然人群LEAD的研究显示,自然人群下肢动脉病变总患病率随着年龄的增加而升高,在60岁以后即明显增加,≥75岁年龄组的患病率是<60岁年龄组的2倍,而且LEAD患病率随年龄增加的趋势在男女性别中表现一致[6]。荟萃研究显示,在我国,50岁以上糖尿病患者的LEAD患病率达6.9%~23.8%[7]。本研究中,社区50岁以上糖尿病病程≥5年的患者LEAD患病率高达45.5%,考虑其主要原因是由于研究对象伴有其他LEAD高危因素较多,另外与样本量偏少有关。由于LEAD与患者的年龄密切相关,故在临床上,对于50岁以上伴有LEAD危险因素的糖尿病患者,均应常规进行LEAD筛查。
HbA1c是T2DM患者发生LEAD的独立相关危险因素,并且是T2DM患者发生LEAD的较强致病因素[8]。血糖长期控制不佳,导致大量糖基化终末产物形成,进而增强氧化应激,损伤血管内皮细胞,促进炎症发生,促使血管平滑肌细胞及成纤维母细胞增生,形成动脉粥样硬化。此外,高血糖对胰岛B细胞的毒性作用能抑制胰岛B细胞分泌胰岛素,并能降低周围靶细胞对胰岛素的敏感性,加重胰岛素抵抗,损伤血管内皮细胞,进而促进动脉粥样硬化的形成和发展[9]。国内大样本临床研究显示,50岁以上T2DM患者HbA1c升高者比HbA1c正常者发生LEAD危险性升高2.44倍[10]。在本研究中,两组的糖尿病病程无明显差异,考虑其原因主要是抽取的样本均为糖尿病病程≥5年,故差异性缩小,另外与样本量偏少有关。
LEAD组的高血压检出率较高,收缩压水平较高,而且收缩压升高是糖尿病患者发生LEAD的独立相关因素。高血压是公认的动脉硬化危险因素,持久的高血压导致动脉内膜纤维组织和弹力纤维增生并损伤内膜血管内皮细胞,增强氧化应激,促进动脉粥样硬化。LEAD与收缩压的关系较舒张压更密切。研究显示,高血压病程每增加1年,LEAD危险增加1.02倍;收缩压每增加10 mm Hg,LEAD危险性增加1.19倍;尤其是SBP>180 mm Hg时,收缩压每增长10 mm Hg,LEAD危险性增加3.7倍[10-11]。
LDL-C是导致动脉粥样硬化病变的基本因素,根据近年来所完成的多项临床试验结果,目前专家仍建议以LDL-C为干预血脂异常的主要靶点[12]。本研究结果显示,两组使用他汀类药物的比例均不高,提示需要强化社区糖尿病患者他汀类药物的应用。他汀类药物不仅能够调整血脂而且可以改善血管内皮功能。BMI和腰围是评估肥胖程度和脂肪量的重要指标,目前,判定腹型肥胖的腰围切点为男性90 cm、女性85 cm。本研究中,两组的BMI、腰围比较,差异有统计学意义,提示腹型肥胖与LEAD有一定关联。腹内脂肪堆积会增加胰岛素的抵抗程度,胰岛素抵抗促进了大动脉粥样硬化的发生和发展。
本研究结果显示,尿酸对LEAD存在影响。尿酸可进入血管内皮细胞,诱导CRP表达,造成内皮功能障碍,同时尿酸还可进入血管平滑肌细胞,刺激合成炎性介质,引起炎症反应,刺激血管平滑肌细胞增生[13]。另外,尿酸结晶可沉积在动脉血管内膜造成直接损伤,进一步诱发和加重动脉粥样硬化[14]。
吸烟是LEAD不可忽视的高危因素,香烟中尼古丁、烟碱等有害成分通过低炎症反应、激活氧化应激等途径,使LEAD发生的危险增加2~6倍[15]。相关研究显示,与未吸烟者相比,吸烟者发生糖尿病足的风险增加4~6倍,截肢风险增加3~5倍[16-17]。国内研究显示,吸烟人群的LEAD患病率比非吸烟人群高1.68倍[10]。本研究结果显示,糖尿病患者的吸烟率达27.5%,而LEAD组的吸烟率更高,提示应加强社区糖尿病人群的控烟教育。
本研究结果显示,LEAD组的冠心病、脑卒中患病率较高,提示糖尿病合并下肢动脉病变者要同时警惕冠心病、脑卒中风险。下肢动脉粥样硬化病变、颈动脉粥样硬化与冠状动脉粥样硬化,均属于糖尿病的大血管病变,具有共同的危险因素和发病机制,即始动因素是血管内皮损伤,进一步发生血管的炎性反应和动脉内膜脂质沉积,故LEAD与颈动脉硬化及冠心病有相关性。踝臂指数(ABI)是LEAD的主要诊断指标,已有多项前瞻性研究[18-19]显示,异常ABI值可以独立预测冠心病、脑卒中等复合心脑血管事件的发生风险。另有研究显示,LEAD可增加患者心血管事件发生风险和病死率,LEAD患者在确诊1年后的心血管事件发生率高达21.1%,故糖尿病合并LEAD是病在下肢,险在心脑[20]。
本研究未将同型半胱氨酸、尿微量白蛋白等与LEAD发病的相关危险因素纳入调查,另外样本量偏少,故存在一定局限性。今后需增加样本量,扩大监测指标,开展更大规模的研究。本研究结果显示,本院所辖社区糖尿病患者的LEAD危害知晓率低,另外LEAD相关危险因素如血脂异常、高血糖、高血压等的控制较差,提示要加强对社区糖尿病患者的教育及管理。
[参考文献]
[1] 李小鹰,管珩,杨庭树,等.老年人四肢动脉粥样硬化性疾病诊治中国专家建议(2012)[J].中华老年医学杂志,2013,32(2):121-131.
[2] 冯美江,鲁翔.老年人外周血管疾病[J].中华老年心脑血管病杂志,2014,16(8):895-896.
[3] 中华医学会糖尿病学分会.中国2型糖尿病防治指南2013年版[J].中华糖尿病杂志,2014,6(7):447-498.
[4] 中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华心血管病杂志,2011,39(7):579 -616.
[5] 中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南[J].中华心血管病杂志,2007,35(5):390-419.
[6] 王勇,李觉,徐亚伟,等.中国自然人群下肢外周动脉疾病患病率及相关危险因素[J].中华心血管病杂志,2009, 37(12):1127-1131.
[7] 冉兴无,许樟荣,纪立农,等.2型糖尿病患者合并下肢动脉病变的筛查及管理规范[J].中华糖尿病杂志,2013, 5(2):82-87.
[8] 邓一洁.糖化血红蛋白、空腹血糖、尿微量白蛋白检测对老年糖尿病患者下肢血管病变的临床意义[J].河北医药,2012,34(21):3303.
[9] 李海峰,杨勇杰,刘丽娟.老年人糖尿病与动脉粥样硬化的相关性研究[J].中华老年医学杂志,2013,32(9):964-966.
[10] 管珩,刘志民,李光伟,等.50岁以上糖尿病人群周围动脉闭塞性疾病相关因素分析[J].中华医学杂志,2007, 87(1):23-27.
[11] 李中南,方朝晖,李远思,等.高血压对老年糖尿病患者下肢血管病变的影响[J].中国临床保健杂志,2006,9(4):319-320.
[12] 2014年中国胆固醇教育计划血脂异常防治建议专家组.2014年中国胆固醇教育计划血脂异常防治专家建议[J].中华心血管病杂志,2014,42(8):633-636.
[13] 2型糖尿病患者血尿酸水平与下肢血管病变的相关性[J].中华医学杂志,2010,90(10):653-657.
[14] 宋超,张建德.老年男性2型糖尿病患者血清尿酸水平与下肢血管病变的关系[J].山东医药,2014,54(13):40-41.
[15] Lu L,Mackay DF,Pell JP.Meta-analysis of the association between cigarette smoking and peripheral arterial disease[J].Heart,2014,100(5):414-423.
[16] Chaturvedi N,Abbott CA,Whalley A,et al.Risk of diabetes related amputation in South Asians vs. Europeans in the UK[J].Diabet Med,2002,19(2):99-104.
[17] 贾红 刘玉秀,冯爱萍,等.吸烟与糖尿病的关系[J].现代预防医学,2006,33(11):2038-2040.
[18] O'Hare AM,Katz R,Shlipak MG,et al.Mortality andcardiovascular risk across the ankle-arm index spectrum:results from the Cardiovascular Health Study[J].Circulation,2006,113(3):388-393.
[19] Milionis H,Vemmou A,Ntaios G,et al.Ankle-brachial index long-term outcome after first-ever ischaemic stroke[J].Eur J Neurol,2013,20(11):1471-1478.
[20] Steg PG,Bhatt DL,Wilson PW,et al.One-year cardiovascular event rates in outpatients with atherothrombosis[J].JAMA,2007,297(11):l197-1206.
(收稿日期:2015-05-24 本文编辑:祁海文)
