花青素对动脉粥样硬化模型小鼠抗氧化和血脂代谢的影响
2015-09-11欧海龙张庆海
欧海龙++张庆海
[摘要] 目的 探讨花青素在动脉粥样硬化模型小鼠体内抗氧化能力和血脂代谢中的作用。 方法 高脂饮食诱导基因敲除的ApoE-/-小鼠8周后,每天用不同剂量(低、中、高:50、100、200 mg/kg)的花青素对小鼠连续灌胃8周。获取血清和肝脏并分别检测各抗氧化指标和各项血脂含量。 结果 中、高剂量组血清中SOD活性的提高及血清和肝脏的MDA含量的降低与空白组比较,差异有统计学意义(P<0.05);高剂量组肝脏的SOD活性与空白组比较,差异有统计学意义(P<0.05);总胆固醇(TC)、三酰甘油(TG)和低密度脂蛋白胆固醇(LDL-C)水平,随着剂量的增加不断降低,中、高剂量组中TG水平与空白组比较,差异有统计学意义(P<0.05);高剂量组TC和LDL-C水平与空白组比较,差异有统计学意义(P<0.05)。 结论 花青素对高脂诱导的动脉粥样硬化小鼠具有抗氧化、降低血脂的功能。
[关键词] 花青素;ApoE-/-小鼠;氧化;血脂;动脉粥样硬化
[中图分类号] R543 [文献标识码] A [文章编号] 1674-4721(2015)08(a)-0004-04
体内脂代谢紊乱,可使过多的脂质沉积在血管内壁,并在脂质氧化和各种炎症反应的作用下形成动脉粥样硬化。载脂蛋白ApoE基因敲除的纯合小鼠(ApoE-/-)可正常存活和繁殖,但当给予适当的高脂饮食时,可导致各种高脂蛋白血症[1-2],是动脉粥样硬化相关疾病病理和药理研究的主要动物模型[3-6]。花青素是一类具有多酚羟基的黄酮类化合物,主要存在于各种植物如葡萄、紫甘薯、蓝莓和黑米中,在体内具有抗氧化、抑制肿瘤及消炎等多种药理功能[7-8]。本研究以实验室前期成功建立的动脉粥样硬化ApoE-/-模型小鼠为试验动物[9],对其用不同剂量的花青素处理,检测小鼠体内血清、肝脏的超氧化物歧化酶(superoxide dismutase,SOD)的活性和丙二醛(malonaldehyde,MDA)的含量及各种血脂蛋白水平,分析花青素在动脉粥样硬化小鼠体内的抗氧化反应和血脂质代谢的影响。
1 材料与方法
1.1 试剂和仪器
电子天平(上海奥豪斯仪器公司),721型分光光度计(上海精密仪器公司),电热鼓风干燥箱(上海跃进公司);紫甘薯花青素(青岛鹏远公司),小鼠基础饲料(贵阳医学院动物中心),低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)检测试剂盒(南京建成生物公司),其余试剂均为国产分析纯。
1.2 试验动物
ApoE-/-小鼠购自南京大学模式动物研究所,引种协议[2012]470号。动物饲养环境条件为室温20~25℃,相对湿度40%~70%。对6周龄左右的ApoE-/-雄性小鼠进行高脂肪饲料(21.5%脂肪和0.15%胆固醇)喂养,喂食8周后,对体重为23~25 g的试验动物分为4组,每组8只。对空白组(0 mg/kg)、花青素低剂量组(50 mg/kg)、花青素中剂量组(100 mg/kg)和花青素高剂量(200 mg/kg)的小鼠进行灌胃,持续8周。试验结束后,解剖并取静脉血和肝脏用于下一步试验。
1.3 体内抗氧化酶活性测定
取肝脏组织加入10倍体积的生理盐水,在冰浴中制成组织匀浆,以5000 r/min离心10 min,取上清液进行相关指标的测定,其中通过羟胺法测定SOD活性、硫代巴比安酸(TBA)比色法测定MDA的含量,具体方法根据南京建成生物公司提供的操作说明。
1.4 血脂水平的检测方法
血清总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)水平的测定分别采用胆固醇氧化酶法(COD-PAP)及磷酸甘油氧化酶法(GPO-PAP),应用分光光度计测其在500 nm吸收值。LDL-C和HDL-C测定所用试剂和方法均按照南京建成试剂盒说明书进行操作。
1.5 统计学分析
采用SPSS 18.0统计软件对数据进行分析,计量资料以x±s表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
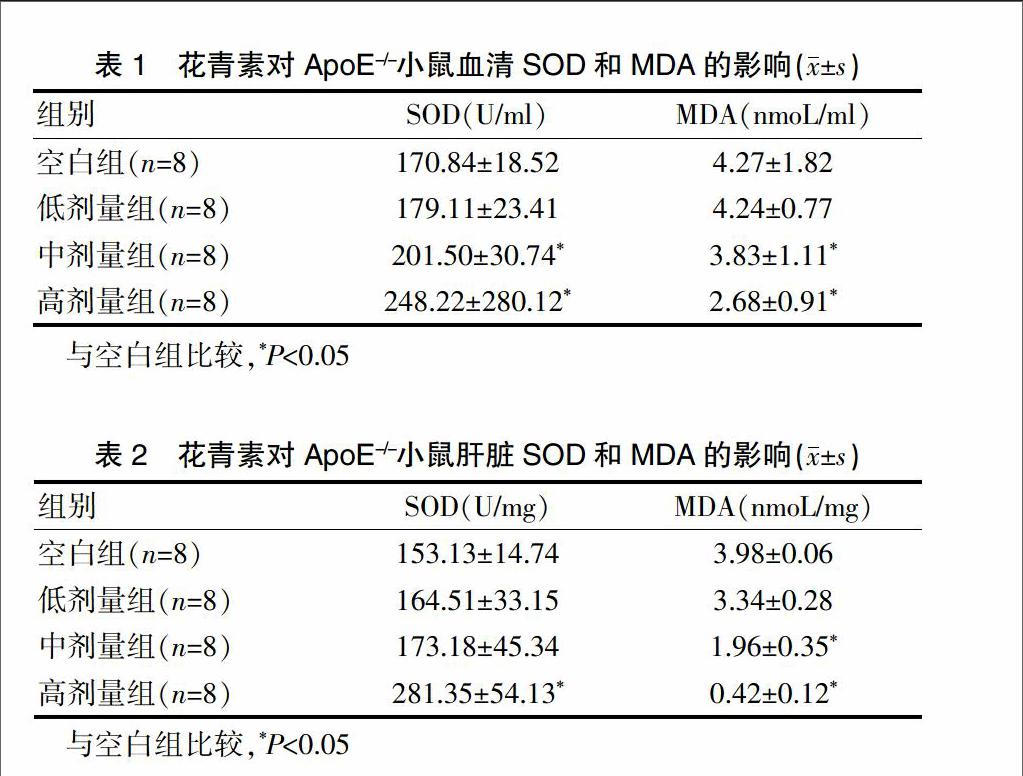
2.1 花青素对ApoE-/-小鼠血清和肝脏SOD、MDA的影响
低剂量组小鼠血清SOD、MDA值与空白组比较,改变不显著;中、高剂量组血清SOD、MDA值与空白组比较,差异有统计学意义(P<0.05);高剂量组SOD值提高了46%,而MDA降低了37%(表1)。在肝脏中,MDA下降水平在中剂量时有显著差异(P<0.05);SOD值则在高剂量时明显提高(P<0.05)(表2)。
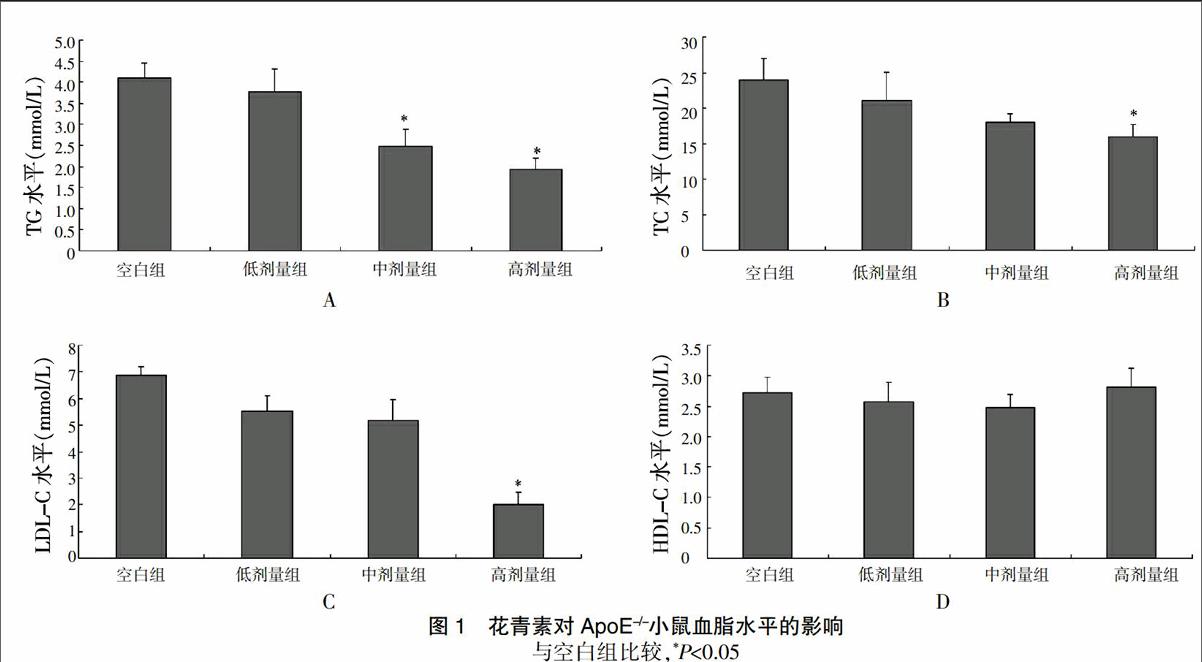
2.2 花青素对ApoE-/-小鼠血脂水平的影响
经不同剂量花青素处理后,中、高剂量组TG水平与空白组比较显著降低,差异有统计学意义(P<0.05);高剂量组TC和LDL-C水平与空白组比较出现明显下降,差异有统计学意义(P<0.05);其中LDL-C的降低效果最显著,高达60%多。4组HDL-C水平比较,差异无统计学意义(P>0.05)(图1)。
3 讨论
自由基是机体氧化反应过程中产生的一类强氧化性化合物。不断积累的自由基诱发体内细胞的氧化损伤、损害机体组织,是引起各种慢性疾病如动脉粥样硬化的危险因素之一。生物体内的SOD、过氧化氢酶(catalase,CAT)等抗氧化酶,可清除自由基、减少体内过氧化脂质、MDA等的生成,其活性的高低常被用于衡量机体的氧化程度[10-12]。本研究以SOD、MDA为指标,分析花青素的抗氧化活性。
TG、TC、LDL-C及HDL-C是血清中的主要胆固醇类型,其中TG、TC、LDL-C的内核里含有丰富的脂质,如在血清中的水平过高,易沉积在血管壁上,逐渐发展为斑块,是动脉粥样硬化的重要的危险因素。HDL-C中蛋白含量较多,脂质较少,且HDL-C有助于将血浆中的脂质运送回肝脏,进行代谢,减少血管脂质的功能。本研究结果显示,经不同剂量花青素处理后TG、TC、LDL-C水平均有不同程度的下降,而HDL-C变化不大,说明花青素具有降低血脂,抗动脉粥样硬化的功能。
花青素是广泛存在于植物中的一种水溶性的天然色素,也是植物花瓣、果实中的主要呈色物质,其所含有的大量活性酚羟基,使花青素具有抗氧化及清除各种活性氧自由基的能力,并在果蝇、小鼠、大鼠及兔的研究中得到证实[13-17]。研究发现,花青素可通过激活AMP激活蛋白激酶(AMP-activated protein kinase,AMPK)的途径抑制糖尿病、肿瘤疾病的发生与发展[18-19]。Takikawa等[18]发现糖尿病模型小鼠经蓝莓花青素处理后,AMPK信号通路被激活同时显著降低血糖浓度,并增强机体对胰岛素的敏感度,缓解高糖血症,显示蓝莓花青素在糖尿病的预防和治疗上有着积极的意义。Park等通过对肿瘤移植小鼠的体内研究认为,花青素降低磷酸化糖原合酶激酶3β(phospho-GSK3 Beta)和β-catenin 蛋白的同时激活AMPK活性,从而抑制了肿瘤的迁移和浸润;而AMPK抑制物的处理能够消除花青素的抗肿瘤功效,说明花青素的抗肿瘤作用是通过对AMPK的激活而实现的[19]。另外,花青素在脂代谢中的调控作用也得到证实,其通过诱导胆固醇从巨噬细胞中流出,促进胆固醇的逆向转运,从而促进血脂的代谢[20-21]。
本文通过花青素在动脉粥样硬化模型小鼠体内的研究,进一步确定花青素具有降低脂质水平,改善血脂代谢功能。研究结果提示,花青素在动脉粥样硬化的防治上具有一定的功能。其对开发、利用花青素资源具有重要的指导意义。花青素可能通过降低体内脂质的氧化程度从而调节体内脂质代谢平衡并缓解动脉粥样硬化,但这些因素之间的具体关系及花青素在体内作用的相关分子机制还需进一步研究。
[参考文献]
[1] Plump AS,Smith JD,Hayek T,et al.Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells[J].Cell,1992,71(2):343-353.
[2] Nakashima Y,Plump AS,Raines EW,et al.ApoE-deficient mice develop lesions of all phases of atherosclerosis throughout the arterial tree[J].Arterioscler Thromb,1994,14(1):133-140.
[3] 徐芳,刘颖,王蔚琛,等.载脂蛋白E基因敲除小鼠动脉粥样硬化早期血管外膜成纤维细胞表型转化为肌成纤维细胞[J].中国动脉硬化杂志,2013,21(12):1064-1068.
[4] 田晋帆,葛长江,吕树铮,等.基质交感分子1在载脂蛋白E基因敲除小鼠动脉粥样硬化斑块形成中的作用[J].中华老年心脑血管病杂志,2015,17(2):183-187.
[5] Kyaw T,Winship A,Tay C,et al.Cytotoxic and proinflammatory CD8+ T lymphocytes promote development of vulnerable atherosclerotic plaques in apoE-deficient mice[J].Circulation,2013,127(9):1028-1039.
[6] Grandoch M,Feldmann K,G■thert JR,et al.Deficiency in lymphotoxin β receptor protects from atherosclerosis in apoE-deficient mice[J].Circ Res,2015,116(8):e57-e68.
[7] Bagchi D,Sen CK,Bagchi M,et al.Anti-angiogenic,antioxidant,and anti-carcinogenic properties of a novel anthocyanin-rich berry extract formula[J].Biochemistry,2004, 69(1):75-80.
[8] Kocic B,Filipovic S,Nikolic M,et al.Effects of anthocyanins and anthocyanin-rich extracts on the risk for cancers of the gastrointestinal tract[J].J BUON,2011,16(4):602-608.
[9] 欧海龙,张礼林,何晓兰,等.ApoE-/-小鼠动脉粥样硬化模型的建立[J].生命科学研究,2015,19(2):141-144.
[10] 张泽生,胡莎,邵婵,等.根皮苷对由高脂导致果蝇氧化损伤的保护作用[J].食品科技,2012,37(4):195-198.
[11] Albuali WH.Evaluation of oxidant-antioxidant status in overweight and morbidly obese Saudi children[J].World J Clin Pediatr,2014,3(1):6-13.
[12] Wang C,Wheeler CT,Alberico T,et al.The effect of resveratrol on lifespan depends on both gender and dietary nutrient composition in Drosophila melanogaster[J].Age,2013,35(1):69-81.
[13] 谭壮生,张懿,宋乃宁,等.花青素对果蝇寿命和小鼠某些氧化及抗氧化指标的影响[J].毒理学杂志,2012,26(6):440-411.
[14] 龚频,陈福欣,虢红梅,等.蓝莓花青素对镉致小鼠睾丸损伤的保护作用[J].中华劳动卫生职业病杂志,2014, 32(10):762-764.
[15] 程强,张作明,张磊.花青素类提取物对光诱导的大鼠视网膜功能和结构损伤的保护作用[J].中华实验眼科杂志,2013,31(2):110-116.
[16] Jurgoński A,Juskiewicz J,Zduńczyk Z.An anthocyanin-rich extract from Kamchatka honeysuckle increases enzymatic activity within the gut and ameliorates abnormal lipid and glucose metabolism in rats[J].Nutrition,2013, 29(6):898-902.
[17] Liu YX,Song X,Han Y,et al.Identification of anthocyanin components of wild Chinese blueberries and amelioration of light-induced retinal damage in pigmented rabbit using whole berries[J].J Agric Food Chem,2011,59(1):356-363.
[18] Takikawa M,Inoue S,Horio F,et al.Dietary anthocyanin-rich bilberry extract ameliorates hyperglycemia and insulin sensitivity via activation of AMP-activated protein kinase in diabetic mice[J].J Nutr,2010,140(3):527-533.
[19] Park SY,Lee YK,Lee WS,et al.The involvement of AMPK/GSK3-beta signals in the control of metastasis and proliferation in hepato-carcinoma cells treated with anthocyanins extracted from Korea wild berry Meoru[J].BMC Complement Altern Med,2014,14:109.
[20] Xia M,Hou M,Zhu H,et al.Anthocyanins induce cholesterol efflux from mouse peritoneal macrophages[J].J Biol Chem,2005,280(44):36792-36801.
[21] Wang D,Xia M,Yan X,et al.Gut microbiota metabolism of anthocyanin promotes reverse cholesterol transport in mice via repressing miRNA-10b[J].Circ Res,2012,111(8):967-981.
(收稿日期:2015-05-13 本文编辑:王红双)
