空肠弯曲菌人工感染鸡的致病性研究
2015-09-09张腾飞艾地云等
张腾飞 艾地云 等
摘要:采用口服、腿部肌肉注射两种不同攻毒方法,对空肠弯曲菌人工感染鸡的致病性进行研究。结果表明,两种攻毒方法攻毒鸡只均无临床症状,但是均表现肠道的病理变化。攻毒后第三天、第五天可从鸡泄殖腔棉拭子和迫杀鸡样品的空肠中分离到目的菌落。
关键词:空肠弯曲菌;鸡;致病性
中图分类号:S858.31 文献标识码:A 文章编号:0439-8114(2015)15-3703-02
DOI:10.14088/j.cnki.issn0439-8114.2015.15.031
Abstract: By oral administration and nasal drip, intramuscular injection, the pathogenicity of Campylobacter jejuni on chicken were studied. The test showed that the infected chicken did not show obvious clinical symptoms except enteric pathological changes. After 3 days and 5 days post inoculation, Campylobacter jejuni were isolated from jejunum and cloacae swabs.
Key words: Campylobacter jejuni;chicken;pathogenicity
空肠弯曲菌(Campylobacter jejuni)是弯曲菌属中引起人类感染最为严重的致病菌,是导致食物中毒的主要病原菌之一[1],近些年来,弯曲菌感染率在世界各地普遍呈上升趋势,已成为最常见的、急性细菌性肠道传染病。鸡是弯曲菌重要的贮存宿主,人类主要通过食用被污染的水、乳制品及食物感染,因此控制鸡群弯曲菌的携带率是控制人弯曲菌病的重要前提。本研究主要对空肠弯曲菌人工感染鸡的致病性进行研究,为弯曲菌病的流行病学调查及防控提供依据。
1 材料与方法
1.1 材料
1.1.1 细菌及培养基 空肠弯曲菌(CICC22936)、mCCDA、布氏肉汤,购自北京北纳创联生物技术研究院,DL2 000 DNA Marker、2×EasyTaq PCR SuperMix购自北京全式金生物制品有限公司,CampyGenTM微需氧产气袋购自Oxoid公司。
1.1.2 试验鸡 SPF鸡蛋购自北京梅里亚维通实验动物技术有限公司,购买回来后孵化,饲养观察,用于后续试验。
1.2 方法
1.2.1 接种 将空肠弯曲菌划线接种于mCCDA平板放入厌氧罐中,将产气袋放在厌氧罐的指定位置,立即封闭厌氧罐,42 ℃培养48 h。挑取单菌落于布氏肉汤中,42 ℃培养48 h,计算菌落数。
1.2.2 攻毒 将布氏肉汤培养物采用两种攻毒方式攻毒1月龄鸡,一种攻毒方式为口服,另一种攻毒方式为腿部肌肉注射,6只/组,5×108 CFU/只;对照组接种灭菌生理盐水,3只,0.3 mL/只;饲养观察1周后迫杀,同时于攻毒后第三天、第五天肛拭子采样分菌。
1.2.3 PCR产物的扩增和产物鉴定 根据Genbank序列,参照何蕊等[2]的方法,合成空肠弯曲菌mapA基因引物,扩增片段长度为589 bp。引物序列如下:上游引物5′-CTATTTTATTTTTGAGTGCTTGTG-3′,下游引物5′-GCTTTATTTGCCATTTGTTTTATTA-3′。由上海生工生物工程技术服务有限公司合成。
模板的制备:将空肠弯曲菌和其他待检菌株加入含抗生素和生长促进剂的布氏肉汤中微需氧法培养48 h,取菌液1 mL,10 000 r/min离心10 min,弃上清,加1 mL去离子水重悬沉淀,沸水浴10 min,同样离心后取上清液作模板,于4 ℃保存备用。
PCR反应体系:在PCR反应管中加入2×Easy Taq PCR SuperMix 25 μL、上下游引物各1μL、DNA模板4 μL,加去离子水补至50μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸50 s,35个循环;最后72 ℃延伸10 min。反应完毕后扩增产物经1.0%琼脂糖凝胶电泳,凝胶成像系统观察结果。
2 结果与分析
2.1 临床表现及剖检病变
所有攻毒鸡只精神食欲正常。口服组迫杀鸡主要剖检病变为十二指肠、空肠黏膜散在分布针尖大小出血点;腿部肌肉注射组迫杀鸡主要剖检病变为鸡只十二指肠黏膜散在分布针尖大小出血点;其他组织无肉眼可见病变。对照组鸡只精神食欲正常,剖检无肉眼可见病变。
2.2 细菌分离结果
攻毒后第三天、第五天鸡泄殖腔棉拭子样品及迫杀鸡只的空肠内容物接种mCCDA,平板上有灰色菌苔生长。挑取灰色菌落划线接种mCCDA,42 ℃培养48 h,有灰色单菌落生长。挑取单菌落进行纯化,纯化的细菌革兰氏染色为红色、细小的S形短杆菌。从迫杀鸡只的肝脏、脑中未分离到空肠弯曲菌。从对照组鸡只中未分离到空肠弯曲菌。
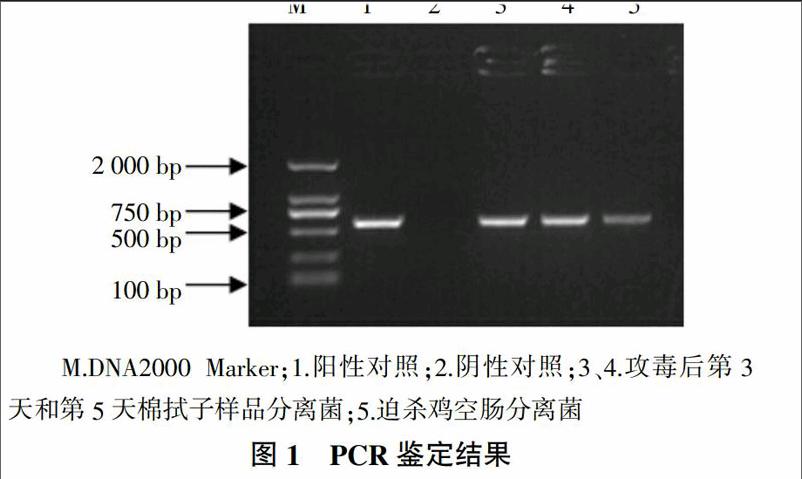
2.3 PCR鉴定结果
对从攻毒后第三天、第五天泄殖腔棉拭子样品及迫杀鸡只的空肠中分离菌进行PCR扩增,均可扩增到约为589 bp片段(图1),而阴性对照无条带。将PCR扩增产物送上海生工测序,测序结果表明,与阳性对照(攻毒菌株)的mapA基因序列比较,同源性可达99%以上。
3 小结与讨论
本研究采用两种方式攻毒,一种攻毒方式为口服,这种方式是模拟家禽自然感染弯曲菌的途径进行,空肠弯曲菌作为一种消化道传播病原菌,主要通过消化道进行感染[3-5];另一种攻毒方式为腿部肌肉注射,这也是进行攻毒试验常用的一种方式,但在空肠弯曲菌攻毒试验中少见报道,本研究加上肌肉注射组,其目的是研究空肠弯曲菌能否通过肌肉注射对鸡进行感染。试验结果表明,肌肉注射和口服两种攻毒方法均未引起鸡只产生明显临床症状,这与部分报道[3,4,6,7]禽在自然或试验条件下感染弯曲菌但不引起临床疾病是一致的。两种攻毒方法鸡只虽不产生明显的临床症状,但是均表现肠道的病理变化,迫杀鸡只剖检后肠道尤其是十二指肠都有明显的病变,其他组织如脑、肝脏等均无肉眼可见病变。国外有研究报道[3,4],禽感染空肠弯曲菌后,能够在肠道的苛刻条件下定居,甚至到达下段肠道。本研究感染鸡只引起的肠道病变可能与空肠弯曲菌主要定植在禽的肠道有关。空肠弯曲菌在鸡体内的定植规律及鸡只感染发病的机理有待于进一步研究。
鸡感染空肠弯曲菌后,向外界排泄菌,从而对人类和其他动物造成持续感染[4,8,9]。肛拭子采样方便、快捷,本研究采用肛拭子采样方法从攻毒后第三天、第五天鸡体采集样品进行空肠弯曲菌的分菌,经过培养特性、形态学观察和PCR检测,鉴定为空肠弯曲菌,提示攻毒空肠弯曲菌的鸡在感染后可很快随粪便向外界排泄菌,同时也证实了泄殖腔拭子采样可作为进行禽空肠弯曲菌病流行病学调查活禽采样的方法[8,10],为今后进行禽弯曲菌病的防控提供理论依据。
参考文献:
[1] 韩文瑜,殷 震.空肠弯曲菌共同抗原重组质粒的基因测序及表达产物的特性分析[J].中国预防兽医学报,2001,23(3):170-174.
[2] 何 蕊,黄金林,许海燕,等.弯曲菌多重PCR检测方法的建立及其初步应用[J].扬州大学学报(农业与生命科学版),2007, 28(1):5-8.
[3] SAIF Y M.禽病学[M].苏敬良,高 福,译.第十二版.北京:中国农业出版社,2012.
[4] 罗天海.弯曲杆菌的流行病学、生态学及其可能的控制方法[J].国外畜牧学-猪与禽,2006,26(2):32-34.
[5] JORGENSEN,BAILEY R,WILLIAMS S,et al.Prevalence and numbers of Salmonella and Campylobacter spp. on raw, whole chickens in relation to sampling methods[J]. International Journal of Food Microbiology, 2002, 76(1-2): 151-164.
[6] 赵 迪,马宁泽.猪空肠弯曲菌病及其防治[J].养殖技术顾问,2012(5):151.
[7] WHEELER J G, SETHI D,COWDEN J M,et al. Study of infectious intestinal disease in England: rates in the community,presenting to general practice, and reported to national surveillance[J].British Medical Journal,1999,318:1046-1050.
[8] 侯建军,朱建国,华修国,等.猪、鸡间空肠弯曲杆菌感染分布状况的调查研究[J].中国动物检疫,2007,24(6):29-32.
[9] SENOK A,YOUSIF A,MAZI W,et al. Pattern of antibiotic susceptibility in campylobacter jejuni isolates of human and poultry origin[J]. Jpn J Infect Dis,2007,60(1):1-4.
[10] 张腾飞,詹丽超,罗 玲,等.鸽源空肠弯曲杆菌的分离鉴定及毒力因子分析[J].湖北农业科学,2013,52(24):6120-6123.
