藏羊DQB1基因RT—PCR扩增及序列分析
2015-09-09张晓芬冶贵生马玉花等
张晓芬 冶贵生 马玉花等
摘要:提取藏羊脾脏总RNA,设计DQB1基因引物并进行反转录,扩增产物测序后利用生物软件进行序列分析。结果表明,藏羊DQB1基因长度为786 bp,编码261个氨基酸。藏羊DQB1基因与参考美利奴羊DQB1基因、中国美利奴细毛羊MHCⅡ抗原基因、山羊DQB1基因的核苷酸序列同源性依次为95.8%、95.9%、95.3%,氨基酸序列同源性依次为91.2%、92.0%、91.2%。
关键词:藏羊;DQB1基因;RT-PCR;序列分析
中图分类号:Q75;S826.8+3 文献标识码:A 文章编号:0439-8114(2015)15-3784-02
DOI:10.14088/j.cnki.issn0439-8114.2015.15.053
Abstract: Total RNA from spleen of Tibetan sheep was extracted and reverse transcribed, and primers of DQB1 gene were designed for PCR amplification. Moreover, the gene sequence was analyzed by DNAStar software after the PCR products was sequenced. The results showed that the length of DQB1 gene was 786 bp, encoding 261 amino acids, and compared with DQB1 gene of Merino sheep, MHC Ⅱantigen gene of Merino Fine-Wool sheep and DQB1 gene of goat, the nucleotide sequence homology of Tibetan sheep were 95.8%, 95.9%, 95.3% respectively, and the amino acid sequence homology were 91.2%, 92.0%, 91.2% respectively.
Key words: Tibetan sheep; DQB1 gene; RT-PCR; sequence analysis
藏羊是中国三大原始绵羊品种之一,青海是主产区,分为高原型、山谷型和欧拉型。藏系绵羊具有耐粗饲、抗病力强等优良种质特性[1]。绵羊的主要组织相容性复合体(Major histocompatility complex,MHC)是参与机体免疫应答的重要基因[2],分为Ⅰ类、Ⅱ类和Ⅲ类分子,其中MHC Ⅱ类分子的DRB和DQB基因编码产物在免疫系统中发挥重要的调控作用[3]。Sauermann等[4]研究表明MHC-classII Mamu-DQB1基因可以减缓猴免疫缺陷病毒(SIV)感染猕猴的速度。绵羊MHC-DQB1基因的遗传多态性与绵羊疾病相关,如多浪羊基因单倍型DQB1-DF和DQB1-DH与包虫病的抗性相关[5],MHC在抗病育种显现出重要作用[6]。因此,本研究通过RT-PCR对藏羊DQB1基因进行扩增并对DQB1基因进行序列分析,旨在为青海藏羊遗传资源开发和抗病育种提供参考。
1 材料与方法
1.1 材料
1.1.1 脾脏 采自青海高原型藏羊,液氮速冻, -80 ℃冰箱中保存备用。
1.1.2 主要试剂 EASY spin Plus组织/细胞RNA快速提取试剂盒为北京艾德莱生物科技有限公司产品;Prime Script反转录酶、Ex Taq DNA聚合酶、 DL 2 000 DNA Marker为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 引物设计 根据NCBI登录的绵羊DQB1基因序列,设计藏羊DQB1基因引物,目的基因长度为786 bp。引物序列如下:DQB1-F:5′-ATGTCTGGGA
TGGTGGCTCTGC-3′,DQB1-R:5′-TCAGCGCACAA
GCCCCTTCT-3′。
1.2.2 总RNA的提取 液氮中研磨脾脏成细粉后,后续步骤按试剂盒说明书依次进行。
1.2.3 反转录 按照Prime Script反转录试剂盒说明书依次进行。
1.2.4 DQB1基因的扩增 PCR反应体系:PCR Buffer 5 μL,dNTPs 4 μL,DQB1-F 1 μL,DQB1-R 1 μL,cDNA 3 μL,Ex Taq DNA聚合酶0.5 μL,灭菌水35.5 μL。PCR扩增条件为:94 ℃ 1 min,62 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min,4 ℃保存。
1.2.5 DQB1基因序列分析 将PCR扩增正确的DQB1基因产物送交生物公司进行核苷酸序列测定,应用DNAStar软件对DQB1基因序列进行分析。
2 结果与分析
2.1 藏羊总RNA的提取结果
藏羊脾脏总RNA经1%琼脂糖凝胶电泳检测,结果(图1)表明,提取的总RNA虽有部分降解,但基本满足反转录的要求。
2.2 DQB1基因RT-PCR扩增结果
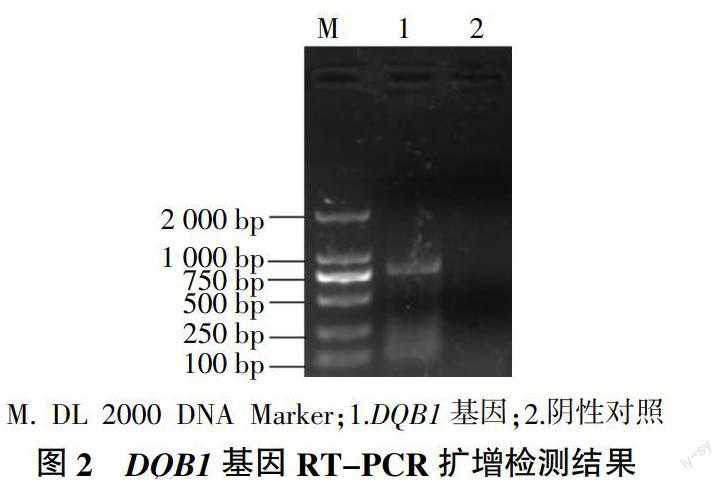
将RT-PCR扩增产物进行1%琼脂糖凝胶电泳,结果(图2)表明,DQB1基因所在泳道出现目的条带,阴性对照无条带。
2.3 DQB1基因序列分析
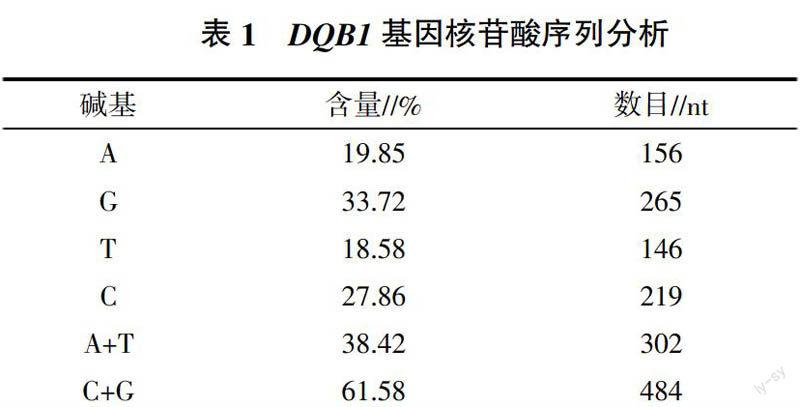
2.3.1 核苷酸序列分析 测定的藏羊DQB1基因核苷酸序列经DNAStar软件分析表明,DQB1基因核苷酸序列长度为786 nt,鸟苷酸含量较高,达到33.72%,整个基因序列中A+T的含量较低(表1)。
2.3.2 藏羊与参考羊DQB1基因核苷酸与氨基酸序列同源比对分析 将藏羊DQB1基因与参考美利奴羊DQB1基因(登录号:L08792.1)、中国美利奴细毛羊MHCⅡ抗原基因(登录号:JQ824377.1)、山羊DQB1基因(登录号:AY464653.1)的核苷酸序列与氨基酸序列进行比对,结果(图3)表明,藏羊DQB1基因与参考美利奴羊DQB1基因、中国美利奴细毛羊MHCⅡ抗原基因、山羊DQB1基因的核苷酸序列同源性依次为95.8%、95.9%、95.3%;藏羊与参考羊DQB1基因核苷酸同源性比较结果(图4)显示,藏羊DQB1基因与美利奴羊DQB1基因之间有3个碱基的插入及33处核苷酸突变,与中国美利奴细毛羊MHC II抗原基因之间有32处碱基突变,与山羊DQB1基因之间有37处碱基突变,碱基突变以A-G、C-T间的转换为主,但也发生低频率的A-T、G-C间的颠换;氨基酸序列同源性依次为91.2%、92.0%、91.2%(图5)。
3 讨论
藏羊DQB1基因与美利奴羊DQB1基因、中国美利奴细毛羊的MHC II抗原基因的核苷酸和氨基酸序列存在一定的差异,说明DQB1基因由于遗传变异可能会导致不同品种绵羊在抗病力或在对疾病的敏感程度上存在差异。另外,藏羊DQB1基因、美利奴羊DQB1基因、中国美利奴细毛羊MHC II抗原基因与山羊DQB1基因的核苷酸和氨基酸序列差异较小,说明羊DQB1基因具有一定的相对保守性。
参考文献:
[1] 闫忠心,靳义超,白海涛,等.藏羊本品种选育研究现状与展望[J].青海畜牧兽医杂志,2014,44(4):55.
[2] 申 红,杜迎春,贾 斌,等.多浪羊MHC-DQB1基因多态性与包虫病的抗性分析[J].中国人兽共患病学报,2009,25(1):17-22.
[3] 余智勇,彭林泽,贾 斌,等.绵羊MHC基因的研究现状[J].贵州畜牧兽医,2006,30(4):12-13.
[4] SAUERMANN U,KRAWCZAK M,HUNSMANNL G, et al. Identification of Mhc-Mamu DQB1 allele combinations associated with rapid disease progression in rhesus macaques infected with simian immunodeficiency virus[J]. AIDS,1997,11(9):1196-1198.
[5] 杜迎春.新疆多浪羊和中国美利奴羊MHC-DRB1、DQB1基因SSCP多态性与包虫病抗性研究[D].新疆石河子:石河子大学,2010.
[6] 惠文巧,侯宏艳,汤继顺,等.绵羊MHCⅡ类基因与疾病相关性研究进展[J].家畜生态学报,2014,35(11):1-5.
