接合转移技术将外源DNA大片段引入变铅青链霉菌中的研究
2015-09-09戴世鲲周丹燕王广华等
戴世鲲 周丹燕 王广华等


摘要:为了发展一种将150 kb及以上的外源DNA片段引入变铅青链霉菌(Streptomyces lividans)中的有效方法,以大肠杆菌-变铅青链霉菌穿梭细菌人工染色体为载体,将携带完整格尔德霉素生物合成基因簇的3个150~180 kb的外源DNA片段期望以接合转移的方式从大肠杆菌宿主菌(Escherichia coli ET12567/pUZ8002)中横向转移入变铅青链霉菌(Streptomyces lividans)TK23菌株中。结果表明,接合转移技术能够有效地将携带完整格尔德霉素生物合成基因簇的3个外源DNA大片段引入到变铅青链霉菌基因组中并稳定传代。
关键词:接合转移技术;外源DNA大片段;细菌人工染色体;变铅青链霉菌(Streptomyces lividans)
中图分类号:R318 文献标识码:A 文章编号:0439-8114(2015)15-3776-03
DOI:10.14088/j.cnki.issn0439-8114.2015.15.051
Abstract: In order to develop an efficient method of transferring 150 kb and above foreign DNA fragments into Streptomyces lividans, intergeneric conjugation technology was utilized to transfer three 150~180 kb foreign DNA fragments, carrying whole geldanamycin biosynthesis gene cluster, into S. lividans TK23 genome, with bacterial artificial chromosome (BAC) of Escherichia coli ET12567/pUZ8002-S. lividans TK23 as vectors. The result showed that all the three foreign DNA fragments were efficiently transferred into S. lividans TK23, and were steadily inherited.
Key words: intergeneric conjugation technology; big foreign DNA fragments; bacterial artificial chromosomes (BAC); Streptomyces lividans
放线菌是一类革兰氏阳性菌,能够产生丰富的具有生物学活性的次级代谢产物和新颖的抗生素。这些天然产物通常是由大片段生物合成基因簇合成的,例如聚酮合成酶(Polyketide synthase,PKS)和非核糖体多肽合成酶(Nonribosomal peptide synthase,NRPS)。为了分析和操作这些完整的生物合成途径,异源表达是一个重要的手段,特别是对于那些沉默的基因簇和天然产物生物合成的基因簇的研究[1]。然而,部分已经报道的生物合成基因簇都已超过100 kb,例如rapamycin生物合成基因簇是107 kb[2]、daptomycin生物合成基因簇是128 kb[3]。对这些生物合成基因簇进行异源表达的遗传操作中,将大片段DNA引入宿主菌链霉菌中是其中的关键步骤。一种策略是将生物合成基因簇分配到几个兼容的质粒中,在异源宿主中通过共表达实现抗生素的生物合成过程[4]。Zirkle等[5]将soraphen A基因簇分配到2个兼容的质粒中,共转化变铅青链霉菌(Streptomyce lividans)原生质体,共表达生物合成化合物。另一种策略是使用细菌人工染色体(Bacterial artificial chromosome, BAC)载体携带完整的抗生素生物合成基因簇。Penn等[3]首次利用原生质体转化的方法将含有完整的daptomycin生物合成基因簇的BAC质粒成功引入变铅青链霉菌中。在放线菌类群中,变铅青链霉菌是异源表达的重要菌种[6,7]。在本研究中,首次利用接合转移技术成功地将3个150~180 kb的外源DNA片段引入到变铅青链霉菌中,并得到了稳定传代。这为大片段的生物合成基因簇在变铅青链霉菌中进行异元表达研究和大范围改造链霉菌基因组提供了一种有效的技术方法。
1 材料与方法
1.1 材料
菌株、质粒以及生长条件和培养基:大肠杆菌(Escherichia coli)使用Luria-Bertani(LB)固体和液体培养基,添加的抗生素浓度为阿伯拉霉素(Apramycin)50 μg/mL、卡那霉素(Kanamycin)25 μg/mL、氯霉素(Chloramphenicol)12.5 μg/mL。大肠杆菌ET12567/pUZ8002菌株作为变铅青链霉菌TK23菌株接合转移的供体菌。变铅青链霉菌菌株以MS为固体培养基,在28 ℃培养。载体pBAC-1003是一个16 kb的大肠杆菌和变铅青链霉菌的穿梭BAC载体,组成元件包括φC31 int、attP、oriT和阿伯拉霉素抗性基因[aac(3)Ⅳ]。3个BAC质粒pH4E9、pH19H10和pH22H5分别以pBAC-1003为载体,插入片段覆盖完整的格尔德霉素(Geldanamycin)生物合成基因簇,脉冲场凝胶电泳(Pulsed field gel electrophoresis,PFGE)显示插入片段分布为150~180 kb(图1)。2×YT培养基(1 L培养基加16 g Difco Bacto tryptone,10 g Difco Bacto yeast extract,5 g NaCl),AS-1培养基(1 L培养基加1 g yeast extract,0.2 g L-alanine,0.2 g L-arginine, 0.5 g L-asparagine,5 g soluble starch,2.5 g NaCl,10 g Na2SO,20 g agar, pH 7.5)和MS(Mannitol soya flour)培养基(1 L培养基加20 g mannitol,20 g soya flour,20 g agar)用于准备变铅青链霉菌孢子和接合转移培养基。
1.2 大片段BAC质粒的接合转移
质粒pBAC-1003、pH4E9、pH19H10和pH22H5分别被电转化至大肠杆菌ET12567/pUZ8002菌株中。与变铅青链霉菌TK23菌株的接合转移根据标准方法[8]稍作修改,具体步骤:①供体菌大肠杆菌ET12567/pUZ8002菌株接种于LB培养基,在37 ℃摇床中培养至OD600为0.4~0.6。②离心收集细胞,用等体积的LB液体培养基洗2次,最后悬浮于0.1倍体积的LB培养基中。③从MS平板上刮取收集变铅青链霉菌孢子,并悬浮于2×YT培养基中,制成浓度为108个孢子/500 μL的孢子悬液,50 ℃热激10 min预萌发。④将500 μL大肠杆菌供体菌悬液加入准备好的500 μL孢子液中,混合物涂布在AS-1培养基平板上,平板中添加MgCl2至终浓度为10 mmol/L。⑤平板28 ℃培养16~20 h后,每个平板的表面覆盖含有0.5 mg萘啶酮酸(Nalidixic acid)、1 mg阿伯拉霉素和1 mL水的混合物。平板在28 ℃继续培养6 d。⑥将平板上长出的菌落(疑是阳性接合子)在MS培养基平板上划线转接,培养基中添加25 μg/mL萘啶酮酸和50 μg/mL阿伯拉霉素。
1.3 变铅青链霉菌TK23阳性接合子的PCR验证
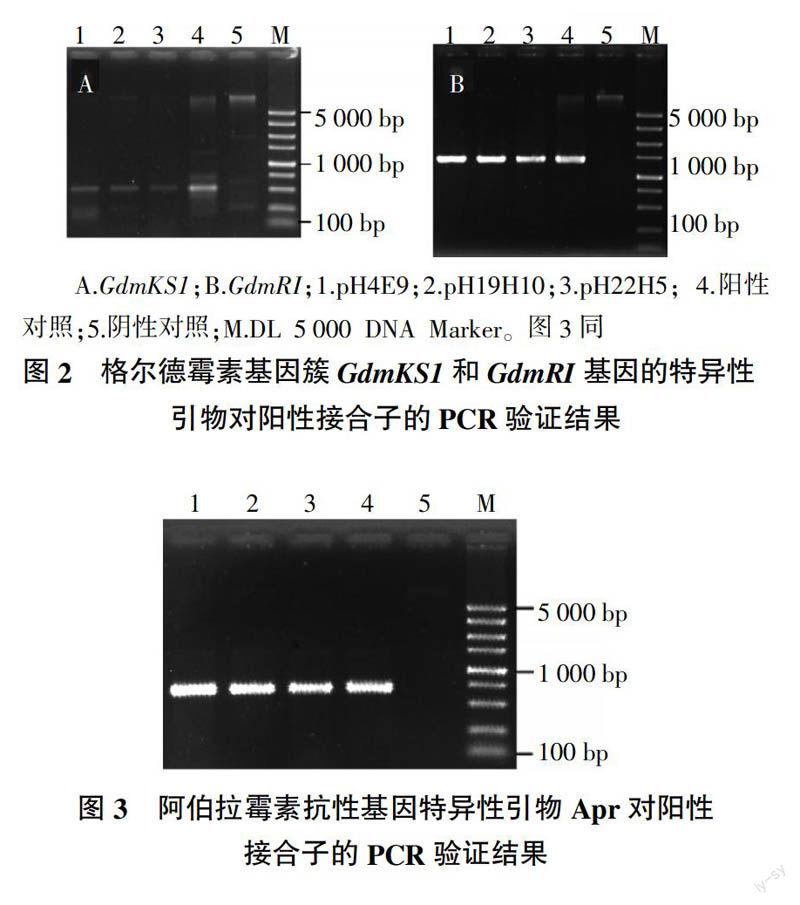
采用PCR方法验证阳性接合子基因组中的外源DNA片段,即携带格尔德霉素生物合成基因簇的BAC质粒。在添加阿伯拉霉素和萘啶酮酸的MS平板上划线培养3代之后,提取阳性接合子基因组DNA。3对特异性引物用于联合检测阳性接合子,其中两对为格尔德霉素基因簇的特异性引物,扩增区域分别是格尔德霉素生物合成基因簇的聚酮合成酶(PKS)第一个酮基合成酶(KS)域GdmKS1基因(forward:5′-GGTGTCGGGTTGGTGTTGCTG-3′, reverse:5′-GCTGACGCCGAAGGAGGAGATT-3′)和后修饰区域的GdmRI基因(forward:5′-GCTGACCGTGATGTAGAGGC-3′,reverse:5′-AGCGGTATCTGTGCTTCCTG-3′),这两个基因分别位于格尔德霉素基因簇前端和末端[9];第三对引物为阿伯拉霉素抗性基因的特异性引物Apr(Apr_1:5′-CAGTTGACCCAGGGCTGTC-3′,Apr_2:5′-GCAATACGAATGGCGAAAA-3′)。PCR反应采用Ex Taq聚合酶(TaKaRa),阳性接合子的基因组DNA作为模板。PCR反应程序:94 ℃变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,30个循环;最后72 ℃延伸10 min。PCR扩增产物TA克隆至pMD18-T载体中,进一步测序验证。
2 结果与分析
2.1 变铅青链霉菌TK23菌株阳性接合子的验证
以格尔德霉素原始产生菌的基因组DNA作为阳性对照,变铅青链霉菌TK23受体菌的基因组DNA作为阴性对照。3个BAC质粒的变铅青链霉菌TK23阳性接合子基因组DNA使用GdmKS1基因和GdmRI基因的两对引物进行PCR扩增均能得到目标条带(图2),测序结果证实序列正确。同时阿伯拉霉素抗性基因的特异性引物Apr对阳性接合子的PCR扩增条带和测序结果均正确(图3)。3对联合检测的特异性引物的PCR结果表明接合转移试验是成功的。
2.2 大片段BAC质粒的接合转移效率
3个BAC质粒通过接合转移进入变铅青链霉菌TK23受体菌后,BAC质粒在int基因的表达产物整合酶的作用下整合到受体菌基因组中。大片段BAC质粒的接合转移效率(阳性接合子数除以变铅青链霉菌受体菌孢子数)对于插入片段的长度具有一定的敏感性。3个插入片段为150~180 kb的BAC质粒与空载BAC质粒相比,接合转移的效率明显降低(图4),空载BAC质粒的接合转移效率为1.1×10-3,3个BAC质粒pH4E9、pH19H10和pH22H5的接合转移效率分别为2.5×10-6、3.8×10-6和7.3×10-7,比空载BAC质粒的接合转移效率低103个数量级。BAC质粒pH22H5的插入片段最大(约180 kb),因而其接合转移效率也是最低的。
3 讨论
原生质体转化是经典的链霉菌基因转移方法,但是原生质体转化的试验操作复杂,包括原生质体的制备和转化后细胞的再生,外源DNA易受到原生质体制备过程中产生的胞外核酸酶的作用而降解,整个试验过程难以控制。与原生质体转化相比,接合转移的试验过程较简单,可避开胞外核酸酶的降解作用,同时还可克服链霉菌对外源DNA的限制性障碍,目前已在多个种属的链霉菌中成功使用。
接合转移供体菌常选择大肠杆菌ET12567菌株,它是一种甲基化缺陷型菌株,可有效地避免一些链霉菌种属中甲基化修饰限制系统的作用。接合转移的质粒载体一般为大肠杆菌和链霉菌的穿梭载体。在接合转移过程中,穿梭载体在pUZ8002的辅助下进入链霉菌菌株中。外源DNA在穿梭载体上int基因表达的产物整合酶作用下,载体中的attP序列与链霉菌基因组中的attB序列发生特异性重组,将穿梭载体及其携带的外源DNA整合到链霉菌基因组中。
目前,接合转移技术常用于链霉菌的基因敲除和基因回补[10],多是10 kb以下短片段,用于cosmid载体也有报道,但大片段BAC质粒则少有报道。本研究首次利用接合转移技术将3个150~180 Kb的外源DNA片段引入变铅青链霉菌中,这一方法扩展了在链霉菌异源宿主中运送大片段外源DNA的遗传操作技术,有助于对链霉菌代谢工程和合成生物学的研究。这项研究结果暗示在自然环境中微生物菌株间的大片段DNA横向转移具有一定的可能性,而这种可能性是抗生素生物合成途径进化理论的假说之一。
参考文献:
[1] 黄 胜,李 娜,周 俊,等.适用于链霉菌大片段基因组DNA克隆和异源表达的细菌人工染色体(BAC)载体的构建及应用[J].微生物学报,2012,52(1):30-37.
[2] SCHWECKE T,APARICIO J F,MOLNAR I,et al. The biosynthetic gene cluster for the polyketide immunosuppressant rapamycin[J].Proc Natl Acad Sci USA,1995,92(17):7839-7843.
[3] PENN J, LI X,WHITING A,et al. Heterologous production of daptomycin in Streptomyces lividans[J]. J Ind Microbiol Biotechnol,2006,33(2):121-128.
[4] KAO C M,KATZ L,KHOSLA C. Engineered biosynthesis of a complete macrolactone in a heterologous host[J].Science, 1994,265(5171): 509-512.
[5] ZIRKLE R, LIGON J M, MOLN?魣R I. Heterologous production of the antifungal polyketide antibiotic soraphen A of Sorangium cellulosum So ce26 in Streptomyces lividans[J]. Microbiology, 2004, 150(Pt8): 2761-2774.
[6] ROBBEL L, MARAHIEL M A. Daptomycin, a bacterial lipopeptide synthesized by a nonribosomal machinery[J]. J Biol Chem,2010,285(36):27501-27508.
[7] ZHANG H, WANG Y, PFEIFER B A. Bacterial hosts for natural product production[J]. Mol Pharm,2008,5(2):212-225.
[8] TOBIAS K, BIBB M J, MARK J B, et a1. Practical Streptomyces Genetic[M]. Norwich, UK: The John Innes Foundation, 2000.
[9] DAI S,OUYANG Y,WANG G,et a1.Streptomyces autolyticus JX-47 large-insert bacterial artificial chromosome library construction and identification of clones covering geldanamycin biosynthesis gene cluster[J]. Curr Microbiol,2011,63(1):68-74.
[10] 林钦恒,张光涛,李苏梅,等.浅蓝霉素产生菌海洋异壁放线菌WH1-2216-6遗传操作体系的建立[J].微生物学报,2011, 51(8):1032-1041.
