超高效液相色谱法快速测定葡萄酒中酚酸
2015-09-09李记明江南大学生物工程学院工业生物技术教育部重点实验室食品科学与技术国家重点实验室酿酒微生物与酶技术研究室江苏无锡4烟台张裕葡萄酿酒股份有限公司山东烟台64000
唐 柯,马 磊,徐 岩*,李记明(.江南大学 生物工程学院,工业生物技术教育部重点实验室,食品科学与技术国家重点实验室,酿酒微生物与酶技术研究室,江苏无锡4;.烟台张裕葡萄酿酒股份有限公司,山东 烟台 64000)
超高效液相色谱法快速测定葡萄酒中酚酸
唐柯1,马磊1,徐岩1*,李记明2
(1.江南大学 生物工程学院,工业生物技术教育部重点实验室,食品科学与技术国家重点实验室,酿酒微生物与酶技术研究室,江苏无锡214122;2.烟台张裕葡萄酿酒股份有限公司,山东 烟台 264000)
通过选择检测波长和优化色谱条件,建立一种8 min内分离葡萄酒中13种酚酸的反相超高效液相色谱(UPLC)检测方法。色谱条件:以2%乙酸和纯甲醇为流动相,采用ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱,流速为0.30 mL/min,检测波长为280 nm和320 nm,柱温为50℃,进样量为1 μL。结果表明:13种酚酸的最低检测限均<0.10 mg/L,标准曲线线性相关性(R2)均>0.99,回收率为90%~110%,且其相对标准偏差(RSD)均<3.00%,保留时间及峰面积的RSD均分别<1.00%、3.00%。该方法灵敏度高、速度快、分离度高,精密度及稳定性良好。样品中检测结果表明,该方法适合葡萄酒中酚酸的检测。
超高效液相色谱;酚酸;葡萄酒;检测
葡萄酒是以新鲜的葡萄或葡萄汁为原料,经过全部或者是部分发酵酿造而成的含有一定酒精度的饮料[1],是世界上消费量最大的果酒。酚酸是葡萄及葡萄酒中最主要的非类黄酮,多为对羟基苯甲酸和对羟基肉桂酸及其衍生物,作为一种次生代谢产物广泛存在于植物体中,这类化合物具有一个苯核。大量研究证明,酚酸与葡萄的生长发育和抗性密切相关。近年来研究发现,酚酸类物质,对葡萄酒的风味、色泽等起着重要的作用,如咖啡酸具有抗氧化性,有助于葡萄酒颜色的稳定[2]。除此之外,酚酸具有营养保健作用和抗氧化性的药用价值,与人类的健康有密切关系[3]。
高效液相色谱法(high performance 1iquid chromatography,HPLC),尤其是液相色谱质谱(1iquidchromatographymass spectrometry,LC-MS)联用法是目前应用最为广泛的检测葡萄酒中酚酸的方法。JAITZ L等[4]应用液相色谱串联质谱(1iquid chromatography tandem mass spectrometry,LC-MS/MS)法检测了奥地利葡萄酒中5种酚酸;PEREIRA V等[5]建立了葡萄酒中9种酚酸的HPLC检测方法;陈建业等[6]也建立了葡萄酒中11种酚酸的HPLC检测方法。这些方法准确、灵敏、重复性好,但存在耗时较长的缺点,分离时间大都接近1 h。随着超高效液相色谱(u1tra performance 1iquid chromatography,UPLC)的问世,更高效率,高灵敏度,高分离度的检测葡萄酒中酚类物质的方法被开发出来。除此之外,由于UPLC-DAD方法检测限更低,因而越来越受到世界各大研究机构的欢迎[7-10]。SPÁCˇIL Z等[11]建立了4 min以内分离葡萄酒中11种酚酸的UPLC检测方法,对比了UPLC-二极管阵列检测器(diode-array detector,DAD)和HPLC-DAD分析酚类物质的方法,两种方法都得到了良好的分离效果,但UPLC-DAD更加灵敏、快速同时大幅减少流动相的消耗,节约成本。TRAUTVETTER S等[12]建立了14 min以内分离蜂蜜中37种酚类物质的超高效液相-质谱(UPLC-MS)联用检测方法。目前国内关于UPLC检测葡萄酒中风味物质的研究报道甚少,而酚酸不仅是葡萄酒风味物质的关键组成,同时也是葡萄酒中重要的生理活性物质,因此建立葡萄酒中酚酸类物质的快速测定方法,分析葡萄酒中酚酸的种类及含量具有重要意义。本实验通过对色谱条件的选择和优化,旨在建立一种利用UPLC高效、快速测定葡萄酒中13种酚酸的分析方法,并应用于葡萄酒样品的测定。
1 材料与方法
1.1材料与试剂
葡萄酒样品由烟台张裕集团提供,其中包括2款干红葡萄酒(干红2010年、干红2011年)和2款干白葡萄酒(干白2010年、干白2011年);0.22 μm滤膜:上海安谱实验科技股份有限公司。
没食子酸、原儿茶酸、龙胆酸、p-羟基苯甲酸、绿原酸、咖啡酸、香草酸、丁香酸、p-香豆酸、阿魏酸、芥子酸、鞣花酸、水杨酸(纯度≥95%):美国Sigma-A1drich公司;甲醇、冰醋酸(纯度≥98%):德国CNW公司;电阻率18 MΩ·cm的超纯水:美国Mi11ipore simp1icity公司。
1.2仪器与设备
Waters ACQUITY UPLC H-C1ass超高效液相色谱仪(配置二极管阵列检测器、样品管理器、溶剂管理器、柱温箱、Empower色谱工作站)、ACQUITYUPLCBEHC18(100mm× 2.1mm,1.7μm)色谱柱:美国沃特世公司;Mi11i-QAcademic超纯水系统:密理博(中国)有限公司;E1masonic E60H超声波振荡器:德国ELMA公司;循环水式真空泵SHZ-D(Ⅲ):巩义市予华仪器有限责任公司。
1.3实验方法
1.3.1流动相配制
流动相A:准确量取10.00 mL乙酸,定容至500 mL容量瓶中,经0.22 μm的水相滤膜减压抽滤后,于超声波振荡器内振荡10 min。
流动相B:准确量取500 mL甲醇,经0.22 μm的有机相滤膜减压抽滤后,于超声波振荡器内振荡10 min。
1.3.2酚酸标准品溶液的制备
分别称取约10~50mg的没食子酸、原儿茶酸、龙胆酸、p-羟基苯甲酸、绿原酸、咖啡酸、香草酸、丁香酸、p-香豆酸、阿魏酸、芥子酸、鞣花酸、水杨酸标准品,用色谱级甲醇定容于10 mL容量瓶中,配成混合溶液,将此溶液稀释成不同浓度梯度的标准溶液,于-20℃下保存备用。
1.3.3样品前处理
用于酚酸测定的葡萄酒样品经0.22 μm水相滤膜过滤后直接进样。
1.3.4色谱条件
ACQUITY UPLC BEH C18(2.1 mm×150 mm,1.7 μm)色谱柱,检测波长为280 nm和320 nm,柱温50℃,流速0.3 mL/min,进样量1 μL。
流动相A:100%甲醇,B:2%乙酸。
洗脱程序:0~3.2 min,8~20%B;3.2~8.0 min,20~44%B;8.0~8.2 min,44~8%B;8.2~10 min,8%B。
1.3.5定性定量方法
定性方法:峰面积增高法进行定性。定量方法:外标法进行定量。
2 结果与分析
2.1检测波长的选择
分别对13种酚酸的标准品溶液进行全波长扫描,扫描波段为210~400nm。结果表明:13种物质最大吸收峰互不相同,但除龙胆酸(320nm)外,其他酚酸在280nm处均有最大或较大吸收。因此,本实验选择280nm、320nm为检测波长。
2.2流动相的选择
当前,国内外有关葡萄酒中酚酸的反相液相色谱检测的报道主要以稀酸水溶液和有机相为流动相进行梯度洗脱。本实验分别尝试了不同浓度的甲酸或乙酸和甲醇或乙腈为组合作为流动相进行梯度洗脱,发现2%的乙酸和100%甲醇洗脱时,效果最佳。因此,本实验选择100%甲醇及2%乙酸作为流动相。
2.3色谱条件的优化
本实验以2.0%乙酸水溶液和纯甲醇为流动相,进行梯度洗脱。分别以0.20 mL/min、0.25 mL/min、0.30 mL/min、0.35mL/min的流速进样;温度分别设置为20℃、30℃、40℃、50℃;进样量设置为1μL、2μL、3μL、4μL、5μL。结果显示:进样量选择1 μL,在50℃的柱温下,以0.30 mL/min的流速进样时分离效果最好。
2.4葡萄酒中酚酸的定性
对13种酚酸混合标准品进行色谱检测,得到13种酚酸标准品色谱图(见图1),对葡萄酒样品进行色谱检测,得到葡萄酒样品中13种酚酸的UPLC色谱图(见图2)。由图1、图2可知,13种酚酸标准品和葡萄酒样品在上述色谱条件下,能够充分分离。
用峰面积增高法进行定性,13种酚酸出峰顺序依次为:没食子酸(ga11ic acid)、原儿茶酸(protocatechuic acid)、龙胆酸(gentisic acid)、p-羟基苯甲酸(p-hydroxybenzoic acid)、绿原酸(ch1orogenic acid)、咖啡酸(caffeic acid)、香草酸(vani11ic acid)、丁香酸(syringic acid)、p-香豆酸(p-coumaric acid)、阿魏酸(feru1ic acid)、芥子酸(sinapic acid)、鞣花酸(e11agic acid)、水杨酸(sa1icy1ic acid)。

图1 13种酚酸标样的UPLC检测色谱图Fig.1 UPLC chromatogram of 13 phenolic acids in standard sample

图2 葡萄酒样品13种酚酸UPLC检测色谱图Fig.2 UPLC chromatogram of 13 phenolic acids in wine
2.5标准曲线的建立
葡萄酒中的酚酸的定量采用外标法,准确配制0.20~211.20 mg/L的8个不同质量浓度的13种酚酸的混合标样,按照上述液谱条件进样。以峰面积(Y)为纵坐标,质量浓度(X)为横坐标,计算得到13条酚酸标准曲线回归方程。结果见表1。由表1可知,13种酚酸标准品溶液的质量浓度与峰面积间的线性相关系数均大于0.99,呈现出良好的线性关系。根据3倍基线噪音所对应的各组分的质量浓度值即为各组分的最低检出限,测定结果表明13种酚酸最低检测限(1imit of detection,LOD)均低于0.10 mg/L,说明此方法定量灵敏度高、准确度高、可行性好,符合实验对于定量要求。
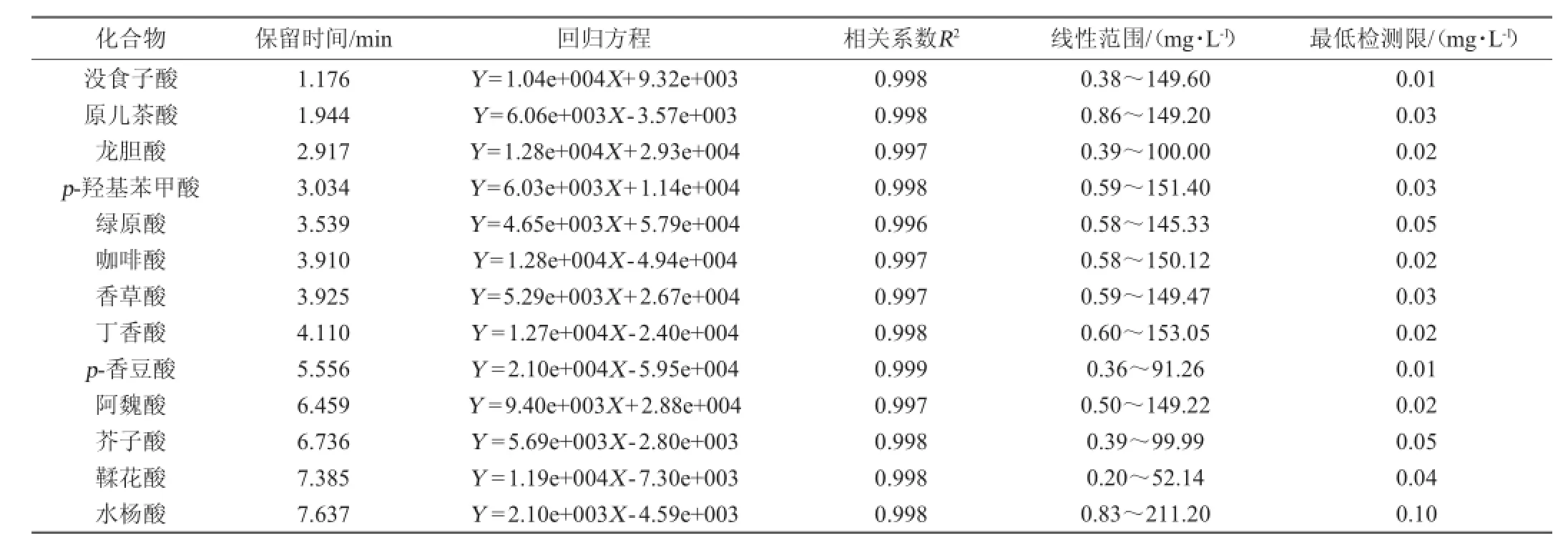
表1 13种酚酸的线性方程及最低检出限(n=8)Table 1 Linear equation and the lowest detectable limit of 13 phenolic acids(n=8)
2.6加标回收率实验
在已测定葡萄酒样品中分别添加一定质量浓度的12种酚酸的标准品,测定其总质量浓度,计算加标回收率,结果见表2。加标回收率=(加标试样测定值-试样测定值)÷加标量×100%。由表2可知,葡萄酒中可以检测到的12种酚酸的回收率为90%~110%,相对标准偏差(re1ative standard deviation,RSD)均小于3.00%,表明该方法准确度高,符合实验对于定量的要求。
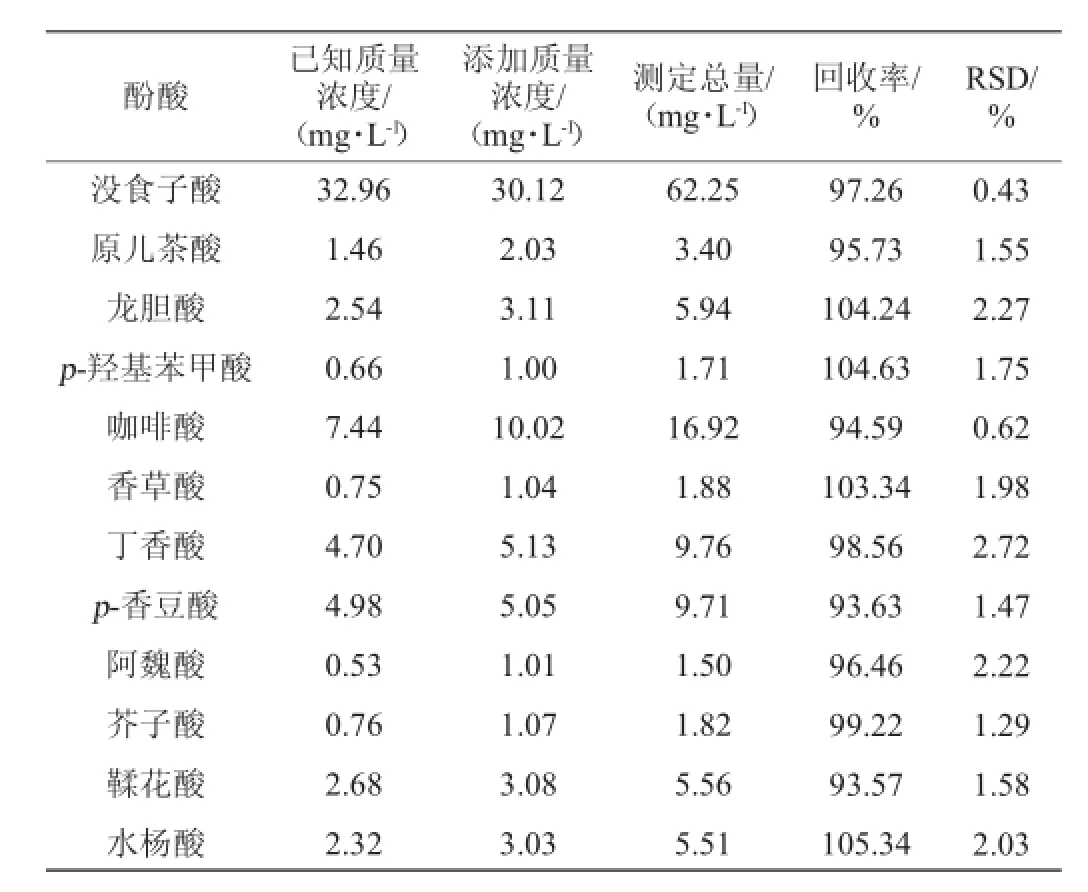
表2 12种酚酸的加标回收率试验结果(n=5)Table 2 Results of recovery rates of 12 phenolic acids(n=5)
2.7精密度和稳定性检验
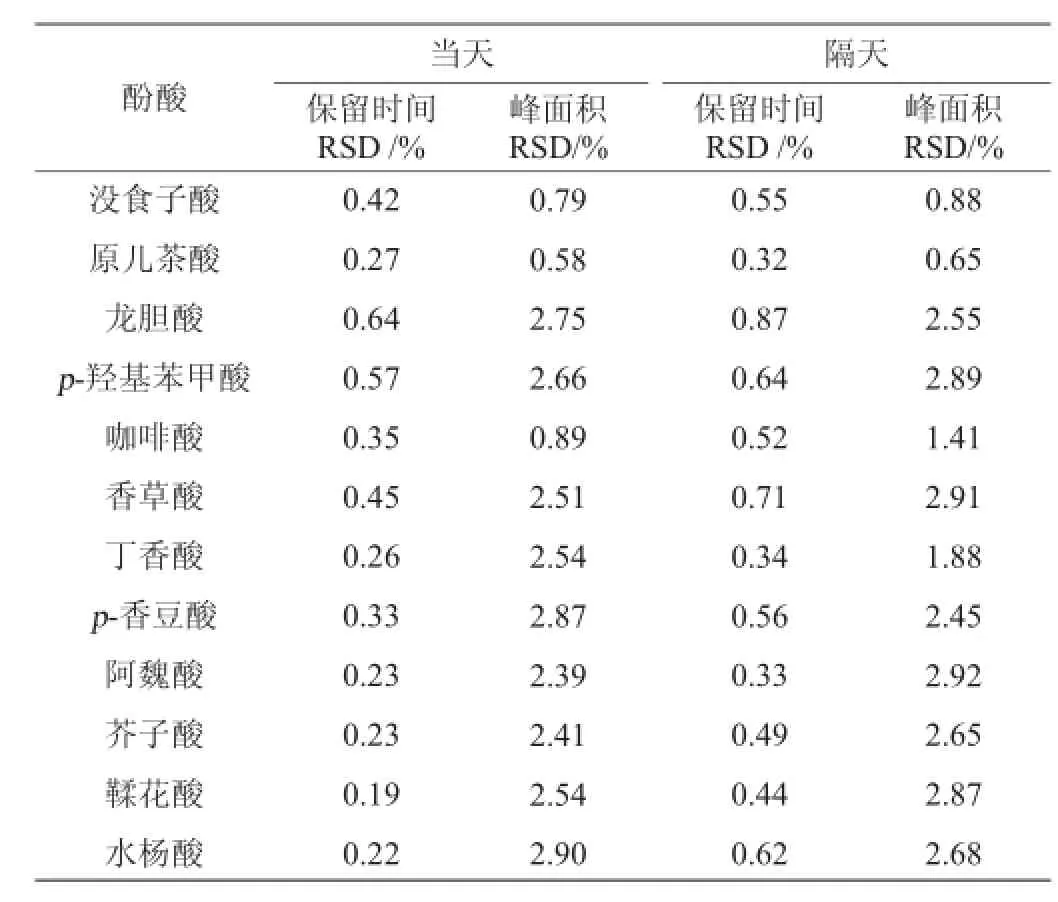
表3 精密度及稳定性试验结果(n=5)Table 3 Results of precision and stability tests(n=5)
在上述色谱条件下,分别在当天和隔天将葡萄酒样品连续进样5次,对12种酚酸的保留时间和峰面积进行相对标准偏差(RSD)计算,结果见表3。由表3可知,12种酚酸保留时间的RSD都极小,均低于1.00%;峰面积的RSD均小于3.00%。说明该检测方法精密度高,稳定性好。
2.8葡萄酒样品中酚酸的检测
应用上述建立的UPLC方法检测4款葡萄酒中酚酸的含量,结果如表4所示。由表4可知,4款葡萄酒样品中均没有检测到绿原酸。干红葡萄酒中,没食子酸是最主要的酚酸,含量最高;咖啡酸、丁香酸、p-香豆酸含量也比较高,其他酚酸含量较低,有些不足1mg/L。干白与干红葡萄酒差别很大,除绿原酸外香草酸、阿魏酸没有检测到,没食子酸含量极低,不足1 mg/L;龙胆酸和咖啡酸含量比较高,但仍不足10 mg/L,其他酚酸含量较低,这与GÓMEZ-ALONSO S等[13-14]的研究结果基本一致。干红葡萄酒样品总酚酸含量为61.47~74.41 mg/L,干白葡萄酒样品总酚酸含量为32.49~44.08 mg/L,干红葡萄酒总酚酸含量明显高于干白葡萄酒,主要源于干红、干白葡萄酒酿造工艺的不同所致[15]。

表4 葡萄酒样品中13种酚酸的检测结果(n=3)Table 4 Detection results of 13 phenolic acids in wine(n=3)
3 结论
本实验建立了一种快速分离葡萄酒中13种酚酸的UPLC检测方法。通过检测波长的选择和色谱条件的优化,实现了8min以内分离葡萄酒中13种酚酸。13种酚酸的最低检测限均低于0.10 mg/L,标准曲线线性相关性均大于0.99,回收率为90%~110%且RSD均小于3.00%,保留时间的RSD均低于1.00%,峰面积的RSD均小于3.00%,该方法灵敏度高、速度快、分离度高,精密度及稳定性良好。与传统HPLC法相比,分离速度快,检测限低[6]。
酒样中酚酸检测结果表明,绿原酸均没有检测到。红葡萄酒中,没食子酸是最主要的酚酸,咖啡酸、丁香酸、p-香豆酸含量也比较高,其他酚酸含量较低。干白与干红葡萄酒中酚酸含量差别很大,干白中除绿原酸外,香草酸、阿魏酸也未检测到,而没食子酸含量极低,龙胆酸和咖啡酸含量相对较高。总酚酸含量,干红葡萄酒明显高于干白葡萄酒。
UPLC作为一种新型液相色谱技术以灵敏度高、速度快、分离度高等特点为现代色谱分析提供了广阔的前景,将会为葡萄酒分析化学的发展中发挥更重要的作用。
[1]柴菊华,崔彦志,杜彬,等.昌黎产区7个单品种干红葡萄酒氨基酸分析[J].中国酿造,2010,29(10):181-183.
[2]DARIAS-MARTÍN J J,RODRÍGUEZ O,DÍAZ E,et a1.Effect of skin contact on the antioxidant pheno1ics in white wine[J].Food Chem,2000,71(4):483-487.
[3]TOMÁS-BARBERÁN F A,ESPÍN J C.Pheno1ic compounds and re1ated enzymes as determinants of qua1ity in fruits and vegetab1es[J].J Sci Food Agr,2001,81(9):853-876.
[4]JAITZ L,SIEGL K,EDER R,et a1.LC-MS/MS ana1ysis of pheno1s for c1assification of red wine according to geographic origin,grape variety and vintage[J].Food Chem,2010,122(1):366-372.
[5]PEREIRA V,CÂMARA J S,CACHO J,et a1.HPLC-DAD methodo1ogy for the quantification of organic acids,furans and po1ypheno1s by direct injection of wine samp1es[J].J Sep Sci,2010,33(9):1204-1215.
[6]陈建业,温鹏飞,战吉宬,等.葡萄酒中11种酚酸的反相高效液相色谱测定方法研究[J].中国食品学报,2007,6(6):133-138.
[7]KLEJDUS B,VACEK J,LOJKOVA L,et a1.U1trahigh-pressure 1iquid chromatography of isof1avones and pheno1ic acids on different stationary phases[J].J Chromatogr A,2008,1195(1):52-59.
[8]RACZKOWSKA J,MIELCARZ G,HOWARD A,et a1.UPLC and spectrophotometric ana1ysis of po1ypheno1s in wines avai1ab1e in the po1ish market[J].Int J Food Prop,2011,14(3):514-522.
[9]MIKULÍKOVÁ R,BĚLÁKOVÁ S,BENEŠOVÁ K,et a1.Study of ochratoxin A content in South Moravian and foreign wines by the UPLC method with f1uorescence detection[J].Food Chem,2012,133(1):55-59.
[10]FIECHTER G,MAYER H.UPLC ana1ysis of free amino acids in wines: Profi1ing of on-1ees aged wines[J].J Chromatogr B,2011,879(17): 1361-^1366.
[11]SPÁCIL Z,NOVÁKOVÁ L,SOLICH P.Ana1ysis of pheno1ic compounds by high performance 1iquid chromatography and u1tra performance 1iquid chromatography[J].Talanta,2008,76(1):189-199.
[12]TRAUTVETTER S,KOELLING-SPEER I,SPEER K.Confirmation of pheno1ic acids and f1avonoids in honeys by UPLC-MS[J].Apidologie,2009,40(2):140-150.
[13]GÓMEZ-ALONSOS,GARCÍA-ROMEROE,HERMOSÍN-GUTIÉRREZ I.HPLC ana1ysis of diverse grape and wine pheno1ics using direct injection and mu1tidetection by DAD and f1uorescence[J].J Food Compos Anal,2007,20(7):618-626.
[14]SÁENZ-NAVAJAS M P,TAO Y S,DIZY M,et a1.Re1ationship between nonvo1ati1e composition and sensory properties of premium Spanish red wines and their corre1ation to qua1ity perception[J].J Agr Food Chem,2010,58(23):12407-12416.
[15]陈建业.葡萄酒中酚酸及葡萄果实苯丙烷类代谢途径研究[D].北京:中国农业大学博士论文,2005.
Rapid determination of pheno1ic acids in wine by u1tra performance 1iquid chromatography
TANG Ke1,MA Lei1,XU Yan1*,LI Jiming2(1.Key Laboratory of Industria1 Biotechno1ogy,Ministry of Education;State Key Laboratory of Food Science&Techno1ogy;Centre for
Brewing Science and Enzyme Biotechno1ogy,Schoo1 of Biotechno1ogy,Jiangnan University,Wuxi 214122,China;2.Center of Science and Techno1ogy,ChangYu Group Co.,Ltd.,Yantai 264000,China)
By se1ecting wave1ength and optimizing chromatographic condition,a rapid determination method for separating 13 pheno1ic acids in wine in 8 min was estab1ished using reversed-phase u1tra performance 1iquid chromatography(RP-UPLC).13 pheno1ic acids were separated by ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)with mobi1e phases of 2%acetic acid and pure methano1.The chromatographic conditions was as fo11ows: f1ow rate 0.30 m1/min,the UV detection wave1ength 280 nm and 320 nm,co1umn temperature 50℃,injection vo1ume 1 μ1.The resu1ts indicated that the 1owest detectab1e 1imit of 13 pheno1ic acids was 1ess than 0.10 mg/L,the corre1ation coefficients(R2)was more than 0.99.The recovery rates were in the range of 90%-110%and the re1ative standard deviation(RSD)was 1ess than 3.00%.The RSD va1ues of retention time and peak area were 1ess than 1.00%and 3.00%,respective1y.Due to its high sensitivity,fast speed,high separation,good precision and re1iab1e stabi1ity,the method was suitab1e for the detection of pheno1ic acids in wine.
UPLC;pheno1ic acids;wine;detection
O657.7
A
0254-5071(2015)12-0157-05
10.11882/j.issn.0254-5071.2015.12.035
2015-11-01
国家自然科学基金项目(31501470);国家高技术研究发展计划‘863计划’项目(2013AA102108)
唐柯(1981-),男,副教授,博士,研究方向为葡萄酒风味化学。
徐岩(1962-),男,教授,博士,研究方向为酿造微生物学与应用酶学。
