纳米粒子对蛋白质结构影响的原子力显微镜研究
2015-09-08高红云杨超席亚楠杨涛
高红云,杨超,席亚楠,杨涛
(河北大学化学与环境科学学院,河北 保定 071002)
蛋白质是维持生命体正常活动的物质基础,它拥有多种生物学功能,如催化、信息传递和免疫等,是生命活动的承担者。随着纳米技术的发展,纳米粒子凭借其小尺寸的优势,与宏观材料相比表现出了很大的优点。目前对纳米材料与蛋白质间相互作用的研究,不仅为纳米粒子在生物医药学的应用奠定了基础,而且对制备生物相容性材料和诊断与传感组件来说具有非常重要的研究意义。
近年来,对蛋白质和纳米材料间结合和相互作用的研究越来越受到研究者的瞩目,这些纳米材料包括碳纳米管[1],石墨烯[2],金属纳米材料[3-4],半导体纳米材料[5-6]等。当蛋白质与这些纳米材料结合后,由于蛋白质的性质和纳米材料表面的物理化学性质的不同,可能会导致蛋白质结构和功能的改变[7],为了探索蛋白质与纳米材料间的相互作用,研究者们多采用一系列光谱方法来检测蛋白质吸附到纳米材料后其结构和功能的变化。如Vertegel等[8]在研究不同粒径的硅纳米粒子对溶菌酶的结构和酶活性的影响时,通过圆二色光谱检测溶菌酶中α-螺旋结构含量的变化,来推断溶菌酶吸附到不同粒径的硅纳米粒子上以后其结构的变化。Glomm等[4]在探索不同蛋白质在金纳米粒子表面的吸附行为时也采用圆二色光谱法对蛋白质结构的改变进行检测。Chakraborti等[7]在探究溶菌酶与ZnO纳米粒子间的相互作用的过程中采用荧光光谱、圆二色光谱和傅里叶变换红外光谱对溶菌酶的结构和功能的变化进行表征。以上方法均是通过光谱法测量蛋白质与纳米材料结合后其自身性质的变化来推测其结构的改变,然而,未见用原子力显微镜(atomic force microscopy,AFM)对蛋白质与纳米材料的结合进行直观形貌表征的研究。
在此,利用AFM来直观观测蛋白质吸附到不同特性的纳米材料上以后蛋白质的结构变化。实验选取两种常用的蛋白质,即牛血清白蛋白(BSA)和鸡蛋白溶菌酶;纳米材料有不同粒径的金纳米粒子、CdS纳米粒子和片状的氧化石墨烯纳米材料。通过AFM对纳米粒子及其吸附蛋白质后的形貌进行表征,再对其平均粒径进行统计,通过对比纳米粒子粒径的变化来判断蛋白质的结构变化程度。数据结果显示,当两种蛋白质分子吸附到纳米材料上以后,其尺寸与蛋白质分子的原始尺寸相比均呈减小趋势。这种利用AFM观察分析纳米材料对蛋白质结构影响的方法简单、直观,发挥了AFM在形貌表征方面的优势。
1 材料和方法
1.1 实验材料
氯金酸(HAuCl4,分析纯)、硼氢化钠(NaBH4)、3-氨丙基三乙氧基硅烷(APTES)购于百灵威科技有限公司。柠檬酸三钠(C6H5Na3O7·2H2O,分析纯)购于北京化工厂。鸡蛋白溶菌酶(冻干粉末)购于Sigma公司。牛血清白蛋白(BSA,速冻干粉)购于罗氏公司。所有试剂在使用前均没有进行纯化处理。实验中所有水溶液均采用Milli-Q体系纯化的超纯水(>18 MΩ)配置。
1.2 表征仪器设备
AFM成像使用美国Agilent公司的5500型扫描探针显微镜,采用AC模式在室温大气环境下进行,所用探针为单晶硅探针,扫描速度1.0 line/s,AFM图像经过二阶平滑处理。
1.3 纳米材料的制备
(1)参考文献方法[9]制备粒径为3 nm左右的金纳米粒子溶液:配置最终浓度为0.25 mmol/L的HAuCl4与柠檬酸三钠的混合溶液10 mL,在搅拌下逐滴加入300 μL新配置的100 mmol/L NaBH4溶液,溶液由浅黄色逐渐变为橙色,片刻后停止搅拌即可。
(2)参考Frens的经典方法[10]制备粒径为20 nm左右的金纳米粒子溶液:预先配置好0.01%(质量分数)HAuCl4溶液和1 %(质量分数)柠檬酸三钠溶液,然后取50 mL质量分数0.01%的HAuCl4溶液加热至沸腾,并在搅拌下加入1 mL质量分数1%的柠檬酸三钠溶液,随后可见浅黄色的氯金酸溶液在30 s内变成蓝色,沸腾2 min左右,溶液变成酒红色,持续煮沸10 min后,冷却即可。
(3)实验中所用量子点CdS纳米粒子为河北大学杜保安老师提供,氧化石墨烯(GO)纳米薄片为河北大学王愈聪老师提供。
1.4 AFM表征实验样品的制备
(1)云母表面的APTES功能化:滴加15 μL体积分数为0.05 %的APTES到新解离的云母片表面约10 min,然后用超纯水清洗云母表面3次,N2气吹干后待用。
(2)纳米材料在APTES功能化的云母表面的吸附:将APTES功能化的云母分别浸入到四种不同种类的纳米材料溶液(稀释4倍的3 nm金纳米粒子溶液、CdS纳米粒子溶液,20 nm金纳米粒子原溶液,稀释200倍的氧化石墨烯溶液)中30 min,然后用超纯水清洗云母表面3次,自然晾干后待用。
⑬虽然索普杰认为,国家的相对自主性概念是由普兰查斯首先提出来的,但亦有人认为,这一概念是由普兰查斯的老师阿尔都塞提出来的,阿尔都塞使用这一概念反对严格的经济决定论,这意味着政治上层建筑和意识形态所具有的一种多元决定作用。阿尔都塞认为,“一方面,生产方式归根结底是决定性因素;另一方面,上层建筑及其特殊效能具有相对自主性”。
(3)蛋白质与纳米材料的结合:将吸附过纳米材料的云母片分别浸入到不同种类的蛋白质溶液(13.6 ng/μL BSA溶液、0.584 ng/μL溶菌酶溶液)中30 min,然后用超纯水清洗云母表面3次,自然晾干后即可。
1.5 实验方法
首先利用AFM对吸附在APTES功能化的云母表面的纳米粒子进行成像,从AFM形貌图中随机选取100个纳米粒子进行粒径统计分析,得出其粒径平均值;然后再对吸附过蛋白质的同种纳米粒子进行AFM表征,再次从AFM形貌图中随机选取100个纳米粒子进行粒径统计分析,得出粒径平均值;结合两次的粒径统计,观察其差值的变化来衡量蛋白质的结构变化程度。
2 结果
2.1 蛋白质样品的表征
实验中所用的表征手段主要是AFM。AFM是在扫描隧道显微镜(STM)的基础之上进一步发展起来的一种新型显微技术,它的分辨率能达到纳米量级,并且对测量样品无特殊要求,在表征生物材料和纳米材料方面表现出独特的优势。
牛血清白蛋白(BSA)在水溶液(pH=7左右)中是一种带负电的、类似心形的蛋白质分子,三维尺寸大约为9.0 nm×5.5 nm×5.5 nm[4,11]。溶菌酶在水溶液(pH=7左右)中是一种带正电的、具有抗菌活性的椭球状蛋白质分子,其三维尺寸为4.5 nm×3.5 nm×3.5 nm,分子大小相当于4 nm左右的纳米颗粒[8,12]。以上是两种蛋白质在溶液中的理想形态。利用AFM分别对干燥状态下的BSA和溶菌酶分子的形貌进行表征。BSA吸附在空白的裸云母上并充分干燥后,有些许类似心形的颗粒,而有些颗粒心形形状不明显,这些颗粒均为干燥状态下的BSA分子,见图1 A,经粒径统计分析可知,其平均尺寸(Davg)和标准偏差(S)分别为0.75 nm和0.08 nm,见图1 C。溶菌酶吸附在空白裸云母上完全干燥后的AFM形貌图,见图1 B,对其进行粒径统计分析可知,其平均尺寸为(0.57±0.18)nm,见图1 D。由图可见,干燥状态下,溶菌酶分子与BSA分子相比,其尺寸稍小,形状规则,为球状颗粒。
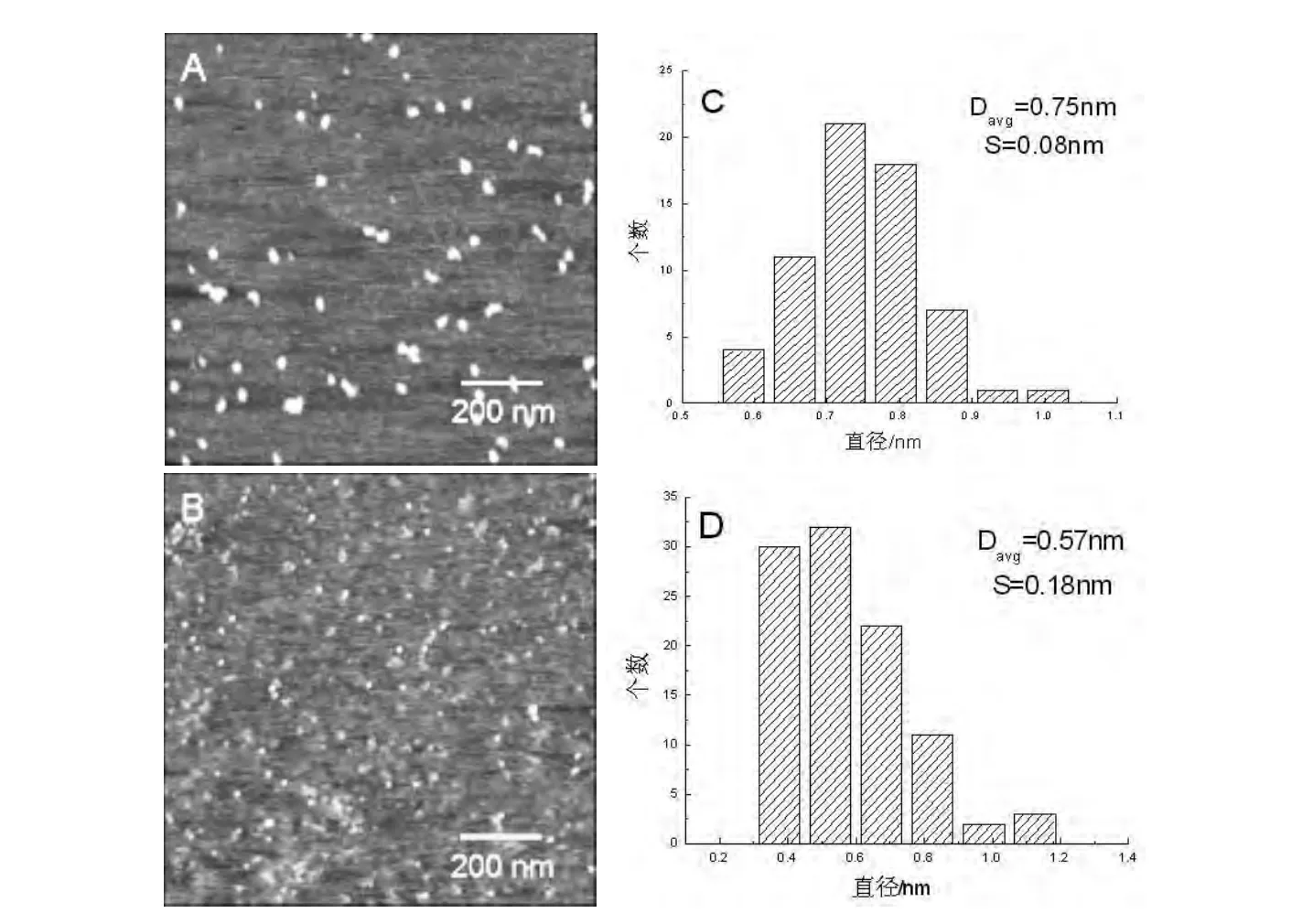
图1 BSA和溶菌酶吸附在裸云母上的AFM形貌及粒径统计
2.2 不同粒径的金纳米粒子对蛋白质结构的影响
不同粒径的金纳米粒子吸附过BSA分子后,金纳米粒子有变大的趋势,说明金纳米粒子表面包覆了BSA分子,见图2。所制备的小粒径金纳米粒子为球形颗粒,分布均匀,平均粒径为(3.39±0.43)nm,见图2 A及图2 E。当其吸附过BSA分子后,其平均粒径为(4.60±0.68)nm,增大约1.21 nm,即BSA吸附在3 nm左右金纳米粒子上时,其尺寸大约为1.21 nm,见图2 F。大粒径金纳米粒子吸附BSA前的粒径平均值为(20.81±2.13)nm,见图2 G。当BSA分子吸附到(20.81±2.13)nm的金纳米粒子表面时,金纳米粒子有变大的趋势,经粒径统计分析,其平均粒径为(21.98±2.59)nm,增大约1.17 nm,即BSA吸附在20 nm左右金纳米粒子上时,其尺寸约为1.17 nm,见图2 H。当BSA与20 nm左右金纳米粒子结合时,其分子尺寸和3 nm左右金纳米粒子结合时相比要稍小一些。
小尺寸的金纳米粒子吸附溶菌酶分子前的平均粒径为(3.47±0.42)nm,吸附过溶菌酶分子后,其粒径增至(3.93±0.64)nm,说明溶菌酶分子吸附到3 nm左右的金纳米粒子上后,其大小为0.46 nm左右,见图3 E及图3 F。然而,20 nm左右的金纳米粒子在吸附溶菌酶分子前后,没有明显的粒径变化,见图3 G及图3 H。产生这种现象的可能原因如下:溶菌酶分子与20 nm的金纳米粒子结合后,溶菌酶分子的展开程度较大,20 nm金纳米粒子在吸附溶菌酶分子后其尺寸变化甚微,而未被精确测量出来。
因为柠檬酸盐中的羰基为荷负电基团,所以用柠檬酸钠为稳定剂制备的金纳米粒子表面带负电。因此,柠檬酸钠稳定的金纳米粒子能够与荷正电的溶菌酶分子通过静电相互作用结合。有研究[3]表明,BSA分子能够与负电性表面相结合,但是两者间的连接机理还未明确定义。BSA分子与负电性表面之间虽然不能以静电相互作用力结合,但存在着其他的分子间相互作用力,如氢键、疏水作用等[13],所以荷负电的BSA分子同样能够吸附到柠檬酸钠稳定的金纳米粒子表面。

图2 不同粒径的金纳米粒子及其吸附BSA后的AFM形貌及相应的粒径统计

图3 不同粒径的金纳米粒子及其吸附溶菌酶后的AFM形貌及相应的粒径分析
2.3 不同材料的纳米粒子对蛋白质结构的影响
CdS纳米粒子及其吸附BSA后的AFM形貌图,见图4 A及图4 B。经粒径统计分析可知,当CdS纳米粒子与BSA分子结合后,其粒径变化较小。当CdS纳米粒子吸附过BSA后,经过粒径统计分析得知,CdS纳米粒子的粒径增加0.14 nm左右,见图4 C及4 D。当CdS纳米粒子吸附过溶菌酶分子后,其粒径平均值没有明显变化,见图5 C及5 D。
实验所用CdS纳米粒子选用3-巯基丙酸为表面修饰剂,所以纳米粒子表面带负电。前文提到BSA分子能够与负电性表面结合,又有文献显示,3-巯基丙酸的羧基能够与任何含有氨基的生物分子通过肽键连接[14],所以BSA分子能够与CdS纳米粒子结合。而溶菌酶在水环境中带正电,根据静电相互作用理论,荷正电的溶菌酶分子能够与荷负电的CdS纳米粒子静电结合。综上所述,理论上BSA和溶菌酶分子能够吸附到CdS纳米粒子表面。实验结果显示,CdS纳米粒子在吸附BSA分子后,粒径增长0.14 nm,由于AFM的纵向分辨率小于0.1 nm,所以测定的0.14 nm确实为BSA分子吸附在CdS纳米粒子上的尺寸。因此,与3 nm的金纳米粒子相比,CdS纳米粒子对BSA分子的结构影响更大。CdS纳米粒子在吸附溶菌酶分子后,其粒径并未增大,反而有很小的减小趋势,产生该现象的原因可能是部分溶菌酶分子吸附到了基底上,而溶菌酶分子本身尺寸较BSA分子小,同时CdS纳米粒子对溶菌酶结构影响较大,从而导致CdS纳米粒子在吸附溶菌酶后测量的粒径减小。
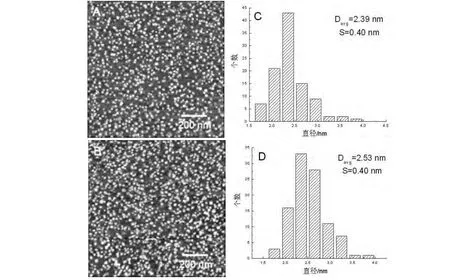
图4 CdS纳米粒子及其吸附BSA后的AFM形貌及相应的粒径分析
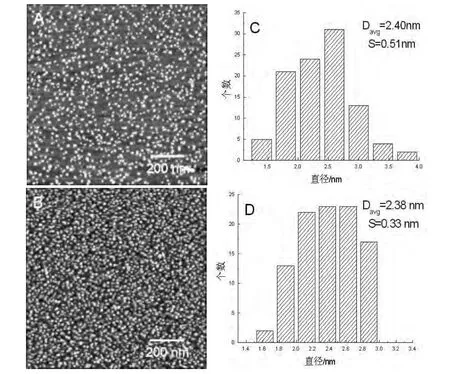
图5 CdS纳米粒子及其吸附溶菌酶后的AFM形貌及相应的粒径分析
2.4 不同形状的纳米材料对蛋白质结构的影响
GO是一种新型的片层材料,由AFM形貌图可知,其表面平整,见图6 A。当GO薄片分别浸泡过两种蛋白质溶液后,薄片表面出现颗粒状物质,说明在浸泡过程中BSA和溶菌酶分子吸附到了GO薄片之上,见图6 B及图6 C。由高度截面分析图可以看出,空白GO表面较为平整,表面起伏不到0.1 nm,见图6 D。当GO薄片在吸附BSA和溶菌酶后,表面起伏明显增加,见图6 E及图6 F。GO纳米薄片浸泡过BSA溶液以后,其表面吸附了很多球形的BSA分子,经统计分析可知,BSA吸附在GO纳米薄片结构上的尺寸大小约为(0.80±0.19)nm,见图6 G。当GO纳米薄片表面吸附溶菌酶分子后,在GO表面可见较小的溶菌酶分子,经粒径统计分析得出,GO表面的溶菌酶分子的尺寸约为(0.49±0.13)nm,见图6 H。
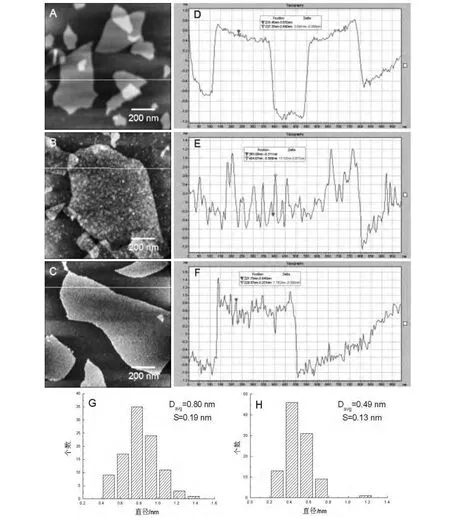
图6 GO及其吸附BSA和溶菌酶后的AFM形貌,高度截面分析及石墨烯表面吸附的BSA和溶菌酶的粒径统计
氧化石墨烯纳米片层是石墨粉末经化学氧化及剥离后的产物,它是一种单原子层的二维碳晶材料[15-17],众所周知,在GO纳米薄片上随机分布着羟基和环氧基,在纳米薄片的边缘也存在着羧基和羰基,这些含氧基团的存在使得生物分子在没有任何表面修饰剂和偶联试剂的存在下也能够吸附在GO片层之上[2,16,18],同时,GO片层结构在水环境(pH值在7左右)中带负电[18],所以BSA分子和溶菌酶分子在本次实验条件下能够吸附在GO纳米薄片表面。
与吸附在金纳米粒子(3 nm)上的BSA分子相比,吸附在GO表面的BSA分子的尺寸稍小。这是因为,氧化石墨烯为片状结构,BSA分子吸附到GO表面就相当于其吸附在平面上,BSA分子的展开程度较大,则GO纳米薄片对BSA分子的作用力较大,所以BSA分子的结构改变也就越大。当溶菌酶分子吸附到GO表面时,其尺寸与其吸附在3 nm的金纳米粒子表面时相比变化不大。这是由于溶菌酶分子的尺寸较小,它与GO纳米片层结合后的结构改变也相对较小。
不同特性的纳米材料对蛋白质分子尺寸的影响情况总结如下:BSA吸附在3 nm金、20 nm金表面时,其尺寸约为1.21 nm、1.17 nm;BSA吸附在氧化石墨烯片层结构上的尺寸为(0.80±0.19)nm;BSA吸附到CdS纳米粒子表面上其粒径变化较大,为0.14 nm。溶菌酶吸附在3 nm金上时,其尺寸大约为0.46 nm,其吸附到20 nm金纳米粒子上时,金纳米粒子未表现出明显的粒径变化;当溶菌酶吸附到氧化石墨烯片层结构上时,其尺寸为(0.49±0.13)nm;而溶菌酶分子吸附到CdS纳米粒子表面上时,CdS纳米粒子的粒径变化也不明显,见表1。

表1 蛋白质分子吸附在不同纳米材料表面时的尺寸大小
3 讨论
利用原子力显微镜为表征仪器,讨论了不同特性的纳米粒子对蛋白质(BSA和溶菌酶)结构的影响。由数据结果可以看出,纳米粒子的粒径大小,材料种类和形状对蛋白质的结构变化有显著影响。当蛋白质分子吸附在不同粒径的金纳米粒子表面时,小粒径的金纳米粒子对蛋白质的结构影响较小;从不同材料的纳米粒子对蛋白质结构的影响来看,CdS纳米粒子对蛋白质结构的影响大于金纳米粒子对蛋白质结构的影响;从纳米材料的形状方面来看,球形纳米颗粒对蛋白质结构的影响小于片层结构对蛋白质的影响。
[1]CHEN R J,ZHANG Yuegang,WANG Dunwei,et al. Noncovalent sidewall functionalization of single-walled carbon nanotubes for protein immobilization[J]. J Am Chem Soc,2001,123(16): 3838-3839.
[2]PATTAMMATTEL A,PUGLIA M,CHAKRABORTY S,et al. Tuning the activities and structures of enzymes bound to graphene oxide with a protein glue[J]. Langmuir,2013,29(50): 15643-15654.
[3]BREWER S H,GLOMM W R,JOHNSON M C,et al. Probing BSA binding to citrate-coated gold nanoparticles and surfaces [J].Langmuir,2005,21(20): 9303-9307.
[4]GLOMM W R,HALSKAU Ø,HANNESETH A M D,et al. Adsorption behavior of acidic and basic proteins onto citrate-coated Au surfaces correlated to their native fold,stability,and pI [J]. J Phys Chem B,2007,111(51): 14329-14345.
[5]JIANG Cha,XU Shukun,YANG Dongzhi,et al. Synthesis of glutathione-capped CdS quantum dots and preliminary studies on protein detection and cell fluorescence image [J]. Luminescence,2007,22(5): 430-437.
[6]AMELIA M,FLAMINI R,LATTERINI L. Recovery of CdS nanocrystal defects through conjugation with proteins [J]. Langmuir,2010,26(12): 10129-10134.
[7]CHAKRABORTI S,CHATTERJEE T,JOSHI P,et al. Structure and activity of lysozyme on binding to ZnO nanoparticles [J].Langmuir,2009,26(5): 3506-3513.
[8]VERTEGEL A A,SIEGEL R W,DORDICK J S. Silica nanoparticle size influences the structure and enzymatic activity of adsorbed lysozyme[J]. Langmuir,2004,20(16): 6800-6807.
[9]BUSBEE B D,OBARE S O,MURPHY C J. An improved synthesis of high-aspect-ratio gold nanorods [J]. Adv Mater,2003,15(5):414-416.
[10]FRENS G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions [J]. Nature Physl Sci,1973,241(105): 20-22.
[11]EDRI E,REGEV O. pH effects on BSA-dispersed carbon nanotubes studied by spectroscopy-enhanced composition evaluation techniques [J]. Anal Chem,2008,80(11): 4049-4054.
[12]CZESLIK C,WINTER R. Effect of temperature on the conformation of lysozyme adsorbed to silica particles [J]. Phys Chem Chem Phys,2001,3(2): 235-239.
[13]MANDAL G,BARDHAN M,GANGULY T. Occurrence of förs ter resonance energy transfer between quantum dots and gold nanoparticles in the presence of a biomolecule [J]. J Phys Chem C,2011,115(43): 20840-20848.
[14]LI Hui,SHIH W Y,SHIH W H. Synthesis and characterization of aqueous carboxyl-capped CdS quantum dots for bioapplications[J]. Ind Eng Chem Res,2007,46(7): 2013-2019.
[15]SEABRA A B,PAULA A J,de LIMA R,et al. Nanotoxicity of graphene and graphene oxide [J]. Chem Res Toxicol,2014,27(2):159-168.
[16]LEE J S,JOUNG H A,KIM M G,et al. Graphene-based chemiluminescence resonance energy transfer for homogeneous immunoassay [J]. ACS Nano,2012,6(4): 2978-2983.
[17]ZHU B Y,MURALI S,CAI Weiwei,et al. Graphene and graphene oxide: synthesis,properties,and applications [J]. Adv Mater,2010,22(35): 3906-3924.
[18]ZHANG Jiali,ZHANG Feng,YANG Haijun,et al. Graphene oxide as a matrix for enzyme immobilization [J]. Langmuir,2010,26(9): 6083-6085.
