EP14-A3文件在试剂内源性抗体干扰研究中的应用
2015-09-05刘君君
张 娟,韦 清,刘君君
(深圳迈瑞生物医疗电子股份有限公司,广东深圳518057)
免疫分析法以其高灵敏度和特异度在临床检测中得到广泛的应用。然而,这项以抗原-抗体反应作为基本原理的技术,必然会受到内源抗体干扰影响[1]。据报道,内源性抗体干扰发生率为1%~40%,甚至更多(与受检人群及检测技术有关)[2-4]。随着干扰阻断剂技术的应用,干扰发生率降至2%以下[3,5]。干扰可导致检测结果的假性升高或降低,甚至假阳性或漏检,影响临床医生对疾病的诊断及病情评估,可能给患者带来不必要的检查和错误用药[6],还可能贻误病情使其错过最佳治疗时期。内源性干扰抗体一般包括:嗜异性抗体,如类风湿因子(RF)、抗核抗体(ANA);人抗动物抗体,如人抗鼠抗体HAMA;自身免 疫 性 抗 体,如 抗 甲 状 腺 素 抗 体(anti-Tg)[1,7]。其中,嗜异性抗体特异性低、能与多种物种抗体结合,是内源性抗体干扰中最常见的一类;人抗动物抗体和自身免疫性抗体因其抗体高度特异性,对结果造成的干扰程度则分别与检测试剂盒采用何种动物的抗体及项目特异性有关。自20世纪70年代发现免疫干扰后,一系列检测和消除干扰抗体的方法(稀释后是否线性、更换检测方法、抗体中和、干扰抗体移除、添加阻断剂等)应运而生[1,7-8]。这些方法并不能完全避免干扰,均为结果出现异常后对样品的一种事后回溯手段[1],而且针对的往往是单个样品的研究,缺少临床多个样品的比较。本文运用EP14-A3[9]中描述的方法,选用市场上广泛应用、口碑较好的厂商试剂作为参比系统,以化学发光免疫方法和内源性抗体RF干扰为例,从试剂盒自身抗干扰能力角度出发,提供一种综合评估试剂盒抗干扰能力的方法,为临床和试剂研发中评估抗内源性抗体干扰能力提供一种新思路。
1 材料与方法
1.1 仪器与试剂 仪器:迈瑞CL-2000i全自动化学发光免疫分析仪,罗氏Cobas e411全自动化学发光免疫分析仪,贝克曼ACCESSⅡ全自动化学发光免疫分析仪。试剂:在研试剂盒A(化学发光免疫分析法)及配套校准、质控品;参比试剂为罗氏硫酸脱氢表雄甾酮(DHEA-S)检测试剂盒(电化学发光法)及配套校准品;在研试剂盒B(化学发光免疫分析法)及配套校准、质控品;参比试剂为贝克曼甲状腺球蛋白(Tg)测定试剂盒(化学发光法)及配套校准品。试剂主要成分和原理见表1。

表1 试剂盒基本信息

续表1 试剂盒基本信息
1.2 方法
1.2.1 样品准备 35份正常血清样品,12份不同浓度的RF血清样品,正常血清样品的DHEA-S和Tg浓度尽量覆盖RF血清样品所含的DHEA-S和Tg浓度。
1.2.2 测试 测试前通过质控测定确保系统稳定。按试剂盒说明书进行准备,将RF 干扰样品随机穿插在正常血清样品中,将样品先用待评估试剂在迈瑞CL-2000i全自动化学发光免疫分析仪上测2 次,再用参比试剂分别在对应仪器上测2次。分别记录测试结果。
1.3 统计学处理 按EP9-A3方法[10]对重复测定结果离群点进行剔除,以对比系统测值的均值为横坐标,待评价系统测值的均值为纵坐标,绘制散点图,用JMP9.0软件判断是否适合线性回归。若呈线性,则以的均值为横坐标,以为纵坐标,绘制散点图,观察散点的分散度是否随横坐标浓度值的递增而递增(呈喇叭状)。若递增,则需将分别转换成和,绘制新散点图。运用MedCalc软件对正常样品散点图进行戴明回归分析,得到斜率和截距根据拟合的戴明回归曲线,对已给定的值可以计算出一个预期的值,按公式计算的95%置信区间,式中:γ 为Ⅰ型错误发生概率(一般为0.05),n 为 样本量;NH为测试 重复 次数为戴明 回归线的标 准差[9]。最 后,以为横坐标,为纵坐标绘制散点图,将散点分别连线后即得到正常样品单值95%置信区间的上下限曲线。
2 结 果
2.1 戴明回归分析前数据处理 运用JMP9.0 软件对DHEA-S和Tg正常样品散点分别进行二次、一次方回归分析,见表2、3,只有一次项系数与0 差异有统计学意义(P<0.05),因此按线性模型回归。以的均值为横坐标,以为纵坐标,分别对DHEA-S和Tg正常样品绘制散点图,见图1、2(见《国际检验医学杂志》网站主页“论文附件”),散点的分散度没有随横坐标浓度值的递增而递增,因此均无需进行对数转换。
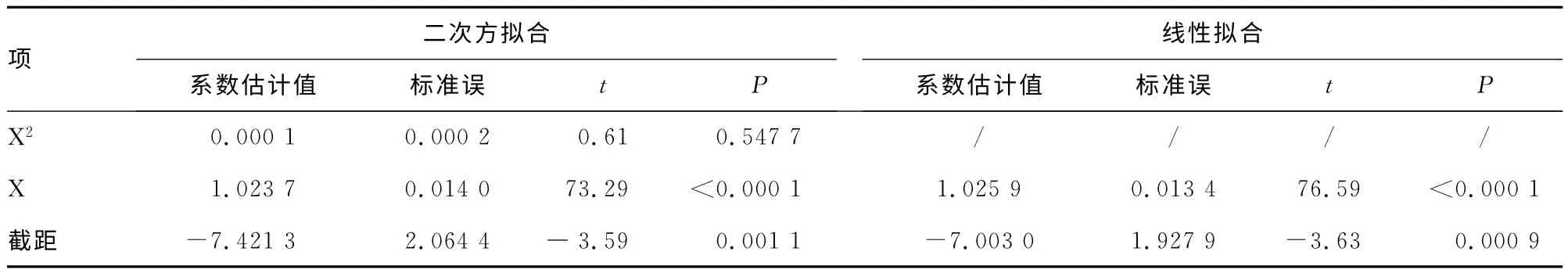
表2 JMP9.0对DHEA-S正常样本回归系数的分析(n=35)
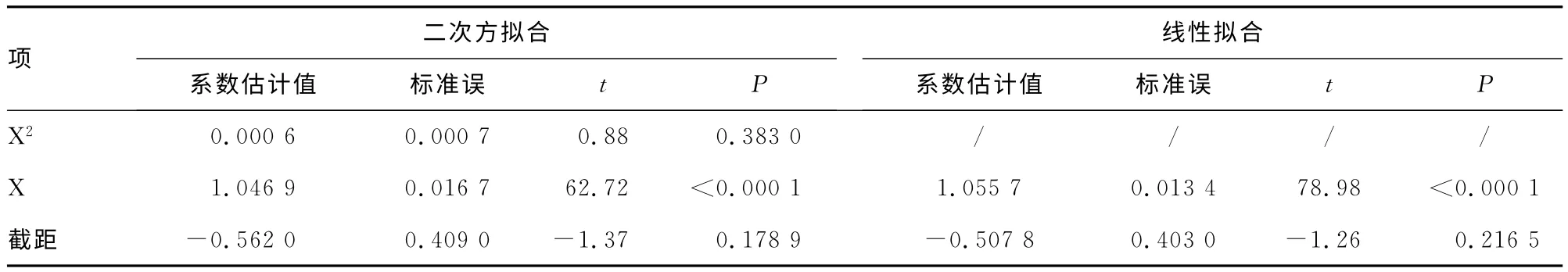
表3 JMP9.0对Tg正常样本回归系数的分析(n=35)
2.2 戴明回归和干扰判断 对正常样品散点图进行戴明回归分析,得到斜率和截距。根据拟合的戴明回归结果,绘制正常样品单值95%置信区间上下限曲线如图3、4(见《国际检验医学杂志》网站主页“论文附件”)中虚线所示。在图3中,RF 样品已超出95%置信区间上限,说明在研试剂A 抗RF 干扰能力较弱,在RF样品识别上与参比试剂存在明显差异性。图4中,RF样品与正常样品聚合较好,RF样品均处于95%置信区间以内,说明在研试剂B与参比试剂抗RF干扰能力相当。
3 讨 论
本文运用EP14-A3方法评估了两种化学发光试剂盒的抗内源性抗体干扰能力。结果显示,RF对在研试剂A 整体表现为正干扰,对在研试剂B的干扰不明显。RF是一类易与变性IgG 的Fc段非特异结合的自身抗体,不具种属特异性[7],以上评价结果从试剂开发原理上分析,在研试剂A 采用竞争法二抗体系且二抗为多克隆兔抗,多克隆兔抗含有的多种IgG Fc段易与RF结合,而使标记抗原不能与捕获抗体相连,导致发光值假性降低,测值偏高,表现为明显的正干扰。而RF 对在研试剂B干扰不明显可能与试剂B 所用抗体为单克隆抗体、RF结合位点少,且试剂抗干扰配方优化较好有关。
从图3、4标出的RF浓度可知,干扰物的浓度与干扰程度并不呈正比,该结论与陈金超等[11]的报道一致。由于RF有多种类型(如IgM、IgG 及IgA),浓度相同但种类不同的RF对检测的干扰程度可能并不相同[12]。此外,血清成分复杂,低浓度的RF干扰样品中可能还存在其他未知干扰物(如其他干扰抗体、代谢物、药物等)。因此,仅以少数几份样品得到的结果往往相互矛盾,不足以评价干扰,评估抗体干扰应建立在一定统计量的基础上。
EP14-A3是用于评价处理样品与血清样品基质效应的指导性文件。内源性抗体干扰导致的结果就是基质差异。本文探讨了EP14-A3方法应用于内源性抗体干扰评估中的可操作性。这种方法侧重于临床多样本研究,在一定统计量基础上评估了试剂RF干扰的风险,可作为一种简便、直观的试剂配方筛选补充手段,一定程度上对国内试剂研发中配方筛选和体系优化提出更高要求,为在研试剂完善提供方向和目标,同时也为临床医院选取和评估待引进试剂提供了科学建议。该方法以参考方法为标准,使用也有前提:(1)方法学比对指标优良;(2)对比系统或参考方法的抗干扰能力临床认可度高。若能满足上述条件,EP14-A3 是科学、直观的内源性抗体干扰评估方法。
[1]Emerson JF,Lai KKY.Endogenous antibody interferences in immunoassays[J].Lab Med,2013,44(1):69-73.
[2]Boscato LM,Stuart MC.Incidence and specificity of interference in two-site immunoassays[J].Clin Chem,1986,32(8):1491-1495.
[3]Ward G,Mckinnon L,Badrick T,et al.Heterophilic antibodies remain a problem for the immunoassay laboratory[J].Am J Clin Pathol,1997,108(4):417-421.
[4]Bjerner J,Nustad K,Norum LF,et al.Immunometric assay interference:incidence and prevention[J].Clin Chem,2002,48(4):613-621.
[5]Levinson SS,Miller JJ.Towards a better understanding of heterophile(and the like)antibody interference with modern immunoassays[J].Clin Chim Acta,2002,325(1/2):1-15.
[6]Olsen TG,Hubert PR,Nycum LR.Falsely elevated human chorionic gonadotropin leading to unnecessary therapy[J].Obstet Gynecol,2001,98(5Pt 1):843-845.
[7]Clinical and Laboratory Standards Institute.LA30-A Immunoassay interference by endogenous antibodies:approved guideline[S].Wayne,PA,USA:CLSI,2008.
[8]Schiettecatte J,Anckaert E,Smitz J.Interferences in immunoassays[M].Rijeka:In Tech,2012:45-62.
[9]Clinical and Laboratory Standards Institute.EP14-A3Evaluation of commutability of processed sample[S].Wayne,PA,USA:CLSI,2014.
[10]Clinical and Laboratory Standards Institute.EP9-A3 Measurement procedure comparison and bias estimation using patient samples[S].Wayne,PA,USA:CLSI,2013.
[11]陈金超,刘涤瑕,王丽,等.免疫学检测方法中的干扰因素和对策[J].现代中西医结合杂志,2009,18(21):2575-2576.
[12]郭兰英,万卷芳.类风湿因子对乙肝酶免试剂的干扰及处理方法[J].河南医科大学学报,2000,35(6):559-560.
