创伤后多器官功能障碍综合征患者外周血髓源抑制细胞细胞的表达
2015-09-05梁颖红龚艳杰张宜花
刘 佳,魏 明,涂 玲,梁颖红,龚艳杰,张宜花
(郑州大学第五附属医院输血科,河南郑州450052)
创伤是临床常见的危重症之一,特别是免疫/炎性反应的失控,促炎细胞因子的大量释放和抗炎反应过度强烈均可导致多器官功能障碍综合征(MODS)[1-3]。创伤后机体在出现全身炎症反应综合征(SIRS)的同时,常伴随免疫功能障碍,主要表现为T 淋巴细胞功能抑制,这是创伤患者发生继发感染和脓毒症的重要原因[4]。髓源抑制细胞(MDSCs)是一群具有共同特性的高度异质性细胞的总称,包括未成熟粒细胞、巨噬细胞、树突状细胞和髓系祖细胞等。其共同特性为缺乏成熟髓系细胞标志,具有抑制T 淋巴细胞的功能[5]。MDSCs是免疫系统重要的调节性细胞,在维持机体免疫系统平衡中起重要作用,它的变化和功能异常与肿瘤免疫逃逸和自身免疫性疾病的发生密切相关[6-7]。脓毒症动物模型外周血、骨髓和脾脏中MDSCs数量明显增加,是脓毒症发生时T 细胞功能障碍和免疫抑制的关键性机制[8-9],创伤后MODS患者外周血中其水平的变化及临床意义鲜见报道。为此本研究对创伤后MODS患者外周血MDSCs(CD14-CD11b+CD33+细胞)的表达进行了检测,并对MDSCs的表达与细胞因子水平、创伤严重程度评分及患者预后的关系进行了分析,旨在进一步揭示MDSCs在创伤后MODS免疫抑制功能中的作用。
1 资料与方法
1.1 一般资料 选取2014年2月至2014年10月郑州大学第五附属医院重症医学科收治并诊断为MODS的66例患者作为MODS组,诊断符合1995年全国危重病急救医学学术会议制订的MODS 病情分期的诊断标准和严重程度评分标准[10]及SIRS和脓毒症诊断符合美国胸科医师协会/危重病医学会(ACCP/SCCM)制定的标准[11],剔除合并肿瘤、自身免疫性疾病等疾病的患者。其中男35 例、女31 例,年龄19~67岁,平均(41±12)岁。原发疾病包括胸部创伤20例,腹部实质脏器损伤18例,腹部空肠脏器损伤20 例,骨关节损伤8 例。选取同期于本院住院的非MODS患者78例(非MODS组),其中男44例、女34例,年龄18~68岁,平均(42±13)岁。另外选取,37例同期于本院进行健康体检者作为健康对照组,其中男21例、女16例,年龄20~69岁,平均(42±13)岁,均无近期感染、自身免疫性疾病等。各组间在年龄、性别构成方面进行比较,差异均无统计学意义(P>0.05),具有可比性。按照医院伦理委员会要求,所有参与研究者签署知情同意书。MODS病例随访至出院或死亡,以死亡或存活判定预后,最终死亡18例,生存22例。
1.2 仪器与试剂 主要检测仪器为美国BD 公司的FACS Canto流式细胞仪。试剂:人CD11b-FITC 抗体、CD14-PE 抗体、CD33-cy5抗体以及上述抗体相应的同型对照抗体均购自美国BD 公 司;白 细 胞 介 素-10(IL-10)和 肿 瘤 坏 死 因 子-α(TNF-α)检测试剂盒分别为法国Diaclone公司,郑州豫兴生物技术有限公司产品。
1.3 方法 MODS患者在入院后24h内进行MODS评分。MODS组于确诊当日,非MODS组于留院观察第1日抽取外周静脉血6mL,平均分为2份。3mL EDTA 抗凝血参照文献[4]用于CD14-CD11b+CD33+检测;另3 mL 非抗凝血以3 000r/min,离心10min后分离提取血清标本,置于-70 ℃超低温冰箱保存待测,血清用于IL-10和TNF-α浓度的测定。采用流式细胞术检测外周血MDSCs表达,流式细胞术参照文献[12]的方法进行。采集患者外周血(EDTA 抗凝)后混匀,取100μL 全 血,加 入CD11b-FITC 抗 体、CD14-PE 抗 体、CD33-Cy5抗体各2μL,冰上避光孵育30 min,PBS洗涤,红细胞裂解液裂解、洗涤、固定、重悬后,用流式细胞仪进行检测,BDFACSDiva软件分析数据。ELISA 检测外周血细胞因子水平,按照试剂盒说明书进行,检测血清IL-10和TNF-α水平。
1.6 统计学处理 采用SPSS13.0统计软件进行处理,计量资料以表示,两独立样本的比较,服从正态分布者用t或校正t(t′)检验,不服从正态分布者用Wilcoxon秩和检验。外周血CD14-CD11b+CD33+细胞表达率与疾病严重程度评分、血清IL-10、TNF-α水平的相关性分析采用Pearson相关分析。预后及影响因素分析采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 MODS患者血清IL-10和TNF-α水平变化 MODS组患者 血清IL-10[(55.65±8.67)pg/mL]、TNF-α[(60.23±34.14)ng/L]水平与 非MODS 组IL-10[(41.12±6.89)pg/mL]、TNF-α[(28.76±21.53)ng/mL]水平比较及与健康对照组IL-10[(30.04±5.72)pg/mL]、TNF-α[(20.87±10.64)ng/mL]水平比较,差异均有统计学意义(P<0.05);MODS组死亡患 者 血 清IL-10[(78.6023±15.74)pg/mL]和TNF-α[(89.72±38.91)ng/L]水平高于存活组患者IL-10[(40.45±8.41)pg/mL]和TNF-α[(63.64±24.23)ng/L]水平,差异均有统计学意义(P<0.05)。
2.2 MODS患者外周血CD14-CD11b+CD33+细胞的表达MODS组患者外周血CD14-CD11b+CD33+细胞表达百分率为(11.86±2.18)%,与非MODS组的(6.52±0.37)%和健康对照组的(1.18±0.22)%比较,差异均有统计学意义(P<0.05);MODS组死亡患者CD14-CD11b+CD33+细胞表达百分率为(15.66±1.68)%,高于存活组患者的(9.48±1.56)%,两者比较差异有统计学意义(P<0.05)。
2.3 MODS患者外周血CD14-CD11b+CD33+细胞表达与疾病严重程度评分、血清IL-10、TNF-α水平的相关性 MODS患者外周血CD14-CD11b+CD33+细胞表达百分率与TNF-α水平和MODS评分成正相关性(r分别为0.342 6、0.387 9,P<0.05),与IL-10水平无相关性(P>0.05)。
2.4 MODS患者外周血CD14-CD11b+CD33+细胞表达与衰竭器官个数关系 以MODS 患者的衰竭器官个数进行分组(分为Ⅰ、Ⅱ、Ⅲ组),各组外周血CD14-CD11b+CD33+细胞表达百分率均随衰竭器官个数增加而升高,各组间比较差异均有统计学意义(P<0.05),见表1。

表1 不同衰竭器官数患者外周血CD14-CD11b+CD33+细胞表达率
2.5 外周血CD14-CD11b+CD33+细胞表达与MODS预后的关系 采用Logistic 回归分析判断外周血CD14-CD11b+CD33+细胞表达与MODS患者预后的关系,结果显示CD14-CD11b+CD33+细胞表达的相对比值比(OR)为0.78,95%可信区间(CI)为0.72~0.91,P=0.04。
2.6 影响MODS患者外周血CD14-CD11b+CD33+细胞表达的因素 对影响MODS患者外周血CD14-CD11b+CD33+细胞表达因素的Logistic回归分析显示,严重创伤、严重感染和器官衰竭个数均是影响患者外周血CD14-CD11b+CD33+细胞表达的因素,见表2。
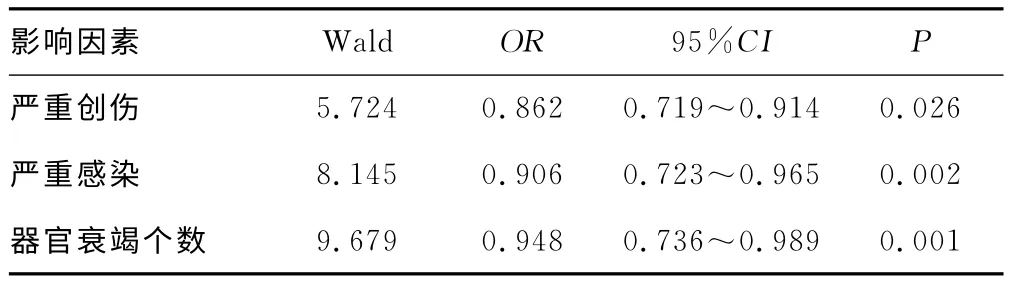
表2 影响MODS患者外周血CD14-CD11b+CD33+细胞表达的因素分析
3 讨 论
创伤、SIRS、MODS、多器官功能衰竭(MOF)、死亡作为创伤并发症的演变过程已达成共识[13]。创伤后并发症如感染、ARDS和MODS等的发生率及病死率居高不下,主要原因是上述并发症发展速度极快。特别是病情发展到MOF阶段,即使采取最及时的治疗措施都难以遏止其发展进程[14]。因此如能早期实施干预措施,对逆转并发症的演变和降低病死率都有重要意义。
创伤后机体常继发SIRS和脓毒症,出现免疫功能紊乱,表现为包括抗原呈递细胞(APC)和T 细胞等多种免疫细胞功能障碍,辅 助 性T 细 胞(Th)向Th2 方 向 分 化 等[15]。MDSCs是机体免疫系统重要的调节性细胞,在维持机体免疫系统平衡中起重要作用[5]。有文献报道,人类MDSCs表型各不相同,但迄今为止报道最多的MDSCs表型为CD14-CD11b+CD33+HLA-DR-[2]。为 此,笔 者 采 用CD14-CD11b+CD33+作 为MDSCs的标志,检测MODS患者外周血MDSCs的变化。本研究显示,MODS 组CD14-CD11b+CD33+细胞表达高于非MODS组和健康对照组(P<0.05),MODS死亡组患者外周血CD14-CD11b+CD33+表 达 高 于MODS 生 存 组 患 者(P <0.05)。经 相 关 分 析,MODS 评 分 与 MODS 患 者 外 周 血CD14-CD11b+CD33+细胞表达成正相关性(P<0.05),表明创伤后并发MODS的患者外周血CD14-CD11b+CD33+细胞表达明显增高,提示它们在创伤后免疫功能障碍中起重要作用。
TNF-α是各种细胞因子和炎性介质失控性释放前产生的关键性细胞因子,被认为是细胞因子爆发中心,能促进多种因子的释放[16]。IL-10是由多种细胞(主要以T 淋巴细胞)产生的炎症抑制因子,其作用是抑制炎症反应。IL-10可以通过抑制单核巨噬细胞的抗原递呈、细胞活化及继发的细胞免疫应答,抑制单核细胞本身的黏附作用及其介导的黏附反应,抑制活化的单核细胞分泌IL-1、IL-6、TNF-α等炎症促进因子,发挥其抑制炎症反应的作用[17]。本研究显示,MODS组血清TNFα、IL-10浓度明显高于非MODS组和健康对照组,MODS死亡组患者血清TNF-α、IL-10浓度高于MODS生存组患者(P<0.05)。经相关分析,TNF-α与MODS等疾病严重度评分值成正相关,提示血清TNF-α、IL-10水平可反映MODS患者的病情严重程度和预后。Logistic回归分析显示,严重创伤、严重感染和器官衰竭个数均是影响患者外周血CD14-CD11b+CD33+细胞表达的危险因素。
综上所述,创伤后并发MODS可导致外周血MDSCs、IL-10、TNF-α水平发生变化,其变化与MODS病情发展和患者预后密切相关,因此动态监测它们的变化对MODS的发生、发展及病情转归具有一定预警作用。临床在早期据此适度地应用相关抑制剂,阻止炎症介质的大量表达和释放,对于防止MODS的发生是一种新的治疗途径。
[1]沈其猷,李培,刘彪,等.创伤后MODS危险因素分析[J].中华创伤杂志,2007,23(7):531-534.
[2]魏明,付聿铭,张俊峰,等.创伤合并多器官功能障碍综合征患者血清LTB4和LPS的变化[J].中华创伤杂志,2010,26(4):331-333.
[3]魏明,涂玲,梁颖 红,等.p38MAPK 和COX-2mRNA 在 创伤后 多器官功能障碍综合征患者外周血中的表达[J].中华急诊医学杂志,2011,20(6):593-596.
[4]Annane D,Bellissant E,Cavaillon JM.Septic shock[J].Lancet,2005,365(9453):63-78
[5]Gabrilovich DI,Nagaraj S.Myeloid-derived suppressor cells as regulators of the immune system[J].Nat Rev Immunol,2009,9(3):162-174.
[6]Ostrand-Rosenberg S,Sinha P.Myeloid-derived suppressor cells:linking inflammation and Cancer[J].J Immunol,2009,182(8):4499-4506.
[7]Nagaraj S,Gabrilovich DI.Tumor escape mechanism governed by myeloid-derived suppressor cells[J].Cancer Res,2008,68(8):2561-2563.
[8]Makarenkova VP,Bansal V,Matta BM,et al.CD11b+/Gr-1+myeloid suppressor cells cause T cell dysfunction after traumatic stress[J].J Immunol,2006,176(4):2085-2094.
[9]Delano MJ,Scumpia PO,Weinstein JS,et al.MyD88-dependent expansion of an immature GR-1(+)CD11b(+)population induces T cell suppression and Th2polarization in sepsis[J].J Exp Med,2007,204(6):1463-1474.
[10]王今达,王宝恩.多器官功能障碍综合征(MODS)病情分期诊断及严重程度评分标准[J].中国危重病急救医学,1995,7(6):346-347.
[11]Anonymous.American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference:definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis[J].Crit Care Med,1992,20(6):864-874.
[12]Dellinger RP,Carlet JM,Masur H,et al.Surviving sepsis campaign guidelines for management of severe sepsis and septic shock[J].Crit Care Med,2004,30(4):536-555.
[13]Almand B,Clark JI,Nikitina E,et al.Increased production of immature myeloid cells in cancer patients:a mechanism of immunosuppression in cancer[J].J Immunol,2001,166(1):678-689.
[14]Simkova V,Baumgart K,Radermacher P,et al.Year in review 2006:Critical Care-ultiple organ failure,sepsis,and shock[J].Crit Care,2007,11(4):221.
[15]Nonaka K,Saio M,Suwa T,et al.Skewing the Th cell phenotype toward Th1alters the maturation of tumor-infiltrating mononuclear phagocytes[J].J Leukoc Biol,2008,84(3):679-688.
[16]Mizuno Y,Ohama E,Hirato J,et al.Nestin immunoreactivity of Purkinje cells in Creutzfeldt-Jakob disease[J].J Neurol Sci,2006,246(1/2):131-137.
[17]李冠兰,刘先哲.基质金属蛋白酶与MODS的研究进展.现代生物医学进展,2006,6:115-119.
