姜黄素对大鼠肝纤维化防治作用*
2015-09-03吴雄健朱海燕
吴雄健 朱海燕
(赣南医学院第一附属医院消化内科 赣州 341000)
肝纤维化是由多种原因所引起的慢性肝损害所致病理改变,是慢性肝病发展到肝硬化的必经阶段,主要表现为肝内细胞外间质成分过度异常地沉积,影响肝脏的功能[1]。姜黄素是一种酚类化合物,近年来研究发现其具有抗肝纤维化作用。但是,目前国内外学者关于姜黄素抗肝纤维化作用的研究多限在肝星状细胞水平观察姜黄素对一些细胞因子、核因子等的影响,在动物实验水平观察姜黄素防治肝纤维化作用及其机制的研究较少见。本文采用四氯化碳中毒诱导的大鼠肝纤维化模型,分析姜黄素的抗肝纤维化作用及其可能机制,现报告如下。
1 材料和方法
1.1 材料
雄性清洁级SD大鼠60只,体重120~160 g,由原第一军医大学动物研究所提供。
1.2 方法
1.2.1 分组造模
60只大鼠正常饲养1周后,随机分为A(正常组)、B(模型组)、C(高剂量姜黄素组)、D(中剂量姜黄素组)、E(低剂量姜黄素组)、F(阳性组)共6组,每组各10只。其中A组不予任何处理,其他5组大鼠给予恒量四氯化碳油溶液(天津市北宏试剂厂分析纯)0.175 ml(四氯化碳与食用花生油以1∶6的比例配制)腹腔注射造模,3次/周(周一、周三、周五各1次),共8周。C、D、E组建模同时按每只大鼠100 g体重分别给予20、10、5 mg姜黄素灌胃(上海三爱思试剂有限公司分析纯),3次/周,共8周;F组建模同时按每只大鼠100 g给予秋水仙碱(昆明制药集团股份有限公司)0.01 mg灌胃,1次/d,5次/周(周一、周三、周四、周五、周日各1次),共8周。
1.2.2 取材
8周后处死大鼠,留取大鼠全血,并分离出血清,-7 ℃保存待测;留取肝左叶浸泡于10%中性甲醛溶液中固定至少24 h待检。
1.2.3 检测方法
比色法检测血清活性氧(ROS)水平;鲎试验法检测血清内毒素;TBA法检测肝组织匀浆中丙二醛(MDA)含量;电泳迁移率试验(EMSA)检测肝组织中对肝组织核因子-kB(NF-kB)的活性,结果用图像分析软件Image Plus进行条带灰度面积分析,计算NF-kB活性值(灰度值);免疫组织化学双染色检测肝组织中NF-kB和肌源性特异性标志物结合蛋白(desmin),确定NF-kB在肝星状细胞的表达;免疫组织化学法检测肝组织中转化生长因子-b1(TGF-b1)、血小板衍生长因子-BB(PDGF-BB)、CTGF水平;RT-PCR法检测肝组织中金属蛋白酶组织抑制剂-1(TIMP-1)的mRNA水平。
1.3 统计学处理
采用SPSS 13.0软件分析数据。数据以(x±s)表示,组间比较用单因素方差分析,P<0.05为差异有显著性意义。
2 结果
2.1 血清ROS水平
经四氯化碳造模后模型组血清ROS水平明显高于对照组,差异具有统计学意义(P<0.05);给予姜黄素后,ROS水平下降,且随着剂量的增大下降趋势明显,其中高剂量姜黄素组与模型组比较具有统计学意义(P<0.05);阳性组与模型组比较,差异无统计学意义(P>0.05,表1)。
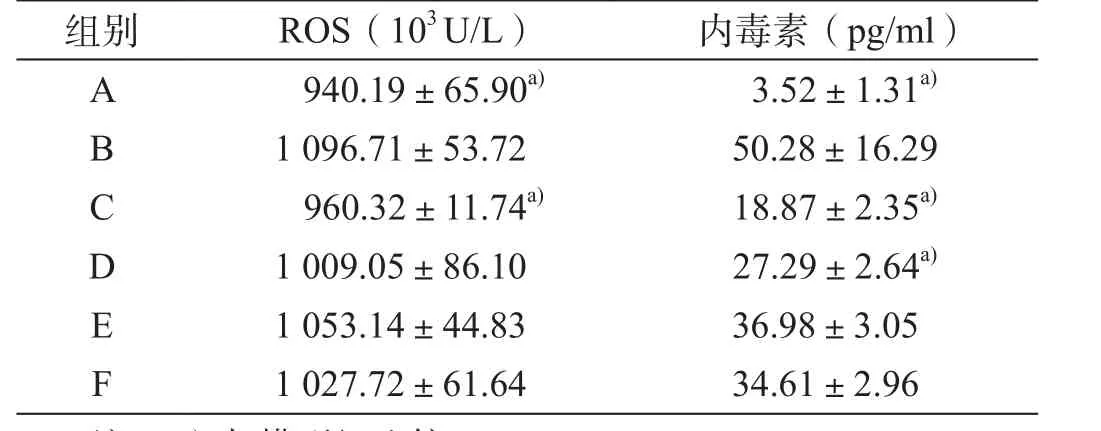
表1 大鼠血清ROS及内毒素水平比较(x ±s)
2.2 血清内毒素水平
模型组血清内毒素水平明显高于对照组,差异具有统计学意义(P<0.05);不同剂量姜黄素组内毒素水平明显下降,组间比较差异均具有统计学意义(P<0.05);高剂量姜黄素组、中剂量姜黄素组与模型组比较,差异具有统计学意义(P<0.05,表1)。
2.3 肝组织MDA含量
模型组MDA含量明显高于正常组,差异具有统计学意义(P<0.05);经姜黄素治疗后,MDA均有下降,高剂量姜黄素组与低剂量黄素组比较,差异具有统计学意义(P<0.05);高、中剂量姜黄素组与模型组比较差异均具有统计学意义(P<0.05);阳性组与模型组比较,差异无统计学意义(P>0.05,表2)。
2.4 肝组织NF-kB活性
姜黄素可降低NF-kB同源序列的结合活性,且呈剂量依赖性;NF-kB活性(灰度值)检测结果显示,模型组活性明显高于正常组,差异具有统计学意义(P<0.05);各剂量姜黄素组活性明显降低,且呈剂量依赖性,高、中剂量姜黄素组组分别与低剂量姜黄素组比较,差异具有统计学意义(P<0.05);各剂量姜黄素组与模型组比较,差异均具有统计学意义(P<0.05,表2)。
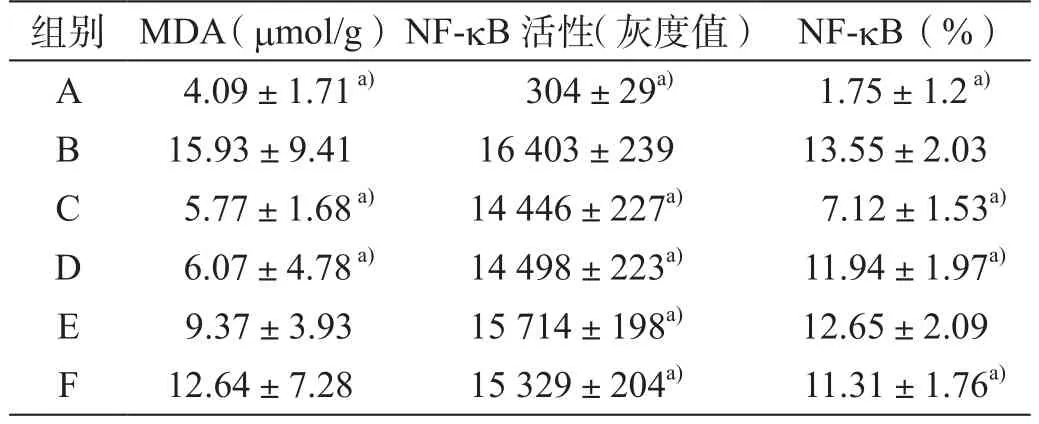
表2 大鼠肝组织MDA、NF-kB活性及表达量化分析(x ±s)
2.5 肝组织NF-kB表达
正常组NF-kB仅极少量表达于汇管区血管壁;模型组可见纤维间隔和汇管区大量表达,且呈长椭圆形或梭形,且着色较深;高剂量姜黄素组仅少量表达于汇管区,中剂量姜黄索组和阳性组在纤维间隔和汇管区可见表达,与模型组比较,差异均具有统计学意义(P<0.05);低剂量姜黄索组在纤维间隔和汇管区可见明显表达,与模型组比较,差异无统计学意义(P>0.05);高剂量姜黄素组分别与中、低剂量姜黄素组比较,差异具有统计学意义(P<0.05,表2)。
2.6 肝组织TGF-b1表达
正常组仅少量表达于于中央静脉周围肝细胞;模型组大量表达于变性的肝细胞及其周围肝窦壁、汇管区和纤维间隔;随着姜黄素剂量的增大,表达量均有下降,不同剂量姜黄素组组间比较差异均具有统计学意义(P<0.05);高剂量姜黄素组与模型组比较,差异具有统计学意义(P<0.05);阳性组表达量低于模型组,差异具有统计学意义(P<0.05,表3)。
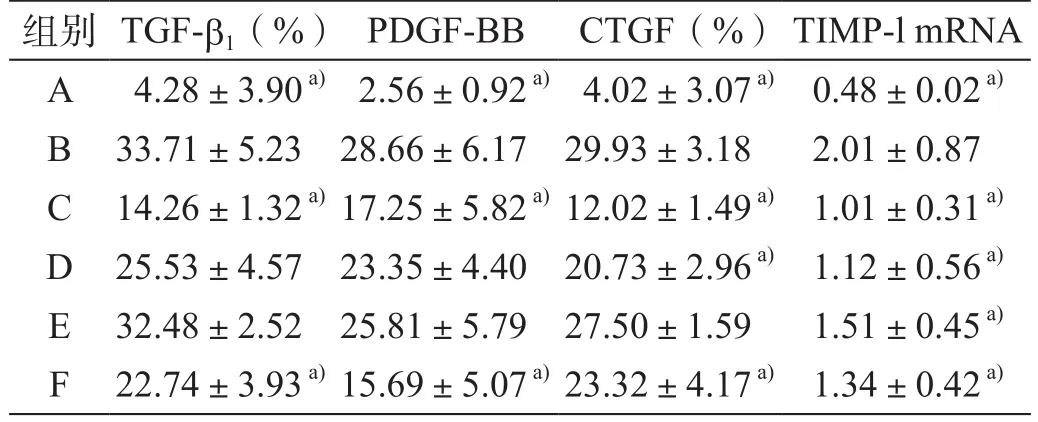
表3 大鼠肝组织TGF-b1、PDGF-BB、CTGF、TIMP-l mRNA表达量化分析(x ±s)
2.7 肝组织PDGF-BB表达
正常组PDGF-BB仅在门静脉血管内有少量表达;模型组在汇管区间隔内细胞、炎细胞、窦旁细胞内均有表达,阳性染色面积比例明显高于对照组,差异具有统计学意义(P<0.05);经姜黄素治疗后表达明显减少,主要见于血窦旁、汇管区,其中高剂量姜黄素组阳性面积比例与模型组比较,差异具有统计学意义(P<0.05);高剂量姜黄素组分别与中、低剂量姜黄素组比较,差异具有统计学意义(P<0.05,表3)。
2.8 肝组织TIMP-l mRNA表达
正常组仅有微量表达,而模型组表达量明显增加,与正常组比较,差异具有统计学意义(P<0.05);各剂量姜黄素组TIMP-1 mRNA表达明显降低,与模型组比较,差异均具有统计学意义(P<0.05);高剂量姜黄素组与低剂量黄素组比较,差异具有统计学意义(P<0.05,表 3)。
3 讨论
肝纤维化是各种慢性肝病发展为肝硬化的共同途径,是肝脏受到各种慢性损伤后发生的一种修复反应,其实质是由于胶原和其它细胞外基质(ECM)的合成与降解失衡,导致在肝内过量沉积[2]。四氯化碳造模过程中,机体通过酶系统与非酶系统产生氧自由基,氧自由基攻击肝细胞膜中的多不饱和脂肪酸,引发脂质过氧化作用,导致肝细胞损伤,激活的肝巨噬细胞(Kupffer细胞)释放出多种细胞因子,如使肝星状细胞(HSC)活化转化为肌成纤维细胞并产生大量的ECM,从而导致肝纤维化的形成[3-4]。
姜黄素为中药姜黄的提取物,毒副作用小,具有广泛的药理活性,能清除自由基、诱导细胞凋亡、调节细胞周期和调控基因表达,是目前抗肝纤维化作用及机理研究的试验药物。本研究结果表明,姜黄素对血清中ROS和内毒素水平及肝组织中MDA、NF-kB、TGF-b1、PDGF-BB、CTGF、TIMP-1 mRNA表达均有不同程度的抑制作用,且与剂量也有一定的相关性。其中,内毒素可直接产生肝细胞毒性,诱导和激发肝星状细胞的基因和表型发生改变,不同剂量姜黄素组内毒素水平明显下降,可延缓肝纤维化的进程[5-6];经姜黄素治疗后,肝组织中的MDA水平下降,提示姜黄素为良好的抗氧化物质,可稳定细胞膜,通过抗氧化作用,抑制脂质过氧化物的产生[7-8];NF-kB在肝纤维化时增强活性,促进炎症反应,加重肝损伤和纤维化程度,姜黄素可降低NF-kB同源序列的结合活性,高剂量姜黄素组仅少量NF-kB表达于汇管区,由此表明姜黄素通过抑制NF-kB的激活而导致抗凋亡作用,进而促进HSC凋亡[9-10];经姜黄素治疗后,肝组织TGF-b1、PDGF-BB表达明显减少,提示姜黄素可降低TGF-bl的促纤维化效应,从而减缓HSC的激活、增殖[11-12],下调PDGF-BB的表达,降低PDGF与其受体结合,使PDGF的促增殖效应得到有效抑制[13];各剂量姜黄素组TIMP-1 mRNA表达明显降低,说明姜黄素可抑制TIMP-1的基因表达,促进ECM降解,减轻肝纤维化程度[14]。
本研究中先采用EMSA技术以检测NF-kB在肝组织中的表达活性,再用免疫组化双染色检测NF-kB和结蛋白,以确定其在HSC中的表达。其中EMSA和免疫组化双染色是本研究中的两个技术难点。再者本研究从动物实验水平观察姜黄素对肝纤维化的治疗作用也是本研究的一个亮点。
综上,本研究证实姜黄素通过多种机制治疗肝纤维化,具有保护肝功能、改善肝脏病理学变化等功效,对临床进一步应用姜黄素抗肝纤维化具有一定的参考价值,但其在人体内的功效有待进一步探讨。
[1] 曾民德, 王泰龄, 王宝恩.肝纤维化诊断及疗效评估共识[J]. 肝脏 , 2002, 7(2): 3-4.
[2] Friedman SL. Mechanisms of hepatic fibrogenesis[J].Gastroenterology, 2008, 134(6): 1655-1669.
[3] 邓燕红. 姜黄素衍生物对四氯化碳诱导肝纤维化的治疗作用[D]. 重庆: 重庆医科大学, 2012.
[4] Anan A, Baskin-Bey ES, Bronk SF, et al. Proteasome inhibition induces hepatic stellate cell apoptosis[J].Hepatology, 2006, 43(2): 335-344.
[5] 彭景华, 胡义扬. 姜黄素抗肝损伤研究进展[J]. 国际消化病杂志, 2005, 25(6): 373-375.
[6] 袁粒星, 刘小菁, 高举, 等. 内毒素对肝星状细胞结缔组织生长因子表达的影响[J]. 中华肝脏病杂志, 2003, 11(4):200.
[7] Zheng J, Wu C, Lin Z, et al. Curcumin up-regulates phosphatase and tensin homologue deleted on chromosome 10 through microRNA-mediated control of DNA methylation-a novel mechanism suppressing liver fibrosis[J]. FEBS J. 2014,281(1): 88-103.
[8] 邓燕红, 沈能, 凌宁, 等. 姜黄素衍生物对四氯化碳诱导肝纤维化的治疗作用[J]. 中国临床药理学与治疗学, 2012,17(2): 147-153.
[9] 杨伟峰, 陈厚昌, 李琳. 姜黄素对肝星状细胞增殖及分泌细胞外基质的影响[J]. 临床肝胆病杂志, 2004, 20(30):142.
[10] Meng Z, Yu XH, Chen J, et al. Curcumin attenuates cardiac fibrosis in spontaneously hypertensive rats through PPAR-γ activation[J]. Acta Pharmacol Sin, 2014, 35(10): 1247-1256.
[11] 何雅军, 舒建昌, 吕霞, 等. 姜黄素预防肝纤维化作用与肝星状细胞关系的观察[J]. 中华肝脏病杂志, 2006, 14(5):337-340.
[12] BreitkopfK, Roeyen Cv, Sawitza I, et a1.Expression patterns ofPDGF-A, -B, -Cand-D andthe PDGF-receptors alpha andbeta in activated rat hepatic stellate cells(HSC)[J].Cytokine, 2005, 31(5): 349-357.
[13] Vuppalanchi R, Chalasani N. Nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: Selected practical issues in their evaluation and management[J]. Hepatology, 2009, 49(1):306-317.
[14] 张小斌, 曾令兰, 陈莎燕, 等. 姜黄素对肝纤维化模型大鼠肝纤维化组织细胞因子的影响[J]. 医药导报, 2011, 30(4):443-446.
