丛枝菌真菌对小麦的促生长效应与根腐病抑制效应
2015-09-03吴洁婷安广楠
王 立,王 敏,马 放,李 哲,吴洁婷,安广楠
(城市水资源与水环境国家重点实验室(哈尔滨工业大学),150090哈尔滨)
小麦是世界上最重要的粮食作物之一,根腐病[1-2]是影响小麦生产的主要病害类型[3],主要由播种过深、营养不平衡、冻伤、大水漫灌、调用带病的麦种等因素造成[4].据统计根腐病可引起小麦减产达15%~20%,经济损失严重,因而对小麦根腐病的防治一直很受重视[5-6].目前,针对小麦根腐病的防治对策主要以化学农药拌种为主[7],但农药残留超标会引发食品安全问题,且农药施加过量会引起严重的面源污染.因此,亟需一种安全、环保、有效的防治小麦根腐病的方法.
丛枝菌根(arbuscular mycorrhiza,AM)是植物根系与丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)形成的共生体,能够有效增强作物的物质生产和抗病能力[8],近些年在“绿色肥料”和“绿色农药”开发领域具有巨大潜力[9-11].丛枝菌根是菌根中分布最广泛、发生率最高的一类菌根.已有研究表明,一方面,丛枝菌根真菌侵染条件下能够有效促进宿主对土壤中矿质元素的吸收[12],增加根际土壤中微生物的数量,改善植物的碳、氮、磷素营养状况[8],促进植物生长,改善作物品质;另一方面,AM能在宿主植物根际形成大量外生菌丝,大大扩展了根系吸收面积,使宿主植物生长健壮,生命力旺盛,从而增强其抗性[13].因此,有望在作物病害防治方面发挥重要作用.本研究选择丛枝菌根真菌中分布广泛、可与多种宿主形成良好共生关系的普适性菌种——摩西球囊霉作为优选菌剂,定量分析其在小麦生长及根腐病防治过程中可能发挥的重要作用.
1 试验
1.1 试验材料
在城市水资源与水环境国家重点实验室模拟自然人工气候室中进行盆栽试验.试验时间为2013年3月25日~2013年9月28日.气候条件:室内平均气温为20.8℃,空气相对湿度为(42±0.12)%.
供试菌剂:广适丛枝菌根真菌——摩西球囊霉(Glomus mosseae),来自黑龙江大学生命科学学院,孢子数为23个·g-1.供试基质:田间灭菌土壤,水解性氮112.24 mg/kg,有 效 磷399.78 mg/kg;pH 为 6.5.
盆栽试验:花盆高12 cm,盆口直径10 cm,盆底直径8 cm.试验前用75%的酒精溶液浸泡30 min,2 h 后加入相应基质 0.35 kg.
植物宿主:小麦(Triticumaestivum),品种为东农024,购于黑龙江省农科院.种子用体积分数为0.1%高锰酸钾液浸种30 min进行表面消毒,然后用蒸馏水浸泡24 h,30℃保湿催芽.待芽长至1 cm左右时,筛选芽长基本一致的小麦种子10粒均匀地撒在小花盆中,表面覆土约2 cm,每天早晚浇水两次.
1.2 试验设计及方法
试验设置AMF空白基质(-GM-AA)、AMF空白基质接种根腐病菌(-GM+AA)以及AMF强化基质接种根腐病菌(+GM+AA)3个组别,采用菌剂与土壤基质均匀混合的方式,各组基质均经过压力0.15 MPa、温度121℃条件下蒸气灭菌2 h.AMF强化基质中每盆接种10 g有效菌剂,空白基质中添加10 g菌剂的滤纸滤液,用以确保3个组别除菌根真菌以外微生物群落的一致性.每个组别设置10个重复.所有基质灌水至盆底有水溢出,而后移栽小麦幼苗,参考大田种植密度规划每盆10株.
1.2.1 AMF 接种及测定
接种:将种子均匀撒入混合基质中,表面覆土约1 cm.
侵染率测定:采样时间为小麦幼苗自然生长4周后.随机选取100条约2 cm长根尖根段染色[12]、制片、观察,并根据十字交叉法计算菌根侵染率[13-14].
1.2.2 菌根依赖性计算

根据Nemec[15]的分类方法,将植物对菌根的依赖度分为3级:菌根依赖指数为300%时为高强度依赖性,200%时为中等强度依赖性,100%时为弱依赖性或无依赖性.
1.2.3 AMF 对植物生长的影响
分别测量AMF强化处理组小麦苗的株高、地上及地下生物量、根总表面积,与空白试验组作对比,研究AMF对植物生长的影响,计算植物菌根依赖指数.
1.2.4 AMF 对植物抗/耐病性的影响
根据植物发病情况分别计算植物的发病率与发病指数[16-17],测量可溶性蛋白 MDA(丙二醛)、游离脯氨酸质量分数以及SOD(超氧化物歧化酶)、POD(过氧化物酶)等体现植物逆性的指标,与对照组(CK)比较,探究AMF对小麦抵抗根腐病的作用.
根据刘惕若等[18]对植物根腐病病情的分类标准,可计算出植株病情指数,即

1.3 数据分析
采用Ducan多重比较检验各处理间的差异,统计学意义水平为5%.
2 结果与分析
2.1 菌根侵染率和菌根依赖性分析
不施加菌剂的对照组(CK)中,仍可检测出AMF对小麦根部的侵染,表明自然基质中土著AMF普遍能够与小麦形成共生体,但侵染率很低(3.25%).
相比CK组,施加菌剂可显著提高AMF对小麦的侵染作用(P<0.05).经测定,接种后摩西球囊霉的侵染率可达42.2%,约为空白基质组的14倍.结果表明,摩西球囊霉对小麦的侵染效果极佳(P< 0.05).
AMF对小麦的侵染作用可有效提高小麦(地上及地下)对AMF的菌根依赖性指数.
将不施加菌剂的对照处理(CK)植物组的菌根依赖指数设为100%,相比于CK,施加菌剂摩西球囊霉植物组的菌根依赖性指数(P<0.05)为149%,约为未施加菌剂组的1.5倍,说明小麦根系对摩西球囊霉具有较强的依赖性.
为进一步揭示菌根真菌对植物生长的促进作用,将植物生长对菌根真菌的依赖性划分为地上和地下两部分.与CK相比,施加菌剂可显著提高植物地上、地下部分的菌根依赖性(P<0.05).其中,小麦地上、地下部分对菌剂摩西球囊霉的依赖性分别为123%,166%,均为中等强度依赖[17].由表1可以看出,小麦地下部分对菌剂的依赖性明显高于地上部分.

表1 AMF对小麦侵染率、菌根依赖性、地上及地下菌根依赖性的影响 %
2.2 AMF对小麦营养生长的影响
2.2.1 AMF接种对小麦株高的影响
株高是反应小麦营养生长状况最易获得且最明显的指标.分别测量了小麦生长第 10天,30天,60天,90天,120天AMF强化基质处理组小麦的株高,并与CK对比,结果见图1.可以看出,植物株高随时间变化呈现先加速而后趋于平缓的二次曲线规律.其中AMF强化组小麦株高在各个时期均显著高于CK组,具体参数见表2.

图1 AMF对小麦株高的影响

表2 小麦株高-时间变化动态
从表2拟合方程可以看出:
1)AMF接种植物生长更旺盛,以曲线的初始斜率表征植物增长速率,GM组与CK组增长速率分别为 40.23%、27.29%,提高了约 13%,表明接种植物较非接种植物更早达到生长旺盛期.
2)AMF可显著促进植物营养生长,其最大株高较非接种植物高8 cm(约30%).
3)两组处理的拟合曲线最高值分别为33.94,25.71,达到最大值的天数分别为 72,115 d.增长速率分别为 40.23%、27.29%,图 1中阴影部分为菌剂的促进效应.结果表明,AMF强化组增长速率更快,最大值远大于CK组,且更早达到最大值,说明AMF能够使小麦营养生长长势更好,生长更迅速.
2.2.2 AMF接种对小麦总生物量及根系总表面积的影响
相比CK组,施加菌剂后可显著提高小麦的地上、地下生物量(P<0.05),对小麦地上部分的促进作用尤为明显(P<0.05).施加摩西球囊霉后,植物地上、地下生物量分别提高38.9%、82.3%.说明摩西球囊霉菌剂能够有效促进同化物质的积累,特别在促进根系发育方面效果显著,结果见图2.
施加摩西球囊霉菌剂后,小麦根部总表面积明显高于未施加菌剂的CK组(P<0.05).说明自然条件下形成的少量AM菌根结构不能明显增大根系的营养吸收面积,而施加了AMF后根系总表面积比 CK 增大了 40.33%[18],见图 3.由于大量菌丝存在增大了小麦根系的总表面积,提高了营养吸收效率,保证了小麦旺盛生长以及良好的抗逆性.
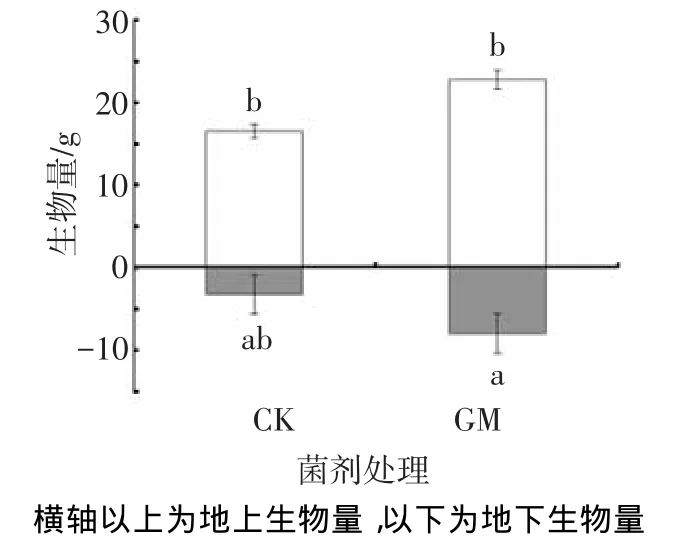
图2 AMF对小麦地上、地下生物量的影响
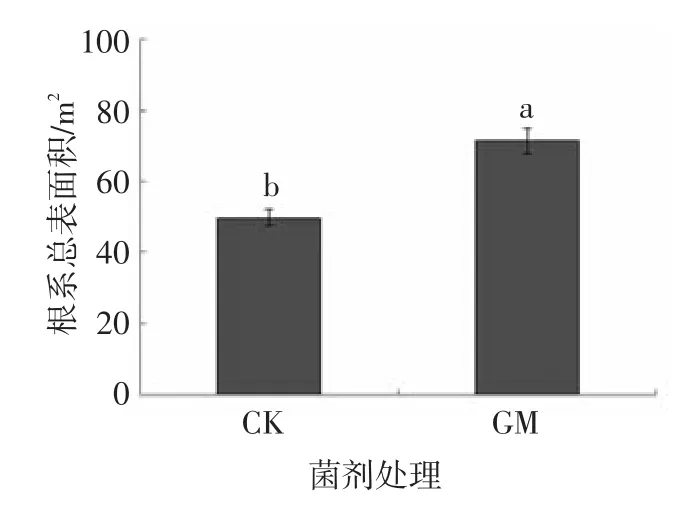
图3 AMF对小麦生物量及根系表面积的影响
2.3 AMF对小麦抗逆性能的提高
可溶性蛋白 MDA(丙二醛)、游离脯氨酸质量分数以及SOD(超氧化物歧化酶)、POD(过氧化物酶)等植物生理胁迫指标的变化,可以间接反映AMF菌对植物抗/耐病性的影响,结果见表3.

表3 AMF对植物各生理胁迫指标的影响
可溶性蛋白质量分数、游离PRO质量分数、SOD活性、POD活性与植物抗逆性呈正相关,MDA质量摩尔浓度与抗逆性呈负相关[19].由表3可知,与空白基质组相比,AMF强化组与抗逆性正相关的参数均有明显提高(P<0.05),分别提高 66.9%、50.2%、84.6%、81.8%,MDA 质量摩尔浓度明显下降64.2%(P< 0.05),说明 AMF菌剂对于改善小麦性质机能、增强自身抗病能力具有显著效果(P<0.05).
2.4 AMF对小麦根腐病的增抗效果
图4分别为添加AMF组(+GM+AA)和未添加AMF组(-GM+AA)小麦根腐病菌侵染小麦根部情况图.从表观上可以看出,两组均出现不同程度的枯黄甚至腐烂,但前者发病情况明显轻于后者,说明AMF可以保护植物根部,对小麦根腐病有一定的增抗效果.
根据植物发病情况分别计算小麦植株的发病率与发病指数[20],考察菌根作物与非菌根作物抗病能力的差异,结果见表4.
各实验组接种根腐病菌后,与CK相比,发病率及病情指数均有增加.但施加AMF菌剂组小麦植株的发病率和发病指数明显低于空白基质组(P< 0.05),分别降低 38%、3.74.

图4 小麦根部根腐病发病情况

表4 AMF对小麦根腐病的增抗效果
3 结 论
1)小麦能够与AMF形成菌根共生体AM.人工接种AMF菌剂可显著提高小麦根部AMF侵染率.摩西球囊霉对小麦根部侵染率为42.2%,约为自然条件的14倍,其菌根依赖性指数高达149%,约为未施加菌剂组的1.5倍,且其地下部分对菌剂的依赖性明显高于地上部分.
2)人工施加AMF菌剂,可显著促进小麦的营养生长,其株高、地上及地下生物量、根系总表面积均显著提高,分别增加 26.67%、38.9%、82.3%、20.33%,这一结论为菌根技术用于“绿色肥料”生产奠定了基础.
3)施加AMF菌剂后,可显著降低小麦植株的发病率、发病指数以及与植物抗逆性成负相关的生理指标参数(P<0.05),且大幅度提高与植物抗逆性呈正相关的生理指标参数(P<0.05),对小麦根腐病具有良好的防治效果,在应用于“绿色农药”开发领域具有巨大潜力.
[1]李向彬.草莓根腐病菌致病物质的初步研究[D].陕西:西北农林科技大学,2010.
[2]湛蔚.菌根真菌提高杨树抗溃疡病机制的研究[D].陕西:西北农林科技大学,2010.
[3]张景春,朱秀廷,刘瑛选.小麦根腐病的研究[J].黑龙江大学自然科学学报,1988(2):68-74.
[4]站徐建.小麦根腐病的发生于防治[J].河北农业科技,2007(4):29.
[5]侯生英,张贵.小麦根腐病产量损失及经济阈值研究[J].西北农林科技大学学报,2002(1):76-78.
[6]贾廷祥,吴桂本,刘传德.我国小麦根腐性病害研究现状及防治对策[J].中国农业科学,1995(3):41-45.
[7]赵宜谦,侯生英,蒋仲英,等.小麦根腐病国内外研究动态及防治对策初探[J].云南农业大学学报,1993(8):218-220.
[8]张淑娟,王立,马放,等.丛枝菌根(AM)对水稻生长促进及化肥减量研究[J].哈尔滨工业大学学报,2010.42-46:958-962.
[9]王立,贾文奇,马放,等.菌根技术在环境修复领域中的应用及展望[J].生态环境学报,2010,19(2):487-493.
[10]王立,马放,任汲东,等.菌根真菌对环境的改造作用及其在环境修复领域中的应用[C]//2008年中国微生物生态学年会论文集.长沙:中国微生物生态专业委员会,2008:79-84.
[11]张淑娟,王立,马放,等.菌根技术在农业面源污染防治中的应用[C]//植物内生菌开发与应用学术研讨会论文集.昆明:中国农业科技学会,2009:110-114.
[12]李登武,王冬梅,余仲东.AM真菌与植物共生的生理生化效应研究进展[J].西北植物学报,2002,22(5):1255-1262.
[13]高秀兵,陈娟,姚雍静,等.丛枝菌根真菌提高植物对土传菌物病害抗性的研究进展[J].贵州茶叶,2010,38(3):5-13.
[14]盛萍萍,刘润进,李敏.丛枝菌根观察与侵染率测定方法的比较[J].菌物学报,2011.30(4):519-525.
[15]NEMEC S.Response of six citrus root-stocks to three species of Glomus,a mycorrhizalfung[J].Proc Fla State Hort Sci,1978(1):9-11.
[16]张建华.测量根系表面积的面积仪法[J].植物生理学通讯,1989(6):46.
[17]张雪,王立,马放,等.生物肥氮肥耦合对水稻资源利用的影响[J].哈尔滨工业大学学报,2012(8):39-43.
[18]刘惕若,张匀华,彭驰,等.小麦根腐病对小麦生产的危害性研究[J].现代化农业,1989(9):4-5.
[19]史惠兰.青海湖地区4种荒漠植物抗逆性指标的研究[J].安徽农业科学,2011(23):14227-14229.
[20]张匀华.小麦赤霉病发病率与病情指数关系初步研究[J].黑龙江农业科学,2000(3):3-5.
