过氧乙酸对脱细胞血管支架生物学特性影响的实验研究
2015-09-03张蔓菁郭树忠鲁开化
刘 宾, 李 菲, 张蔓菁, 夏 炜, 郭树忠, 鲁开化
过氧乙酸对脱细胞血管支架生物学特性影响的实验研究
刘 宾, 李 菲, 张蔓菁, 夏 炜, 郭树忠, 鲁开化
目的 探讨使用体积分数为0.1%过氧乙酸处理脱细胞血管支架的生物相容性和生物力学特征,观察其作为生物材料消毒剂对于脱细胞血管支架材料生物特性的影响。方法 选取2.0~2.5 kg大耳白兔10只,在无菌条件下切取新鲜的兔股动脉,经反复冻融与超高压处理后,以15 μg/ml R-Nase A,150 μg/ml D-Nase Ⅰ 核酸酶进行脱细胞处理,室温下放置于体积分数为0.1%过氧乙酸溶液中3 h,对其进行组织学评估,观察其超微结构、生物力学,以及细胞毒性的测定。结果 经体积分数为0.1%过氧乙酸处理后的脱细胞血管支架,在组织结构、生物力学及细胞毒性方面与正常对照组之间无明显差异。结论 采用体积分数为0.1%过氧乙酸处理脱细胞血管支架,对其生物相容性和生物力学特性无明显影响,或许可以作为脱细胞组织工程血管生物支架消毒剂的一种选择。
组织工程血管; 过氧乙酸; 脱细胞血管支架; 消毒
脱细胞血管基质因其保留了细胞外基质的主要结构和成分,具有低免疫原性、机械性能良好、促进细胞的黏附生长和组织再生的优良特性,是一种理想的组织工程血管支架材料,因此,在血管组织工程中得到越来越多的重视和应用[1-2]。但是,脱细胞血管支架的研究应用,也面临着传播供体潜在疾病以及在移植物处理应用过程中二次污染的问题。传统的生物材料灭菌方法存在操作要求条件较高,过程较复杂,以及可能降低材料的机械强度等缺点[3-5]。因此,我们希望寻找一种操作简便、灭菌效果确实、费用低廉、残留低,且对材料性能影响较小的脱细胞血管支架消毒办法。过氧乙酸(peracetic acid, PAA)是一种强氧化剂,它的自然降解产物无毒或低毒,是其作为灭菌剂的一大优点。自2011年9月至2012年6月,我们将体积分数为0.1%PAA作为脱细胞血管支架的消毒剂,对经PAA处理的脱细胞血管支架进行相关特性的测定,旨在观察过氧乙酸对脱细胞血管支架材料生物学特性的影响。
1 材料与方法
1.1 材料和试剂来源
选取2.0~2.5 kg大耳白兔10只 (第四军医大学动物中心),核糖核酸酶(R-Nase A)、脱氧核糖核酸酶(D-Nase I)、40%PAA(美国SIGMA公司)。
1.2 方法
1.2.1 脱细胞血管支架的制备 在麻醉及无菌条件下取出兔股动脉(20根),去除血管外膜后,置入液氮罐中,-196 ℃,1 h,37 ℃水浴复温15 min。上述冻融过程反复进行3次;将反复冻融的血管材料,以D-Hank液洗净后放入特制的塑料袋中,袋中浸满D-Hank液;将塑料袋置入超高压机器中,5.065×105kPa (4 ℃)处理10 min后,在无菌条件下将内层特制塑料袋中的血管取出,并置入含有15 μg/ml R-Nase A,150 μg/ml D-Nase Ⅰ 溶液中,冲洗48 h(37 ℃,5% CO2环境内搅拌),然后用PBS冲洗1 d[6]。
1.2.2 脱细胞血管支架的PAA处理 将40%PAA溶液,以无菌PBS溶液稀释成体积分数为0.1%PAA溶液(现配现用),用滴定法(1N的NaOH)将溶液pH值调至7.0~7.4;将制备的脱细胞血管支架10根,室温下放置于体积分数为0.1%的PAA溶液中3 h;另外10根作为未处理的对照组,同等条件下放置于灭菌PBS溶液中3 h。脱细胞血管材料经PAA处理完毕后,在灭菌PBS溶液中冲洗3次,每次30 min。所有材料处理完毕后,无菌保存在-80 ℃冰箱中。
1.2.3 兔血管内皮细胞的分离培养 取兔股静脉>20 cm,6 h内进行分离、培养,取培养出的5~6代细胞进行试验。
1.2.4 接触细胞毒性测定 实验组:将约3 mm×3 mm 的无菌医用粘合膜粘贴于一次性细胞培养皿中央,然后在无菌条件下取5 mm×5 mm大小PAA消毒处理过的脱细胞血管基质,黏附于细胞培养皿中。对照组:将1滴氰基丙烯酸酯滴加至另一培养皿中央的医用粘合膜上;再将准备的内皮细胞悬液依次接种于上述培养皿中,于CO2培养箱中(37 ℃,5% CO2)孵育48 h后,在倒置荧光显微镜下观察细胞与培养皿中央材料毗邻部位的形态。1.2.5 材料提取物及不同浓度PAA细胞毒性测定 ⑴取PAA消毒处理的脱细胞血管支架100 mg,用无菌剪刀尽可能地剪碎,将组织碎片放入可密封消毒试管中,称重,加入DMEM培养液200 ml(2 ml/mg组织)。密封试管于37 ℃孵育96 h,离心4000 r/min, 20 min,取上清液,经0.2 μm滤器过滤后测定体积。将提取液与DMEM按照1∶1,1∶4,1∶6,1∶12的体积比稀释;将0.2%PAA与DMEM按照1∶1,1∶4,1∶6,1∶12的体积比稀释。然后,将混合溶液分别稀释为0.1%、0.04%、0.003%、0.0015%,以验证不同浓度PAA的细胞毒性。⑵用MTT法检测细胞增殖活性。以上每个试验浓度设5个复孔,并设定阴性对照孔(DMEM培养液100 μl)和空白孔(无细胞),进行MTT实验。每组实验重复5次,取平均A值。
1.2.6 经PAA处理的脱细胞血管支架材料的胶原含量测定 羟脯氨酸含量测定:经PAA处理以及未处理脱细胞基质材料各取50 mg,利用Edwards and O′Brien法[7],测量材料的胶原含量。
1.2.7 处理前后材料机械力学特性的测定 ⑴最终抗张强度(ultimate tensile strength, UTS )。利用张力实验机测定经PAA处理前后材料的UTS(西安交通大学工程力学系机械结构强度与振动,国家重点实验室MTS-858双轴液压生物材料试验机)。⑵缝线保留测试。利用张力实验机,完成对经PAA处理前后材料的缝线保留测试实验。

2 结果
2.1 脱细胞血管基质的组织学观察
脱细胞血管的管壁纤维波浪状结构均保存基本完好,支架中完全去除了血管中的细胞成分。
2.2 材料细胞毒性
2.2.1 材料接触性细胞毒性 经过PAA处理的脱细胞血管材料无细胞毒性,在材料周围的内皮细胞形态正常,未发现内皮细胞的接触或者生长抑制。阳性对照组材料周围的细胞,则出现明显的生长及接触抑制,并出现大量的细胞坏死和漂浮(图1,2)。
2.2.2 材料提取物细胞毒性 ⑴材料提取物的细胞毒性见表1。根据测定结果发现,在不同培养时长内,材料提取液不同稀释比例,各组对于细胞的抑制作用与正常组比较差异,无明显的统计学意义。⑵不同稀释浓度的PAA细胞毒性结果见表2。根据测定结果发现,浓度低于或等于0.003%的PAA,其细胞的毒性与正常组比较,差异无明显的统计学意义。

图1 PAA处理后材料与内皮细胞共培养(×40) 图2 带有氰基丙烯酸酯的粘合膜与内皮细胞共培养(×40)
Fig 1 Co-culture of endothelial cells and material treated with PAA vascular (×40). Fig 2 Co-culture of endothelial cells and cyanoacrylates treated with adhesive film (×40).
2.3 材料的胶原含量测定
见表3。
2.4 材料的机械力学特征
材料的UTS,以及缝线保留测试结果见表4。
3 讨论
作为组织工程血管研究领域的一个热点,脱细胞血管支架在组织工程血管研究领域,一直有着比较广泛的应用。但是,与其他异体或异种的组织移植物一样,脱细胞血管支架的研究应用也面临着传播供体潜在疾病,以及在移植物处理应用过程中二次污染的问题。因此,灭菌处理也是高效、快速、安全制备脱细胞组织工程血管支架材料的一个非常重要环节。传统的生物材料灭菌方法主要有以环氧乙烷为代表的化学法和以Co60照射为代表的电离辐射法。这两种通用的灭菌方法有着毋庸质疑的灭菌效果,但它们也存在着改变材料生物化学特性,降低材料生物力学强度等问题[7]。而能够达到灭菌效果的足够剂量的Co60照射处理,明显降低了生物材料的生物力学强度。因此,我们设想能够找到一种操作简便,灭菌效果确实,费用低廉,残留低,且对材料的生物力学及生物化学性能影响较小的脱细胞血管支架的消毒办法。
目前,对于PAA的研究主要集中在其灭菌效能上,而其对材料生物学特征影响的研究则较少。有研究表明,体积分数为0.1%PAA是对生物移植物消毒灭菌的最佳浓度[8-9],而其作为生物材料的消毒剂,则最早应用于骨及心脏瓣膜组织[10-12],以及处理人的脱细胞膑韧带和测定其对韧带组织生物相容性及生物力学特征的影响[13]。结果表明,经PAA处理前后的韧带组织,其生物学特性无明显改变。而PAA对于脱细胞血管基质支架的此类管状生物材料及材料生物力学和化学特性影响的研究,国内外报道较少。因此,我们的研究中,将可以作为骨骼、瓣膜、韧带等片状生物材料消毒剂的PAA,应用到脱细胞血管支架的此类管状生物材料的消毒制备中。在每一种新的生物材料消毒灭菌方法应用前,除了其灭菌效能以外,对于生物材料的生物学特性影响,也是非常重要的考察指标。因为这些生物学特性对于生物材料日后的应用起着非常重要的作用。另外,使用的消毒灭菌试剂在材料的残留以及是否与材料发生生物化学反应,亦是重要的考察指标。因此,我们在研究中对体积分数为0.1%PAA处理的兔脱细胞血管基质材料的上述指标进行了体外测试。结果表明,经过体积分数为0.1%PAA处理的脱细胞血管基质,其材料毒性并未明显增加(接触以及细胞提取物);细胞学实验表明,与其共培养的血管内皮细胞增殖旺盛,大量细胞长入材料内部。由此看出,经过处理后的脱细胞血管基质,在体外依然具有良好的生物相容性。
脱细胞血管基质的主要成分为胶原纤维,而胶原纤维的主要分解产物为羟脯胺酸。因此,我们通过测定PAA处理前后材料羟脯胺酸的含量,初步判断体积分数为0.1%PAA是否与材料发生生物化学反应。笔者发现,经PAA处理前后的脱细胞血管支架,其羟脯胺酸含量基本一致,从而可以初步表明,PAA未与脱细胞血管基质材料发生明显的生物化学反应。
表1 不同稀释浓度材料提取液作用后EC吸光度变化

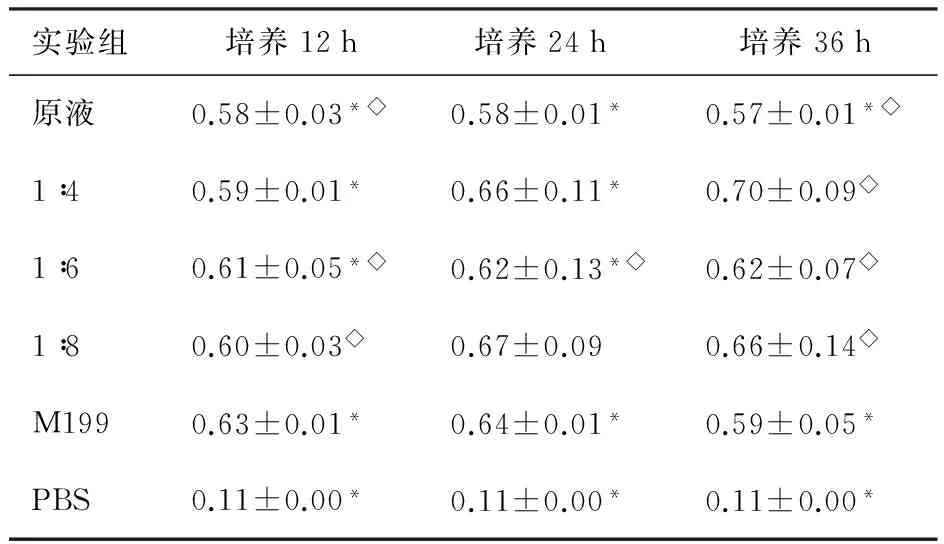
实验组培养12h培养24h培养36h原液0.58±0.03*◇0.58±0.01*0.57±0.01*◇1∶40.59±0.01*0.66±0.11*0.70±0.09◇1∶60.61±0.05*◇0.62±0.13*◇0.62±0.07◇1∶80.60±0.03◇0.67±0.090.66±0.14◇M1990.63±0.01*0.64±0.01*0.59±0.05*PBS0.11±0.00*0.11±0.00*0.11±0.00*
注:*同一时段相邻各浓度组间比较,P>0.05;◇同一浓度不同 时间的组间比较,P>0.05
表2 不同浓度PAA作用后EC吸光度变化


实验组培养12h培养24h培养36h0.1000%0.06±0.01*0.05±0.02*0.05±0.01*0.0400%0.27±0.01*0.24±0.01*0.19±0.01*0.0030%0.54±0.02*◇0.47±0.01*◇0.56±0.01*◇0.0015%0.59±0.01*◇0.64±0.02*◇0.59±0.01◇M1990.63±0.01*0.64±0.01*0.59±0.05*PBS0.11±0.00*0.11±0.00*0.11±0.00*
注:*浓度≥0.003%PAA同一时段相邻各浓度组间比较,P<0.05;
◇浓度≤0.003%PAA同一浓度不同时间的组间比较,P>0.05
表3PAA处理前后血管材料的羟脯氨酸含量测定结果


样品羟脯氨酸含量(μg/mg)正常血管组2.01±0.16脱细胞血管支架组2.15±0.09过氧乙酸处理脱细胞血管支架组2.13±0.12
注:血管材料的羟脯氨酸含量各组两两比较,P>0.05
表4PAA处理后血管材料的生物力学性能指标测试结果

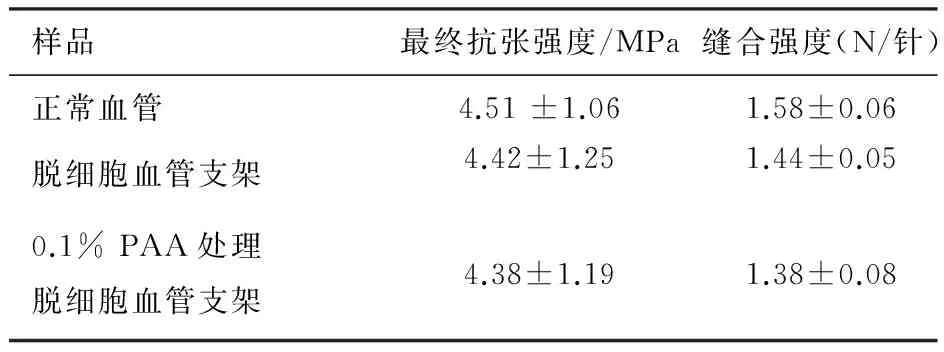
样品最终抗张强度/MPa缝合强度(N/针)正常血管4.51±1.061.58±0.06脱细胞血管支架4.42±1.251.44±0.050.1%PAA处理脱细胞血管支架4.38±1.191.38±0.08
注:血管材料的UTS以及缝合强度各组两两比较,P>0.05
足够的初始强度和弹性,对于组织工程血管支架的材料来说,是非常重要和必需的。因此,我们在研究中测试了经PAA处理前后血管组织的强度和弹性,以判断经过体积分数为0.1%PAA的处理,作为管腔状脱细胞血管基质材料的主要生物力学指标,是否会发生明显的改变;体外测试的结果(UTS、缝线保留测试)也证实,PAA没有明显改变脱细胞血管基质的强度和弹性。这一结果,同时也可以从常规组织切片的胶原纤维正常形态中得到证实。
4 结论
体外试验初步表明,经体积分数为0.1%PAA处理的脱细胞血管材料,其细胞毒性、生物力学以及其自身化学成分,与未经PAA处理前比较,差异无明显的统计学意义(P>0.05)。由此我们推断,应用体积分数为0.1%PAA作为组织工程血管支架制备过程中的消毒灭菌制剂或许是可行的。我们在后续的动物体内试验中将继续验证这一推论。
[1]TeebkenOE,PichlmaierAM,HaverichA.Cellseededdecellularisedallogeneicmatrixgraftsandbiodegradablepolydioxanone-prosthesescomparedwitharterialautograftsinaporcinemodel[J].EurJVascEndovascSurg, 2001,22(2):139-145.
[2]ChoSW,ParkHJ,RyuJH,etal.Vascularpatchestissue-engineeredwithautologousbonemarrow-derivedcellsanddecellularizedtissuematrices[J].Biomaterials, 2005,26(14):1915-1924.
[3]KearneyJN,BojarR,HollandKT.Ethyleneoxidesterilisationofallogenicboneimplants[J].ClinMater, 1993,12(3):129-135.
[4]SilvaggioVJ,FuFH,GeorgescuHI,etal.TheinductionofIL-1byfreeze-driedethyleneoxide-treatedbone-patellartendon-boneallograftwearparticles:aninvitrostudy[J].Arthroscopy, 1993,9(1):82-86.
[5]FidelerBM,VangsnessCTJr,LuB,etal.Gammairradiation:effectsonbiomechanicalpropertiesofhumanbone-patellartendon-boneallografts[J].AmJSportsMed, 1995,23(5):643-646.
[6] 刘 宾, 张蔓菁, 夏 纬, 等. 反复冻融与超高压处理制备脱细胞组织工程血管支架的实验研究[J]. 中国美容整形外科杂志, 2009,20(12):761-764.
[7]EdwardsCA,O′BrienWDJr.Modifiedassayfordeterminationofhydroxyprolineinatissuehydrolyzate[J].ClinChimActa, 1980,104(2):161-167.
[8]LomasRJ,Cruse-SawyerJE,SimpsonC,etal.Assessmentofthebiologicalpropertiesofhumansplitskinallograftsdisinfectedwithperaceticacidandpreservedinglycerol[J].Burns, 2003,29(6):515-525.
[9]RauhJ,DespangF,BaasJ,etal.Comparativebiomechanicalandmicrostructuralanalysisofnativeversusperaceticacid-ethanoltreatedcancellousbonegraft[J].BiomedResInt, 2014,2014:784702.
[10]PrussA,KaoM,KiesewetterH,etal.Virussafetyofavitalbonetissuetransplants:evaluationofsterilizationstepsofspongiosacuboidsusingaperaceticacid-methanolmixture[J].Biologicals, 1999,27(3):195-201.
[11]KheirE,StapletonT,ShawD,etal.Developmentandcharacterizationofanacellularporcinecartilagebonematrixforuseintissueengineering[J].JBiomedMaterResA, 2011,99(2):283-294.
[12]StapletonTW,IngramJ,KattaJ,etal.Developmentandcharacterizationofanacellularporcinemedialmeniscusforuseintissueengineering[J].TissueEngPartA, 2008,14(4):505-518.
[13]LomasRJ,JenningsLM,FisherJ,etal.Effectsofaperaceticaciddisinfectionprotocolonthebiocompatibilityandbiomechanicalpropertiesofhumanpatellartendonallografts[J].CellTissueBank, 2004,5(30):149-160.
Effects of peracetic acid on the biological features of the acellular vascular scaffold
LIUBin,LIFei,ZHANGMan-jing,etal.
(DepartmentofBurnsandPlasticSurgery,Xi′anCentralHospital,Xi′an710003,China)
Objective To observe the effects of 0.1% volume fraction peracetic acid on the biological features of the acellular vascular scaffold through analyzing the biocompatibility and biomechanics of the acellular vascular scaffold treated by 0.1% volume fraction peracetic acid. Methods Femoral artery were isolated under sterile conditions from 2.0~2.5 kg rabbits (10) and treated by repeated freeze thawing for disruption of donor cells. 15 μg/ml R-Nase A and 150 μg/ml D-Nase Ⅰ concentration of nuclease were used to wash out the cell debris. Then, the scaffold was put into the solution of 0.1% volume fraction peracetic acid for 3 hours at room temperature, the acellular scaffold was evaluated by histological and ultrastructural observation, the biomechanics and cytotoxicity of the blood vessels that treated by repeated freeze thawing and ultrahigh pressure was also evaluated. Results From the histological and ultrastructural analysis, the acellular scaffold treated by 0.1% volume fraction peracetic acid has no obvious difference in tissue construction, biomechanics and cytotoxicity compared with the normal control group. Conclusion This tissue processing of disinfection by 0.1% volume fraction peracetic acid treatment has not obvious effect on the biocmpatibility and biomechanics of the acellular scaffold, and it may be a alternative of disinfector for the acellular bioscaffold preparation.
Tissue engineering blood vessels; Peracetic acid; Acellular vascular scaffold; Disinfection
710003 陕西 西安,西安市中心医院 烧伤整形外科(刘 宾);西安医学院护理学院(李 菲);昆明医学院第二附属医院(张蔓菁);第四军医大学西京医院 整形外科(夏 炜,郭树忠,鲁开化) 第一作者:刘 宾(1978-),男,陕西西安人,副主任医师,副教授,硕士生导师,博士. 通信作者:鲁开化,710003,第四军医大学西京医院 整形外科, 电子信箱:lukaihua@fmmu.edu.cn
实验研究
10.3969/j.issn.1673-7040.2015.09.020
R318
A
1673-7040(2015)09-0567-04
2015-04-23)
