漏斗胸与心房颤动
2015-09-01柳茵孔祥明
柳茵 孔祥明
漏斗胸与心房颤动
柳茵 孔祥明
心房颤动(atrial fibrillation,AF,简称房颤)是临床最常见的心律失常,与严重的临床致残率及增高的致死率有关。房颤的发生随着年龄的增加及心血管的异常而增加,孤立性房颤或60岁前没有心血管危险因素而发生的房颤比较少见且也未认识清楚。目前,普通人群房颤的发生率约1%~2%,而发生了房颤的患者中,约10%~20%是孤立性房颤。
尽管孤立性房颤的病理机制尚未完全阐明,但认为是多因素的,有基因易感体质的患者在内外因素的刺激下触发了房颤。无论是局部还是全身炎症,都认为与孤立及非孤立房颤有关,炎症在孤立性房颤的发展中可能起了扳机作用。而且潜在的结构性因素也可能使个体易患孤立性房颤。
漏斗胸是最常见的先天性胸廓畸形,新生儿中发生率约为1:800到1:1000,它可以使右心房、右心室、及右心室流出道受压,从而导致心脏异常,如心搏量下降,静息性心动过速。漏斗胸患者中二尖瓣脱垂的发生率也增加,这些心脏异常已明确与活动耐量下降有关,经手术矫正后可改善(图1)。猜测漏斗胸可能是通过心脏受压或某个共同基因的异常而与孤立性房颤的发生有关。为了证实这个假设,Nicole T.Tran等回顾了SMART(Symptom Mitigation in Atrial Fibrillation)研究,该研究纳入患者的胸部CT结果,比较了其在孤立性房颤、非孤立性房颤,及对照组中漏斗胸的发生率及严重程度。
1 SMART研究特点
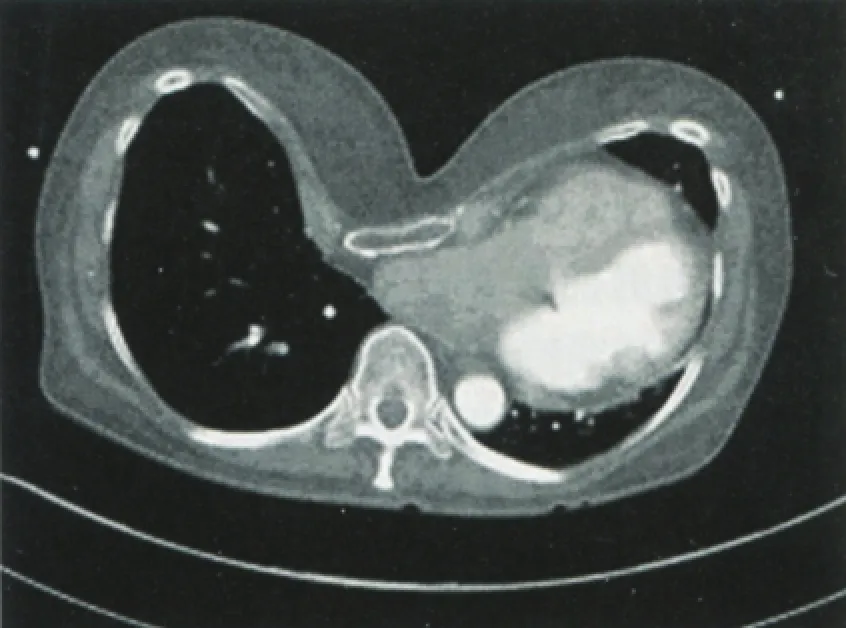
图1 孤立性房颤患者存在严重漏斗胸改变
SMART研究是关于美国北卡罗来纳院外患者房颤症状和健康结果的前瞻性队列研究。
来自2008~2012年,于美国北卡罗来纳心电生理中心就诊,共525位参加者纳入SMART研究,其中220位接受了射频消融术治疗房颤,每位接受消融治疗的患者术前均查胸部CT,这些图像分析可明确每位患者漏斗胸的发生率及严重程度。所有接受消融治疗的患者均纳入该研究。对照组225例要求18岁以上,均接受胸部CT检查,排除房颤史,明确每位入选患者的基础临床特征。
孤立性房颤主要的预测变量,孤立性房颤定义为没有其他房颤危险因素且在60岁前发生了至少1次有记录的房颤。房颤危险因素为:心力衰竭、高血压、糖尿病、冠心病、甲状腺疾病、慢性阻塞性肺病、睡眠呼吸暂停综合征、低氧血症或其他包括先天性异常在内的心肺疾病,排除心脏瓣膜病。
患者分为3组:孤立性房颤组,非孤立性房颤组,对照组。对SMART研究队列中的不符合上述孤立性房颤定义的患者归类为非孤立性房颤组。
2 漏斗胸畸形程度指数
漏斗胸畸形程度指数(pectus severity index,PSI)作为主要的连续性结果变量,有以下四种表现:无、轻、中、重度漏斗胸(图2)。
3 SMART研究的结果
从2008~2012年,在SMART研究中确认了连续纳入220例接受射频消融术治疗的房颤患者,再确认225例对照组,房颤组患者年龄较对照组大(60.8岁±11.7岁 vs. 56.1岁±16.3岁)而且男性更多(70.5% vs. 36.4%)。房颤组患者白种人更多(91.5% vs. 66. 5%,P<0.01)。房颤患者并发症发生率更高,包括高血压、冠心病、心衰、心脏瓣膜病和阻塞性睡眠呼吸暂停症。和非孤立性房颤组患者比较,如前定义的孤立性房颤组患者没有如上的并发症。孤立性房颤组患者年龄也较非孤立性房颤组患者轻(49.5岁±12.0 岁 vs. 63.4岁±10.0岁)。与对照组比较,孤立性房颤组和非孤立性房颤组患者男性更多(分别是68.3%和71.0%)。有严重漏斗胸患者(PSI>3.25)与没有严重漏斗胸患者的基线特点如冠心病、高血压、糖尿病、脑血管病、CABG、PCI、心力衰竭、慢性阻塞性肺病等没有差异。
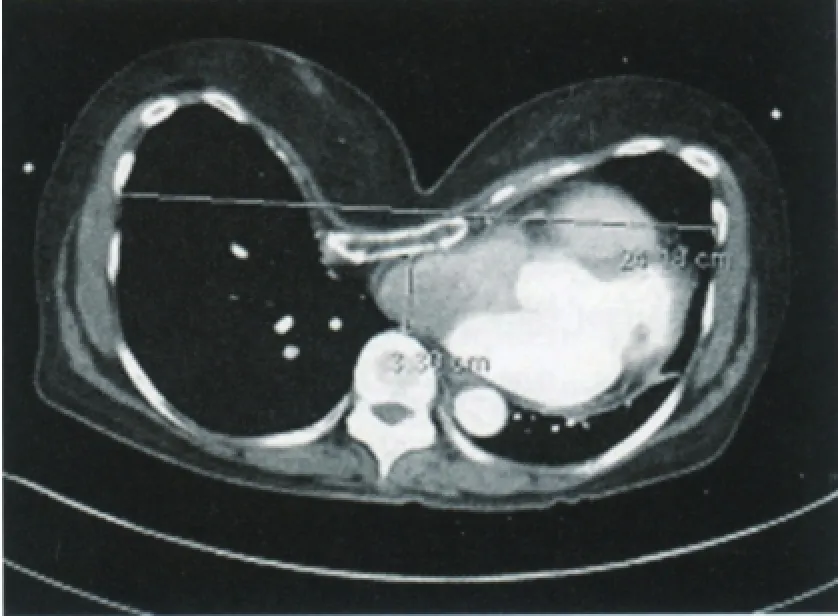
图2 用Haller方法计算PSI(漏斗胸严重程度指数)。即最大跨胸廓横向内径除以胸廓压迫最低点处前后内径
4 孤立性房颤与漏斗胸分型
漏斗胸患者:轻度PSI值>2.5,中度PSI值>2.8,重度:PSI值>3.25。SMART研究表明与非孤立性房颤组及对照组比较,孤立性房颤组患者至少存在轻度漏斗胸的百分比例明显增高(P<0.01)。孤立性房颤组患者存在中度漏斗胸(PSI值>2.8)的百分比例也有统计学意义的显著增高(P<0.01)。而且,孤立性房颤组患者存在重度漏斗胸的百分比例也有显著增高(P<0.01)。
在所有房颤患者的队列中,存在严重漏斗胸中,孤立性房颤的发生较非孤立性房颤或对照组更普遍。而在非严重漏斗胸患者中,孤立性房颤的发生较非孤立性房颤则更少。在没有中度漏斗胸的患者中,孤立性房颤的发生远较非孤立性房颤少。综合比较,没有轻度漏斗胸的患者中孤立性房颤的发生远较非孤立性房颤少。
5 孤立性房颤心脏结构改变
SMART研究对174例房颤患者经心脏超声评价了射血分数,左房大小,二尖瓣关闭不全严重程度,二尖瓣脱垂等情况的数据。在孤立性房颤组和非孤立性房颤组射血分数没有显著差异。非孤立性房颤组左房大小较孤立性房颤组显著较大(4.6±0.75 vs. 3.7± 0.61,P<0.01)。非孤立性房颤组患者二尖瓣反流分级程度较孤立性房颤组显著较高(0.69±0.52 vs. 0.48 ±0.47,P=0.04)。在孤立性房颤组中,尽管二尖瓣脱垂的情况有增加的趋势,但没有达到显著的统计学差异(分别为37,5%和21.8%;P=0.063)。
SMART研究分析了445例患者,发现较非孤立性房颤组和对照组比较,孤立性房颤组明显更易于合并根据PSI值限定的轻中重程度的漏斗胸。与非孤立性房颤组和对照组比较,孤立性房颤组PSI值明显增高。即使校正了潜在的干扰因素,与非孤立性房颤组和对照组比较,孤立性房颤组严重漏斗胸(PSI>3.25)的发生率高达5倍以上。在有轻中重程度漏斗胸的患者中,孤立性房颤的比例较没有漏斗胸的患者明显增高。尽管曾经报道二尖瓣关闭不全与漏斗胸伴发,在我们的研究中,这种关联不能够用二尖瓣关闭不全解释。据我们所知,这是首次报道漏斗胸与孤立性房颤间潜在的联系。
6 漏斗胸与孤立性房颤展望
漏斗胸与孤立性房颤进展的联系有几种可能的解释,漏斗胸可导致右心房和右心室流出道被胸骨压迫,左心房被脊椎压迫,心脏向左侧横向移位。无论患者有无这种心律失常的易患性,左心房的机械性压迫可以激活房颤的发生,这类似于有人提出的吞咽性房颤,可能的机制是由于吞咽过程中对左心房的机械刺激导致的迷走反射有关。
还有认为二尖瓣反流可能与孤立性房颤的进展有关,Shasrma等用经食管超声评价57例孤立性房颤患者与100例对照组发现,66%孤立性房颤患者存在未被临床识别的二尖瓣反流。几项研究证实漏斗胸患者中二尖瓣脱垂的发生率较高。我们猜测未被认识的漏斗胸患者发生二尖瓣反流的机制可能与这些患者中房颤的进展有关。然而,我们用经胸心脏超声分析房颤组中在二尖瓣反流程度和二尖瓣脱垂表现情况上,孤立性房颤与非孤立性房颤两者间没有显著差异。所有孤立性房颤患者有轻到中度二尖瓣反流归因于心律失常的进展。
漏斗胸患者由于右心房右心室受压,右心室充盈量减少导致右心室收缩功能和搏出量下降,为了维持正常心排量,漏斗胸患者交感神经系统激活而产生代偿性静息性窦性心动过速,漏斗胸患者增加的交感神经系统活性可能激活了易感患者孤立性房颤的进展。
还有一可能是漏斗胸和孤立性房颤存在潜在的共同基因突变。如胶原蛋白的产生异常可导致骨骼异常和心房纤维化。目前的看法是孤立性房颤的进展是由于患者这种未被完全理解的心律失常进展的遗传倾向性激活的过程。依据亲属受影响数目和年龄不同,有阳性家族病史个体易发展为孤立性房颤的危险性约为3.5倍到>80%。Olesen等发现40岁以前为孤立性房颤者与3个单核苷酸多态性有关。尽管目前在孤立性房颤和非孤立性房颤的基因研究中,已经识别出与心肌形态学,体外发育,心肌离子通道表达有关的候选基因,对房颤遗传学基础更加全面的了解,可能会有助于揭示由潜在基因突变连接的漏斗胸与房颤的联系。
研究证明在漏斗胸患者中,孤立性房颤比率较非孤立性房颤比率是增加的。另外,今后需要漏斗胸患者孤立性房颤进展的大型前瞻性队列研究来进一步证实这些发现。
总之,孤立性房颤患者、非孤立性房颤患者及没有房颤病史的对照组患者,将近2/3的孤立性房颤患者经胸部CT发现合并最少轻度的漏斗胸,17%患者发现合并重度的漏斗,即使校正了潜在的干扰因素,与非孤立性房颤组及对照组相比这种患病率的显著不同仍然持续存在。这种联系的潜在机制包括共同的基因异常,心脏结构的直接压迫,或由于心腔受压后交感神经活性的增加。然而,还需要进一步的研究来证实这种联系和阐明潜在的机制。
[1] Olesen MS,HolstAG,JabhariJ,et al. Genetic loci on chromosomes 4q25,7p31,and 12p12 are associated with onset of lone atrial fibrillation before the age of 40 years.Can J Cardiol,2012,28:191-195.
[2] Oyen N,Ranthe MF,Carstensen L,et al. Familial aggregation of lone atrial fibrillation in young persons. J AmCoil Cardiol,2012,60:917-921.
[3] Henningsen KM,Olesen MS,Pedersen M,et al.singlenucleotidepolymorphisms in inflammatory genes and the risk of early onset of lone atrial fibrillation.Inflamm Res,2010,59:965-969.
[4] Daunt SW,Cohen JH,Miller SF. Age-related normal ranges for the Haller index in children. Pediatr Radiol,2004,34:326-330.
[5]Wu TH,Huang TW,Hsu HH,et al. Usefulness of chest images for the assessment of pectusexcavatum before and after a Nuss repair in adults. EurJ CardioThorac Surg,2013,43:283-287.
[6] Brochhausen C,TurialS,MullerFK,et al. Pectus excavatum:history,hypotheses and treatment options. InteractCardiovascThoracSurg,2012,14:801-806.
[7] Fonkalsrud EW. 912 open pectus excavatum repairs:changing trends,lessons learned:one surgeon’s experience.World J Surg,2009,33:180-190.
[8]Saxena AK,Willital GH. Valuable lessons from two decades of pectus repair with the Willital-Hegemarm procedure. J Thorac Cardiovasc Surg,2007,134:871-876.
[9]Dean C,EtienneD,HindsonD,et al. Pectus excavatum(funnel chest):a historical and current prospective.Surg Radiol Anat,2012,34:573-579.
[10]Frantz FW. Indications and guidelines for pectus excavatum repair. Curr Opin Pediatr,2011,23:486-491.
R541.75
A
2095-4220(2015)03-0140-03
2015-05-01)
(本文编辑:崔俊玉)
266071 青岛,青岛大学附属医院
