升清降浊方对MSG肥胖大鼠脂代谢的影响及机制研究*
2015-08-27张德芹黄春丽张青霞周文龙
杜 娟,张德芹,文 静,黄春丽,张青霞,周文龙,刘 花
·实验研究·
升清降浊方对MSG肥胖大鼠脂代谢的影响及机制研究*
杜娟,张德芹,文静,黄春丽,张青霞,周文龙,刘花
(天津中医药大学中医药研究院,天津300193)
[目的]研究升清降浊方(SQJZF)对L-谷氨酸钠(MSG)肥胖大鼠脂代谢的影响及其机制研究。[方法]复制MSG肥胖大鼠模型,随机分为模型组、阳性药罗格列酮组、阳性药非诺贝特组、SQJZF高剂量组(含生药6 g/kg)、SQJZF中剂量组(含生药3 g/kg)、SQJZF低剂量组(含生药1.5 g/kg);另取正常组大鼠8只。连续给药50 d后,分别检测大鼠肝脏脂质和血清游离脂肪酸的含量;实时定量聚合酶链反应(PCR)检测药物对MSG大鼠肝脏中过氧化物酶体增殖物激活受体α(PPAR α)、脂蛋白脂肪酶(LPL)、载脂蛋白A-Ⅴ(ApoA-Ⅴ)、载脂蛋白C-Ⅲ(ApoC-Ⅲ)的基因表达水平。[结果]模型组MSG大鼠肝脏总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)和血清游离脂肪酸(NEFA)含量显著升高(P<0.05或P<0.01),肝脏高密度脂蛋白(HDL-C)含量显著降低(P<0.01);肝脏PPARα、LPL基因的相对表达量降低,ApoA-Ⅴ基因的相对表达量显著降低(P<0.01),ApoC-Ⅲ基因的相对表达量升高;给药50 d后,各给药组肝脏TC、TG、LDL-C和NEFA含量降低(P<0.05或P<0.01),肝脏HDL-C含量升高(P<0.05或P<0.01);对相关基因的相对表达均有一定的调节作用。[结论]SQJZF对MSG大鼠可能通过激活PPAR受体调控脂蛋白代谢来控制MSG肥胖大鼠脂代谢紊乱。
升清降浊方;L-谷氨酶钠肥胖大鼠;脂代谢
DOI:10.11656/j.issn.1672-1519.2015.11.08
过氧化物酶体增殖物激活受体(PPARs)属于非甾体类核受体超家族的转录因子,调控糖、脂代谢多种关键基因的表达[1],有3种不同的亚型[2],分别具有不同的组织分布和代谢调节功能[3]。其中,过氧化物酶体增殖物激活受体α(PPARα)是机体脂质代谢的重要调节因子,主要表达于啮齿类动物的肝脏,其次是骨骼肌与脂肪。以氯贝特和非诺贝特为代表的贝特类PPARα激动剂作为降脂药已经应用于临床达数十年,通过PPARα调节脂蛋白氧化基因的表达是贝特类降脂药的分子作用靶点[4]。本次实验通过复制L-谷氨酸钠(MSG)肥胖大鼠,检测MSG大鼠肝脏中的脂质水平和与脂蛋白相关基因的表达水平,来研究升清降浊方对MSG肥胖大鼠脂代谢的影响及机制研究,并且为进一步确定升清降浊方调脂机制做铺垫。
1 材料
1.1实验动物Wistar孕鼠24只,由天津实验动物中心提供,合格证号SCXK(津)2010-0002。孕鼠单笼饲养于天津中医药大学实验动物中心,屏障环境,温度(22±2)℃,湿度50%~60%。
1.2饲料高脂饲料配方为10%猪油,1.5%胆固醇,0.25%胆盐,10%蔗糖,78.25%基础饲料,由北京诺康源生物科技有限公司提供。
1.3药物升清降浊方:棕色干膏粉,出膏率为100g生药含干膏粉11.11 g(每克干膏粉的生药含量为9.00 g),批号:2010911,由天津中医药大学中医药研究院药学部提供。阳性对照药罗格列酮[葛兰素史克(天津)有限公司,批号:10125188],阳性对照药非诺贝特(Laboratoires FOURNIRE S.A.,批号:15135),MSG(美国Sigma-Aldrich,批号:BCBF3631V)。
1.4试剂胆固醇(TC)试剂盒(批号:111241),甘油三酯(TG)试剂盒(批号:114871),以上所用试剂盒均由中生北控生物科技股份有限公司提供。游离脂肪酸(NEFA)试剂盒(日本Wako公司,批号:DBJ5786),Trizol试剂(美国Invitrogen公司,批号:l15596018),SYBR Green PCR Master Mix试剂盒(美国Applied Biosystems公司,批号:4367659),High Capacity cDNA Reverse Transcription Kit试剂盒(美国Applied Biosystems公司,批号:4368814),引物合成(北京鼎国昌盛生物技术有限责任公司,批号:201205)。
1.5实验仪器ALLEGRA-64R高速离心机(美国BECKMAN COULTER有限公司),Infinite M200微量多功能读板机(瑞士Tecan公司),DU-530紫外分光光度计(美国BECKMAN COULTER有限公司),FlexStation3多功能微孔板分析仪(美国Molecular Devices公司),PC-1000 PCR逆转录仪(美国PERKIN ELMER仪器公司),7500 Real-Time PCR system实时荧光定量PCR仪(美国Applied Biosystems公司)。
2 方法
2.1模型的建立取Wistar孕鼠24只,饲养于清洁级动物房。新生鼠于出生第2天起,皮下注射MSG,注射剂量3 g/kg[5],正常组注射等量生理盐水,每隔1 d注射1次,连续7次。21 d后断乳,MSG组及正常组均按雌雄分笼饲养,正常组给予普通饲料,MSG模型组给予高脂饲料。定期记录体质量,观察体型变化。第8周时,禁食不禁水8 h检测空腹血脂的含量及糖耐量2 h后血糖,以血脂含量和糖耐量2 h血糖高于正常组为成模标准。
2.2分组给药筛选成模雄性大鼠48只,采用随机区组法随机分为模型组、罗格列酮组、非诺贝特组、升清降浊方高、中、低剂量组(含生药6、3、1.5 g/kg)6组,每组8只。另取Wistar雄性大鼠8只为正常组。罗格列酮组给药剂量为5 mg/kg[6],非诺贝特组给药剂量为100 mg/kg[7],SQJZF高剂量组给药剂量为含生药6 g/kg,SQJZF中剂量组给药剂量为含生药3 g/kg,SQJZF低剂量组给药剂量为含生药1.5 g/kg,灌胃体积为10 mL/kg,正常组和模型组灌胃同体积5%阿拉伯胶水溶液。每日上午灌胃1次,连续灌胃50 d。每周称体质量1次,给药50d后,根据体质量调整用药剂量。
2.3标本采集给药8周后大鼠禁食(不禁水)8 h,3.5%水合氯醛腹腔注射麻醉,腹主动脉采血并离心取血清,迅速剖去肝脏和骨骼肌,液氮速冻后一并移入-80℃冰箱冷贮备用。
2.4检测方法
2.4.1肝脏脂质检测取肝脏组织300 mg,生理盐水洗净,准确称取重量,加9倍量(g/mL)的乙醇-丙酮(1∶1)溶液,组织匀浆后,静置提取24 h,离心,取上清,应用TECAN多功能读板机采用终点法505 nm波长下读取吸光度(A),计算总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)和低密度脂蛋白(LDL-C)的含量,并换算到单位为mg/g组织。
2.4.2血清游离脂肪酸检测采用酶学比色法(ACS·ACOD)550 nm波长下读取吸光度(A),并计算血清NEFA含量。
2.4.3RT-PCR检测基因的表达肝脏组织研磨后,Trizol法提取总RNA,检测RNA样品纯度符合实验要求。每10 μL体系2 000 ng总RNA为模板进行逆转录合成cDNA。逆转录条件:25℃,10 min;37℃,120 min;85℃,5 min,4℃,∞,-20℃保存。取2 μL cDNA进行实时定量PCR,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,加入上下游引物各0.5 μL,SYBR Green PCR Master Mix10 μL,无酶双蒸水补足至总反应体系20 μL,于PCR仪中进行反应。用2-△△CT方法计算各基因的表达水平。引物序列见表1。

表1 RT-PCR引物序列Tab.1 Primer sequences for real-time PCR
2.5统计方法采用SPSS18.0软件分析,计量资料均以均数±标准差(x±s)表示,正态分布计量资料组间比较采用单因素方差分析(One-way ANOVA),组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett’s T3法,偏态分布计量资料组间比较采用秩和检验,P<0.05为差异有统计学意义。
3 结果
3.1对血清NEFA的影响模型组MSG大鼠血清NEFA含量与正常组相比显著升高(P<0.01);给药50 d后,与模型组MSG大鼠相比,各给药组均显著降低血清中NEFA的含量(P<0.01)。见表2。
3.2对肝脏脂质的影响模型组MSG大鼠肝脏TC、TG和LDL-C的含量与正常组相比显著升高(P<0.01),HDL-C的含量与正常组相比显著降低(P<0.01);给药50 d后,与模型组MSG大鼠相比,各给药组均显著降低肝脏TC、TG和LDL-C的含量(P<0.05或P<0.01),罗格列酮组和SQJZF高、中和低剂量组均升高肝脏HDL-C的含量(P<0.05或P<0.01)。见表2。
3.3对脂蛋白代谢相关基因表达的影响模型组MSG大鼠肝脏PPARα,LPL基因的相对表达量降低,载脂蛋白A-V(ApoA-Ⅴ)基因的相对表达量显著降低(P<0.01),载脂蛋白C-Ⅲ(ApoC-Ⅲ)基因的相对表达量升高;给药50 d后,与模型组MSG大鼠相比,非诺贝特组,SQJZF高、中和低剂量组均显著升高肝脏PPARα基因的相对表达量(P<0.01);罗格列酮组、非诺贝特组,SQJZF中、低剂量组均升高肝脏LPL基因的相对表达量(P<0.01);罗格列酮组,SQJZF高、中剂量组均升高肝脏ApoA-Ⅴ基因的相对表达量(P<0.01);非诺贝特组,SQJZF中、低剂量组均降低肝脏ApoC-Ⅲ基因的相对表达量(P<0.01)。见表3。
表2 给药50 d后MSG大鼠肝脏脂质和血清NEFA含量(±s)Tab.2 Contents of liver lipid and NEFA in MSG rats after 50 days of administration(±s)
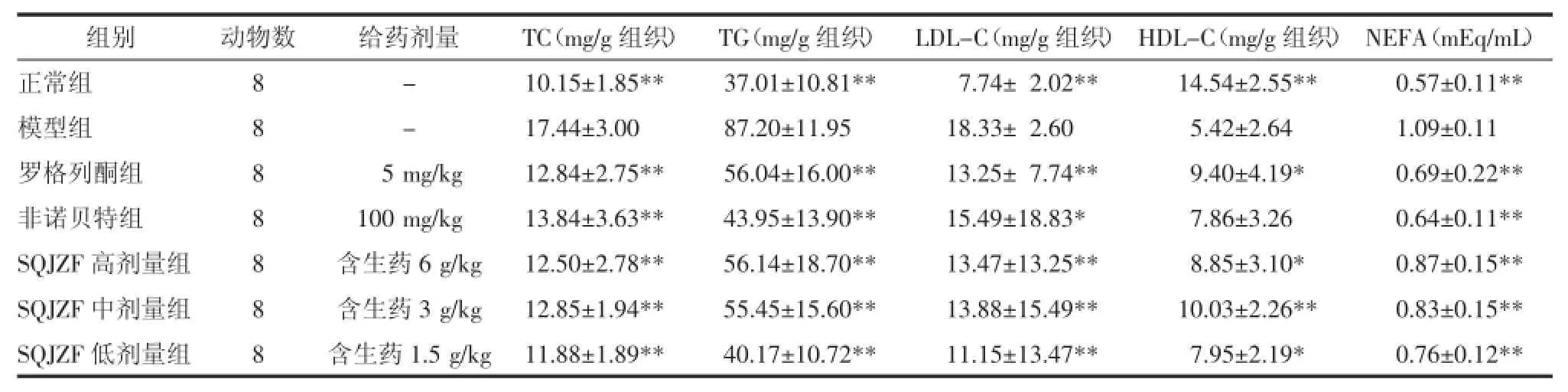
表2 给药50 d后MSG大鼠肝脏脂质和血清NEFA含量(±s)Tab.2 Contents of liver lipid and NEFA in MSG rats after 50 days of administration(±s)
注:与模型组比较,*P<0.05,**P<0.01。
组别正常组模型组罗格列酮组非诺贝特组SQJZF高剂量组SQJZF中剂量组SQJZF低剂量组动物数8 8 8 8 8 8 8给药剂量TC(mg/g组织)TG(mg/g组织)LDL-C(mg/g组织)HDL-C(mg/g组织)NEFA(mEq/mL)-10.15±1.85**37.01±10.81**07.74±02.02**14.54±2.55**0.57±0.11** -17.44±3.0087.20±11.9518.33±02.6005.42±2.641.09±0.11 005 mg/kg12.84±2.75**56.04±16.00**13.25±07.74**09.40±4.19*0.69±0.22** 100 mg/kg13.84±3.63**43.95±13.90**15.49±18.83*07.86±3.260.64±0.11**含生药6 g/kg12.50±2.78**56.14±18.70**13.47±13.25**08.85±3.10*0.87±0.15**含生药3 g/kg12.85±1.94**55.45±15.60**13.88±15.49**10.03±2.26**0.83±0.15**含生药1.5 g/kg11.88±1.89**40.17±10.72**11.15±13.47**07.95±2.19*0.76±0.12**
表3 给药50 d后MSG大鼠肝脏脂蛋白代谢相关基因的表达(±s)Tab.3 Relative expression of lipoprotein metabolism in the liver in MSG rats after 50 days of administration(±s)

表3 给药50 d后MSG大鼠肝脏脂蛋白代谢相关基因的表达(±s)Tab.3 Relative expression of lipoprotein metabolism in the liver in MSG rats after 50 days of administration(±s)
注:与模型组比较,*P<0.05,**P<0.01。
组别正常组模型组罗格列酮组非诺贝特组SQJZF高剂量组SQJZF中剂量组SQJZF低剂量组动物数8 8 8 8 8 8 8给药剂量PPARα基因LPL基因ApoA-Ⅴ基因ApoC-Ⅲ基因相对表达量相对表达量相对表达量相对表达量-1.01±0.1201.02±0.241.00±0.02**1.01±0.18 -0.84±0.0900.58±0.200.61±0.051.08±0.14 05 mg/kg1.02±0.0801.61±0.20**0.91±0.09**0.68±0.22 100 mg/kg1.47±0.12**21.54±2.84**0.25±0.12**0.22±0.12**含生药6 g/kg1.56±0.23**00.57±0.370.87±0.06**0.95±0.06含生药3 g/kg1.93±0.17**01.51±0.21**1.49±0.15**0.67±0.10**含生药1.5 g/kg2.09±0.13**04.72±0.54**0.41±0.140.69±0.11**
4 讨论
升清降浊方来源于临床经验方,由荷叶、桑叶、山楂叶等中药组成,该方在长期的临床应用中,对糖尿病前期合并高脂血症患者具有显著疗效。本课题组前期研究中表明,升清降浊方对实验性大鼠、小鼠和KK-Ay小鼠均有调节糖脂代谢的作用[8-11],并且对高血脂家兔糖脂代谢以及组织病理学均具有调节作用[12-14]。本次实验选用MSG大鼠作为实验动物模型。20世纪70年代,由Bunyan开始研究谷氨酸单钠盐对新生鼠脂质代谢及内分泌的影响。2 d龄Wistar大鼠皮下注射谷氨酸单钠盐[15],成年后可形成严重的向心性肥胖和糖脂代谢紊乱,导致明显的高胰岛素血症、高血脂、脂肪肝并伴有糖耐量异常和胰岛素抵抗,是一种具有典型代谢综合征特征的实验动物模型[16]。
本次实验显示,给药50 d后,MSG大鼠肝脏中TC、TG和LDL-C水平显著降低,HDL-C水平显著升高。脂蛋白代谢相关基因表达水平均升高。PPARα与TC、TG、HDL和LDL-C的代谢密切相关。大量研究证明,PPARα激动剂贝特类降脂药非诺贝特的主要治疗作用是通过降低机体内极低密度脂蛋白(VLDL)的产生和增加TG的代谢,间接的减少LDL、HDL以及清除肝脏及血液中的TC。贝特类降脂药非诺贝特对VLDL与乳糜微粒(CM)中的TG水解作用很强,因为PPARα激活后,可以上调脂蛋白脂肪酶(LPL)在肝脏、骨骼肌和脂肪中的活性及表达[17]。LPL是外周血管TG的水解酶关键因子,它可以加速含TG丰富的脂蛋白的分解,它的失活将会导致严重的高TG血症和低HDL血症,即所谓的高脂血症。然而以ApoC-Ⅲ为代表的载脂蛋白C类能够抑制LPL的活性及表达[18],已有研究证实,ApoC-Ⅲ的高表达小鼠TG大幅增高。PPARα激动剂贝特类药物在动物和人的治疗中都可以减少ApoC-Ⅲ的合成,因此,有效地增加VLDL的降解以及空腹血清TG的水平,进一步提高LPL的活性。总之,PPARα可以通过其转录激活脂蛋白的作用,减少TG的产生,增加TG的降解,促进HDL的代谢和TC外流到肝脏,从而使全身血脂维持正常水平,从而达到调控脂代谢的作用。
[1]Issemann I,Green S.Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J].Nature,1990,347(6294):645-650.
[2]VamecqJ,LatruffeN.Medicalsignificanceofperoxisome proliferators activated receptors[J].Lancet,1999,354(9173):141-148.
[3]Osumi T,Ishii N,Miyazawa S,et al.Isolation and structural characterization of the rat acyl-CoA oxidase gene[J].J Biol Chem,1987,262(13):8138-8143.
[4]Fu J,Gaetani S,Oveisi F,et al.Oleylethanolamide regulates feeding and body weight through activation of the nuclear receptor PPAR-alpha[J].Nature,2003,425(6953):90-93.
[5]Bunyan J,Murrell EA,Shah PP.The induction of obesity inrodents bymeans ofmonosodium glutamate[J].Br JNutr,1976,35(1):25-39.
[6]李平平.PAPRα/γ双激动剂西格列梭对胰岛素抵抗和脂质紊乱的改善作用及其作用机制研究[D].北京:中国协和医科大学中国医学科学院,2006:85.
[7]董爱梅,郭晓蕙,王薇.非诺贝特对胰岛素抵抗大鼠肝脏脂肪酸氧化的影响[J].山东医药,2009,49(13):31-33.
[8]王威,三浦俊宏,史红,等.复方中药糖脂清对KK-Ay小鼠糖脂代谢影响的机制探讨[J].天津中医药,2008,25(3):223-224.
[9]李玉红,张德芹,王茜,等.糖脂清对实验性2型糖尿病大鼠糖、脂代谢的影响[J].天津中医药大学学报,2010,29(2):77-79.
[10]李玉红,张德芹,刘虹,等.糖脂清对四氧嘧啶糖尿病小鼠糖、脂代谢的影响[J].天津中医药大学学报,2009,28(4):185-187.
[11]Jia Nan Xia,De Qin Zhang,Juan Du.et al.Regulation effects of TZQ-F on adipocyte differentiation and insulin action[J].Journal of Ethnopharmacology,2013,150(2):692-699.
[12]王茜,张德芹,李玉红,等.糖脂清对实验性高胆固醇血症家兔脂代谢的影响[J].中国实验方剂学杂志,2009,15(6):41-43.
[13]柳占彪,李玉红,张少卓,等.三叶糖脂清对高胆固醇血症家兔主动脉粥样硬化的组织病理学影响[J].中药药理与临床,2011,27(3):101-102.
[14]柳占彪,李玉红,张少卓,等.糖脂清对高脂血症家兔糖脂代谢及肝组织的影响[J].中国实验方剂学杂志,2011,17(15):135-138.
[15]Iwase M,Yamamoto M,Iino K,et al.Obesity induced by neonatal monosodium glutamate treatment in spontaneously hypertensive rats: an animal model of multiple risk factors[J].Hypertens Res,1998(21):1-6.
[16]Ding SY,Shen ZF,Xie MZ.Preliminary study of insulin resistance induced by neonatal monosodium glutamate treatment in normalW istar rats[J].Chin PhamacolBull,2001(17):181-185.
[17]Kristina S,Julia P,Anne L,et al.PPAR and PPAR activators direct a distinct tissue-speciffic transcriptional reponse via a PPRE in the lipoprotein lipase gene[J].The EMBO,1996(15):5336-5348.
[18]Rachel H,Janette BS,Jacob BT.Mode of peroxisome proliferators as hypolipidmic drugs[J].Biol chem,1995(270):13470-13475.
(本文编辑:高杉,滕晓东)
Effects of Shengqing Jiangzhuo formula to improve the insulin sensitivity of MSG rats
DU Juan,ZHANG De-qin,WEN Jing,HUANG Chun-li,ZHANG Qing-xia,ZHOU Wen-long,LIU Hua
(Traditional Chinese Medicine Research Institute,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
[Objective]To study the mechanisms and effects of Shengqing Jiangzhuo formula(SQJZF)to improve the lipid metabolism of MSG rats.[Methods]Copy the MSG obese rat models,which were randomly divided into model group,rosiglitazone group,fenofibrate group,three dose of SQJZF.Then choose 8 normal rats as the normal control group.Measure the levels of liqid in liver and the level of NEFA in serum after administration for 50 days.Real-time PCR detect the expression level of PPAR,LPL,ApoA-Ⅴ,A poC-Ⅲin liver.[Results]Compared with the normal group,the model group improved the level of TC,TG,LDL-C in liver and the level of NEFA in serum and decreased the level of HDL-C in liver significantly(P<0.05 or P<0.01),and decreased the expression of PPAR,LPL,ApoA-Ⅴsignificantly(P<0.01),and improved the expression of ApoC-Ⅲ.Compared with the model group,each of groups had some improvements of the level of liqid in liver and the level of NEFA and the level of genes expression.[Conclusion]SQJZF improve the lipid metabolism disorders in MSG rats which by activating the genes expression of PPAR.
Shengqing Jiangzhuo formula;MSG rat;lipid mechanism
R589.2
A
1672-1519(2015)11-0668-04
国家自然科学基金项目(81173373)。
杜娟(1987-),女,硕士研究生,从事中药基本理论及临床应用研究。
张德芹,E-mail:deqin123@163.com。
(2015-06-15)
