类风湿关节炎患者血清HMGB1及TGF-β1的表达及意义
2015-08-26贾治林
何 蛟,贾治林
(1.大连医科大学附属第一医院 图书馆,辽宁 大连 116011; 2.大连医科大学附属第一医院 血液内科,辽宁 大连 116011)
类风湿关节炎患者血清HMGB1及TGF-β1的表达及意义
何蛟1,贾治林2
(1.大连医科大学附属第一医院 图书馆,辽宁 大连 116011; 2.大连医科大学附属第一医院 血液内科,辽宁 大连 116011)
目的探讨类风湿关节炎(RA)血清中的HMGB1和TGF-β1的表达及临床意义。方法112例经确诊的RA患者作为病例组,其中活动期RA患者67例,非活动期RA患者45例,选取健康体检者80人作为对照组。ELISA法测定3组血清中HMGB1及TGF-β1含量。结果活动期RA患者的血清HMGB1水平(59.40±18.74)高于非活动期患者(16.58±6.02)和对照组(13.97±2.43),差异均有显著性意义(P<0.05)。非活动期RA患者和对照组相比,血清HMGB1水平差异无显著性意义(P>0.05)。活动期RA患者(17.13±11.26)和非活动期患者(22.42±13.70)的血清TGF-β1水平均低于对照组(28.35±8.14),活动期RA患者血清TGF-β1水平低于非活动期患者,差异有显著性意义(P<0.05)。结论血清中HMGB1及TGF-β1含量与RA的疾病活动有关,但两者的作用机制仍需要进一步研究。
类风湿关节炎;HMGB1;TGF-β1
[引用本文]何蛟,贾治林. 类风湿关节炎患者血清HMGB1及TGF-β1的表达研究[J].大连医科大学学报,2015,37(2):148-150.
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症为特点的慢性自身免疫性疾病,可导致骨的侵蚀和关节的破坏,造成关节畸形,目前临床上缺乏根治方法,预后较差[1]。新近研究显示,高迁移率族蛋白-1(high mobility group box chromosomal protein 1,HMGB1)可能在其发生发展中具有重要作用,但其在外周血中的表达存在争议[2]。而转化生长因子-β1(transforming growth factor-β1,TGF-β1)在RA中具有导致RA曲型滑膜改变、加的多重作用[3],但其究竟是以致病作用为主还是保护作用为主仍需要进一步探索。本实验采用病例对照研究设计,双抗体夹心(enzyme-linked immune-sorbent assay,ELISA)法测定RA患者及对照组血清中的HMGB1和TGF-β1,旨在探索两者在RA中的作用,为发掘RA治疗的新方法提供依据。
1 资料与方法
1.1研究对象
以2012年1月1日—2014年6月30日大连医科大学附属第一医院确诊的112例类风湿关节炎作为病例组,所有病例均采用美国风湿病学会(ACR)1987分类标准,且排除4周内使用过激素、非甾体镇痛药的患者及患有感染、肿瘤、严重心脑血管疾病及其它免疫性疾病的患者。病例组中活动期RA患者67例,其中男性19例,平均年龄(55.1±15.4)岁,女性48例,平均年龄(54.3±13.6)岁;非活动期RA患者45例,其中男性14例,平均年龄(52.9±14.3)岁,女性31例,平均年龄(55.4±14.7)岁。选取同地区性别及年龄相近的健康人80人作为对照组,对照组选取的是2013年6月—2014年3月的健康体检者,年龄性别根据文献及前期研究基础确定,其中男性25例,平均年龄(54.6±16.8)岁;女性55例,平均年龄(53.0±17.2)岁。各组之间性别及年龄差异无显著性意义。
1.2研究方法
3组受试对象均于清晨空腹采集新鲜静脉血2 mL,离心分离血清并于-20 ℃保存。
HMGB1及TGF-β1含量的测定采用均ELISA法,严格按照试剂盒提供的方法和流程操作。TMB显色,HMGB1含量的测定用酶标仪在波长450 nm处检测OD值,TGF-β1含量的测定在490 nm处检测OD值。用CurveExpert 1.4软件进行分析,计算标准曲线的直线回归方程式,将OD值带入方程式,求得血清中HMGB1及的TGF-β1实际浓度。
1.3统计学方法
2 结 果
活动期RA患者的血清HMGB1水平显著高于非活动期患者和正常对照组,差异有显著性意义(P<0.05)。非活动期RA患者和正常对照组相比,血清HMGB1水平差异无显著性意义 (P>0.05)。见表1。
活动期RA患者和非活动期患者的血清TGF-β1水平均低于正常对照组,差异有显著性意义(P<0.05)。活动期RA患者血清TGF-β1水平低于非活动期患者,差异有显著性意义(P<0.05)。见表1。
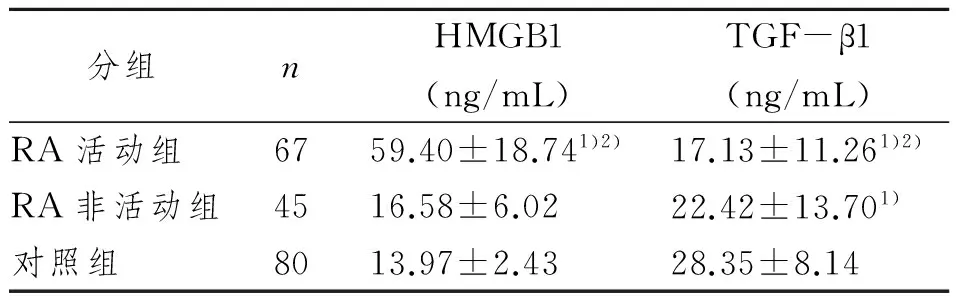
表1 3组对象血清中HMGB1和TGF-β1含量Tab 1 HMGB1 and TGF-β1 of three groups
3 讨 论
类风湿性关节炎(RA)是一种以关节滑膜炎症为特征的慢性自身免疫性疾病。RA的发病机制尚未完全明了,但普遍认为其与细胞因子网络有关,如TGF-β1、HMGB1、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1(interleukin-1,IL-1)等均被认为可能与引起机体炎症反应及组织损伤、调节血管内皮生长、成纤维细胞增生等有密切关系[4]。
HMGB1作为一种新型的炎性细胞因子,与脓毒症、肺炎、败血症、内毒素血症等多种炎性和自身免疫性疾病的发病有关。研究显示,HMGB1在实验性关节炎大鼠的滑膜巨噬细胞及间质内均存在异常表达[5],在RA患者关节液中的含量也明显增高[6],但其在外周血中的表达存在争议。Goldstein等[7]的研究显示,RA患者血清HMGB1含量明显高于正常人(71 ng/ mL vs. 18 ng/mL,P<0.001);但也有学者持不同意见[8]。本研究结果显示活动期RA患者的血清HMGB1水平显著高于非活动期患者和正常对照组,与Goldstein等的研究一致。说明HMGB1可能与RA的发病具有重要关系,同时也提示HMGB1可用于评价RA的病情活动情况。有研究证明血清中的HMGB1可能是从细胞核内分泌而来,通过非典型的、囊介导的分泌通路,由溶血磷脂胆碱激发溶酶体的胞吐作用而产生[9]。也有研究认为其可能来自于巨噬样滑膜细胞的主动分泌或坏死、损伤的细胞[10],但其确切来源目前仍不清楚,作用机制也仍有待于更深入研究。
TGF-β1是一种多功能的细胞因子,可调节细胞生长及分化,对RA具有双重作用。一方面其可以抑制血管内皮细胞增生、调控成纤维细胞生长和拮抗炎性细胞因子,从而维护关节软组织完整性、进行免疫抑制,对RA的治疗和恢复产生积极的作用[11]。有研究显示,全身性应用TGF-β1可能有助于预防和治疗RA,连续腹腔注射7~14 d,可起到防止胶原诱发小鼠关节炎症的作用,显著降低关节炎症的发生。将TGF-β1注射入链球菌壁导致的变态反应性关节炎鼠模型关节腔后,也可显著减轻关节肿胀,单核/巨噬细胞浸润,血管翳形成,骨和软骨破坏[12]。其抗炎症机制可能与TGF-β1作用于内皮细胞,通过抑制E-选择素表达,继而阻断白细胞向炎症部位的粘附和定位有关。另一方面,TGF-β1作为一种强力的单核细胞趋化因子,在炎症早期局部聚集,即可趋化和激活单核细胞,将T细胞吸引至炎症部位,从而加重滑膜炎症,使组织呈现免疫亢进状态,加速RA的发生和发展[13]。研究显示,局部应用TGF-β1会启动并加速炎症反应,将TGF-β1注射入健康大鼠关节腔后,可迅速引起炎症细胞侵润,导致滑膜炎,该作用与TGF-β1上调白细胞粘附分子的表达,促进其粘附和浸润有关。本研究结果显示活动期RA患者和非活动期患者的血清TGF-β1水平均低于正常对照组,且活动期RA患者血清TGF-β1水平低于非活动期患者,这与Valle等[14]的研究一致。这说明TGF-β1主要起免疫抑制作用,其水平下降导致RA患者调节免疫活动的能力下降,可考虑应用TGF-β1进行RA治疗,但其使用方式、用法用量、确切的作用机制等仍需要更多的实验证明。
总之,RA患者血清中HMGB1呈高表达,提示其与RA的发病和病情严重程度密切相关,其确切的作用机制仍有待于更深入研究。RA患者血清中TGF-β1含量较少,其主要发挥免疫抑制作用,仍需要更多的研究来证明其治疗作用。
[1] Schneider M,Krüger K. Rheumatoid arthritisq-early diagnosis and disease management[J].Dtsch Arztebl Int,2013,110(27):477-484.
[2] Harris HE,Andersson U,Pisetsky DS. HMGB1:a multifunctional alarmin driving autoimmune and inflammatory disease[J].Nat Rev Rheumatol,2012,8(4):195-202.
[3] Hussein YM,Mohamed RH,El-Shahawy EE,et al. Interaction between TGF-β1 (869C/T) polymorphism and biochemical risk factor for prediction of disease progression in rheumatoid arthritis[J].Gene,2014,536(2):393-397.
[4] 谢庆云,魏萌,张波,等. 外周血炎性细胞因子与类风湿关节炎[J].中国组织工程研究,2012,16(42):7945-7950.
[5] Chen Y,Sun W,Gao R,et al. The role of high mobility group box chromosomal protein 1 in rheumatoid arthritis[J].Rheumatology (Oxford),2013,52(10):1739-1747.
[6] He Z,Shotorbani SS,Jiao Z,et al. HMGB1 promotes the differentiation of Th17 via up-regulating TLR2 and IL-23 of CD14+monocytes from patients with rheumatoid arthritis[J].Scand J Immunol,2012,76(5):483-490.
[7] Goldstein RS1,Bruchfeld A,Yang L,et al. Cholinergic anti-inflammatory pathway activity and High Mobility Group Box-1 (HMGB1) serum levels in patients with rheumatoid arthritis[J].Mol Med,2007,13(3-4):210-215.
[8] Pullerits R,Urbonaviciute V,Voll RE,et al. Serum levels of HMGB1 in postmenopausal patients with rheumatoid arthritis:associations with proinflammatory cytokines,acute-phase reactants,and clinical disease characteristics[J].J Rheumatol,2011,38(7):1523-1525.
[9] Kaur PP,Derk CT,Chatter Ji M,et al. Septic arthritis caused by Actinobacillus nreae in a patient with rheumatoid arthritis receiving anti-tumor necrosis factor-alpha therapy[J].J Rheumatol,2004,31(8):1663-1665.
[10] Kokkola R,Sundberg E,Ulfgren AK,et al.High mobility group box chromosomal protein 1:a novel proinflammatory mediator in synovitis[J].Arthritis Rheum,2002,46(10):2598-2603.
[11] 高泽斌,马悦,张萍,等. 转化生长因子β 在类风湿关节炎中的作用[J].大连医科大学学报,2002,24(2):144-145.
[12] Li DY,Sorensen LK,Brooke BS,et al.Defective angiogenesis in mice lacking endoglin[J].Science,1999,284(8):1534.
[13] Chang WW,Su H,He L,et al. Association between transforming growth factor-beta1 T869C polymorphism and rheumatoid arthritis:a meta-analysis[J].Rheumatology (Oxford),2010,49(4):652-656.
[14] Muoz-Valle JF,Torres-Carrillo NM,Guzmn-Guzmán IP,et al. The functional class evaluated in rheumatoid arthritis is associated with soluble TGF-β1 serum levels but not with G915C (Arg25Pro) TGF-β1 polymorphism[J].Rheumatol Int,2012,32(2):367-372.
Expression of HMGB1 and TGF-β1 in rheumatoid arthritis
HE Jiao1,JIA Zhi-Lin2
(1.Library,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China;2.DepartmentofHematology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China)
Objective To study the expression of HMGB1 and TGF-β1 in rheumatoid arthritis. Methods Included were 112 rheumatoid arthritis patients(active RA group=67,inactive RA group=45) and 80 healthy persons (control group). Serum HMGB1 and TGF-β1 were measured by ELISA. Results The expression of HMGB1 in active RA group (59.40±18.74)was higher than inactive RA group (16.58±6.02,P<0.05)and control group(13.97±2.43,P<0.05).But no statistical significance was detected between inactive RA group and control group(P>0.05).The expression of TGF-β1 in active RA group (17.13±11.26)was lower than inactive RA group (22.42±13.70)and control group(28.35±8.14). The differences between groups had statistical significance(P<0.05).Conclusion RA is closely related to HMGB1 and TGF-β1.The mechanisms need further study.
rheumatoid arthritis; HMGB1; TGF-β1
论著10.11724/jdmu.2015.02.11
辽宁省科技计划项目(2013225002);大连市科技计划项目(2012E15SF166)
何 蛟(1981-),男,辽宁抚顺人,馆员。E-mail:hejiao_barton@163.com
贾治林,副主任医师。E-mail:jiazl126@163.com
R593.22
A
1671-7295(2015)02-0148-03
2014-12-26;
2015-03-23)
