UPLC-Q-TOF/MS法鉴定大鼠体内甘草素的代谢产物*
2015-08-25李元元江振作张蕾柴欣王跃飞
李元元,江振作,张蕾,柴欣,王跃飞
(1.天津中医药大学,天津市现代中药重点实验室,天津300193;2.天津国际生物医药联合研究院,中药新药研发中心,天津300457)
UPLC-Q-TOF/MS法鉴定大鼠体内甘草素的代谢产物*
李元元1,2,江振作1,2,张蕾1,2,柴欣1,2,王跃飞1,2
(1.天津中医药大学,天津市现代中药重点实验室,天津300193;2.天津国际生物医药联合研究院,中药新药研发中心,天津300457)
[目的]研究甘草素在大鼠体内的代谢产物。[方法]采用静脉注射(iv)、灌胃(ig)两种给药方式,剂量20 mg/kg,收集大鼠血浆、尿液、粪便、胆汁,应用UPLC-Q-TOF/MS法鉴定甘草素的代谢产物。[结果]血浆、尿液、粪便、胆汁样品中共鉴定15种代谢产物,主要有异甘草素、(异)甘草素葡萄糖醛酸结合物和硫酸结合物、二氢异甘草素、二氢异甘草素硫酸结合物、异甘草素甲基化及甘草素脱氢的代谢产物;其主要代谢途径为异构化、葡萄糖醛酸化、硫酸化、甲基化、脱氢反应。[结论]构建的UPLC-Q-TOF/MS法可用于大鼠体内甘草素代谢产物的研究。
甘草素;代谢产物;UPLC-Q-TOF/MS;异构化;葡萄糖醛酸化;硫酸化
甘草为豆科植物甘草Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza inflata Bat.或光果甘草Glycyrrhiza glabra L.的干燥根及根茎;性味甘平,归心、肺、脾、胃经,具有补脾益气、清热解毒、祛痰止咳等功效[1]。甘草素是甘草黄酮的代表性成分,具有抗炎、抑制急性肝损伤、抗肿瘤等作用[2-4]。甘草素的活性及药效与其体内代谢过程密切相关。为进一步研究甘草素体内代谢特征,分离制备甘草素体内代谢产物,本实验采用静脉注射(iv)、灌胃(ig)两种给药方式,应用UPLC-Q-TOF/MS法鉴定大鼠给药后血浆、尿液、粪便、胆汁样品中的代谢产物,共鉴定15种代谢产物。为甘草素代谢产物的制备,同时也为甘草中其他黄酮类成分代谢研究提供有益借鉴。
1 材料
1.1仪器ACQUITYTMUPLC-Xevo G2-S液质联用仪(美国Waters公司,MassLynx V4.1色谱工作站);十万分之一天平(瑞士METTLER TOLEDO公司,型号:XS205);涡旋混合仪(德国IKA公司,型号:VORTEX GENIUS3);真空离心浓缩仪(德国Eppendorf公司,型号:Concentrator plus);高速台式离心机(上海安亭科学仪器厂,型号:TGL-16C);旋转蒸发仪(上海亚荣生化仪器厂,型号:RE-2000);超声波清洗器(天津市恒奥科技发展有限公司,型号:HS615OD);大鼠代谢笼(意大利TECNIPLAST公司)。
1.2试药甘草素(成都普菲德生物技术有限公司,批号:131102);乙腈、甲醇(SIGMA-ALDRICH公司,色谱纯);甲酸(天津市大茂化学试剂厂,色谱纯);聚乙二醇400、D101大孔吸附树脂、95%乙醇(天津市大茂化学试剂厂,分析纯);氯化钠注射液(河北天成药业股份有限公司);超纯水(实验室自制,Milli-Q纯水系统)。
1.3动物SD大鼠,雌性,体质量200~220 g,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2009-0004。动物实验伦理审批号:TJABTJU20140003。
2 方法
2.1甘草素溶液配制取甘草素适量,精密称定,溶于聚乙二醇400-生理盐水(4∶6,v/v)溶液,制成每毫升含5 mg的甘草素溶液[5]。
2.2生物样品采集
2.2.1血浆采集取健康SD大鼠6只,随机分为2组,每组3只,给药前禁食12h,分别iv、ig(20 mg/kg)给药,肝素抗凝,目眦取血。iv组:2、5、10、15、30、45、60、120、240、360、480、600 min;ig组:15、30、60、90、120、240、360、480、600、720 min,-80℃保存。样品处理前,等量混合各时间点血浆[6],备用。
2.2.2尿液、粪便、胆汁采集另取6只健康SD大鼠,随机分为2组,每组3只,置于代谢笼中,分别iv、ig(20 mg/kg)给药,收集给药前、给药后0~24 h尿液、粪便,-80℃保存。大鼠饲养3 d后采集胆汁,给药前禁食12 h,分别iv、ig(20 mg/kg)给药,大鼠腹腔注射20%乌拉坦麻醉,插管引流胆汁,收集0~24 h胆汁,-80℃保存。
2.3生物样品处理
2.3.1血浆样品处理取血浆1.2 mL,加甲酸酸化后(终浓度1%),加入3倍量甲醇,涡旋,14 000 r/min离心10 min。取上清液3.6 mL离心浓缩,加入200 μL 30%甲醇水溶液复溶,涡旋,14 000 r/min离心10 min。取上清液,用30%甲醇水溶液稀释5倍,即得。
2.3.2尿液样品处理取尿液3.5 mL,4 000 r/min离心10 min,取上清液3 mL,加甲酸酸化(终浓度1%),D101大孔吸附树脂纯化,依次用0.1%甲酸水溶液、95%乙醇洗脱[7-8],收集95%乙醇洗脱液,浓缩,加入200 μL 10%甲醇水溶液复溶,涡旋,14 000 r/min离心10 min。取上清液,用10%甲醇水溶液稀释100倍,即得。
2.3.3粪便样品处理取粪便1 g,精密称定,碾碎,加入10倍量50%甲醇水溶液,超声提取30 min,4 000 r/min离心10 min。取上清液9 mL,减压浓缩,10 mL蒸馏水复溶,加甲酸酸化(终浓度1%),D101大孔吸附树脂纯化,依次用0.1%甲酸水溶液、95%乙醇洗脱。收集95%乙醇洗脱液,浓缩,加入200 μL 30%甲醇复溶,涡旋混匀,14 000 r/min离心10 min。取上清液,用30%甲醇水溶液稀释200倍,即得。
2.3.4胆汁样品处理取适量胆汁样品,4 000 r/min离心10 min,取上清液2 mL,用0.1%甲酸水溶液稀释1倍后加甲酸酸化(终浓度1%),D101大孔吸附树脂纯化,依次用0.1%甲酸水溶液、95%乙醇洗脱,收集95%乙醇洗脱液,浓缩,加入200 μL 30%甲醇水溶液复溶,涡旋,14 000 r/min离心10 min。取上清液,用30%甲醇水溶液稀释1 000倍,即得。
2.4分析方法的建立
2.4.1色谱条件色谱柱:ACQUIFY UPLC BEH C18(100×2.1 mm,1.7 μm);流动相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~10 min,5%~35%B;10~15min,35%~95%B;15~17min,95%B;17~17.5 min,95%~5%B;17.5~20 min,5%B;流速:0.4 mL/min;柱温:40℃;进样量:10 μL。
2.4.2质谱条件ESI电喷雾离子源,负离子检测模式;毛细管电压-2 kV;锥孔电压30 V;离子源温度100℃;脱溶剂气温度400℃;锥孔气流量50 L/h;脱溶剂气流量800 L/h;碰撞能量10~60 V;扫描范围m/z 100~1 200;数据采集模式:MSE;数据分析:质量亏损过滤(MDF)。
3 结果
3.1大鼠血浆、尿液、粪便、胆汁样品UPLC-QTOF/MS分析大鼠血浆、尿液、粪便、胆汁样品经UPLC色谱分离,采用MSE扫描模式采集质谱数据,运用Metabolynx软件检索代谢产物。通过代谢产物的准分子离子、特征碎片离子推测代谢产物[9-10]。本实验采用iv和ig给药方式,经分析在大鼠体内共检测到15个代谢产物。大鼠空白及给药后血浆、尿液、粪便、胆汁样品中代谢产物的负离子提取离子流色谱图,如图1所示。甘草素代谢产物质谱鉴定结果见表1。
3.2大鼠体内甘草素代谢产物结构解析甘草素是甘草黄酮的代表性成分,在大鼠体内发生广泛代谢,其主要代谢途径有:异构化、甲基化、脱氢反应、葡萄糖醛酸化、硫酸化。负离子模式下,甘草素及其代谢产物易发生RDA裂解,产生特征性的碎片离子[11-12]。以甘草素为例,甘草素准分子离子为m/z 255.065 8,二级碎片离子m/z 135.008 7,119.050 2,其质谱裂解方式如下所示:

根据不同代谢途径,对大鼠体内代谢产物进行结构解析。
异构化反应(M13、M14):相关文献报道[13]:大鼠给药甘草素、甘草苷后在体内转化成异甘草素和二氢异甘草素。代谢物M13的保留时间为9.95 min,准分子离子m/z 257.081 4,二级碎片离子为m/z 151,与文献报道的二氢异甘草素质谱信息一致,推测M13可能为二氢异甘草素。代谢物M14保留时间为10.29 min,碎片离子与甘草素相同,推测M14可能为异甘草素。
甲基化反应(M15):代谢物M15的保留时间为10.94 min,准分子离子m/z 269.081 5,M15的质量数比(异)甘草素多14,推测可能发生甲基化反应。根据甘草素与异甘草素的色谱保留行为,推测M15可能为异甘草素甲基化的代谢产物。结合碎片离子m/z135,可推测甲基取代位点为异甘草素B环4′位羟基。
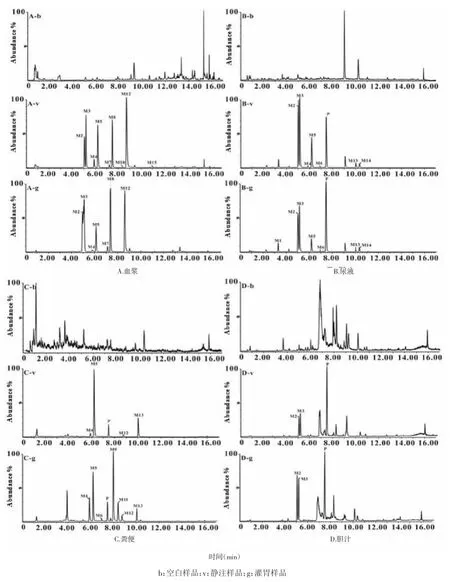
图1 大鼠空白及给药后血浆、尿液、粪便、胆汁提取离子流色谱图Fig.1 The extracted ion chromatogram of blank and administrated plasma,urine,feces and bile in rats
脱氢反应(M6):代谢物M6保留时间为6.87 min,准分子离子m/z 253.050 9,推测M6可能为(异)甘草素脱去2H的代谢产物,碎片离子m/z 209、135、117,结合文献报道[14],推测M6的脱氢反应可能发生在甘草素C环C2-C3。
葡萄糖醛酸结合反应(M1、M2、M3、M7、M8):代谢物M1的保留时间为3.24 min,准分子离子m/z 607.128 8,质量数比(异)甘草素多352,推测可能结合2个葡萄糖醛酸。碎片离子m/z 431、255、175、135、119,其中m/z 255、135、119与(异)甘草素的特征碎片离子相同,根据甘草素与异甘草素的色谱保留行为,推测M1可能为甘草素二葡萄糖醛酸结合物。代谢物M2的保留时间为4.95 min,准分子离子m/z 431.0982,质量数比(异)甘草素多176,碎片离子m/z 255、175、135、119,根据甘草素与异甘草素的色谱保留行为,推测M2可能为甘草素葡萄糖醛酸结合物。代谢物M3、M7、M8的一、二级质谱信息与代谢物M2的一致,因此,可根据甘草素与异甘草素的色谱保留行为,推测代谢物M3可能为甘草素葡萄糖醛酸结合物,M7、M8可能为异甘草素葡萄糖醛酸结合物,具体信息见表1。

表1 甘草素代谢产物质谱鉴定结果Tab.1 The characterization of metabolites of liquiritigenin by mass spectrometry
硫酸结合反应(M4、M5、M9、M10、M11、M12):代谢物M4的保留时间为5.79 min,准分子离子m/z 335.0224,质量数比(异)甘草素多80,碎片离子m/z 255、135、119,根据甘草素与异甘草素的色谱保留行为,推测M4可能为甘草素硫酸结合物。代谢物M5、M10、M12的一、二级质谱信息与代谢物M4的一致,因此,可根据甘草素与异甘草素的色谱保留行为,推测代谢物M5可能为甘草素硫酸结合物,M10、M12可能为异甘草素硫酸结合物。代谢物M9的保留时间为7.91 min,准分子离子m/z 337.0781,碎片离子m/z 257、151与二氢异甘草素的碎片离子相同,推测M9可能为二氢异甘草素硫酸结合物。代谢物M11的一、二级质谱信息与代谢物M9的一致,因此推测代谢物M11可能为二氢异甘草素硫酸结合物,具体信息见表1。
根据以上信息,推测甘草素代谢途径如图2所示。
4 讨论
为了减少生物样品中的基质对质谱检测结果的影响,在样品分析前需进行纯化处理,如:尿液中含有大量的水分、无机盐及含氮物质,胆汁中含有大量的胆汁酸和无机盐[15],粪便中含有大量的食物残渣,可采用大孔树脂进行预处理,使用0.1%甲酸水溶液洗脱,对样品进行脱盐、除杂处理;血浆中富含各种蛋白质会严重干扰质谱检测结果,本研究采用甲醇沉淀蛋白法去除。此外,高分辨质谱的准确度与化合物的浓度息息相关,化合物的浓度过高或过低均会导致检测结果偏差较大。因此,为了准确分析各生物样品中的代谢产物,本研究先将上述纯化后样品浓缩,再根据不同生物样品中代谢产物在质谱仪中的信号强度,调整各样品的浓度,以保证所有生物样品中的代谢产物能被质谱准确检测。

图2 大鼠体内甘草素可能代谢途径Fig.2 The proposed metabolic pathway of liquiritigenin in rats
药物进入机体,经机体处置,最终随尿液、粪便、汗液、乳汁等排出体外。其中尿液和粪便是药物的主要排泄形式,药物通过Ⅰ相、Ⅱ相代谢,改变、增加药物的极性,其中极性较大的化合物随血液流经肾脏,经肾小球滤过,以主动或被动形式随尿液排出体外;极性较小的化合物经肝脏代谢和胆盐一起排入肠道,最终以粪便的形式排出体外。本研究结果:大鼠血浆主要检测到(异)甘草素葡萄糖醛酸结合物和硫酸结合物等;尿液检测到(异)甘草素葡萄糖醛酸结合物和硫酸结合物、异甘草素等;粪便主要检测到原型药物、二氢异甘草素及少量的(异)甘草素硫酸结合物等;胆汁中主要为原型药物及少量的甘草素葡萄糖醛酸结合物。由结果可知,不同生物样品中药物代谢产物类型差异较大,Ⅰ相代谢产物主要存在粪便中,Ⅱ相代谢产物主要存在于血浆、尿液中;此外,为系统研究药物的代谢轮廓,阐明药效物质基础,需同时研究药物在血浆、尿液、胆汁和粪便中的代谢产物。
5 结论
甘草素体内主要代谢部位是肝脏,甘草素经肠粘膜吸收后,在肝药酶的作用下发生Ⅰ相、Ⅱ相代谢反应[16-17]。甘草素在大鼠体内进行广泛代谢,主要发生了异构化、甲基化、脱氢、葡萄糖醛酸结合、硫酸结合反应。
[1]刘洋洋,刘春生,曾斌芳,等.甘草种质资源研究进展[J].中草药,2013,44(24):3593-3598.
[2]张明发,沈雅琴.甘草及其活性成分抗炎与抗炎机制的研究进展[J].现代药物与临床,2011,26(4):261-268.
[3]田庆来,官月平,张波,等.甘草有效成分的药理作用研究进展[J].天然产物研究与开发,2006,17(18):343-347.
[4]王兵,王亚新,赵红燕,等.甘草的主要成分及其药理作用的研究进展[J].吉林医药学院学报,2013,34(3):215-218.
[5]HE Kang,SI Sohn,JW Lee,et al.Liquiritigenin pharmacokinetics in a rat model of diabetes mellitus induced by streptozotocin:greater formation of glucuronides in the liver,especially M2,due to increased hepatic uridine 5′-diphosphoglucuronic acid level[J]. Metabolism Clinical and Experimental,2010,59:1472-1480.
[6]HE Kang,YW Kim,SI Sohn,et al.Pharmacokinetics of liquiritigenin and its two glucuronides,M1 and M2,in rats with acute hepatitis induced by D-galactosamine/lipopolysaccharide or CCl4[J]. Informa healthcare,2010,40(6):424-436.
[7]程新宇,韩亚男,金燕清,等.大孔树脂在甘草活性成分分离纯化中的应用[J].中国现代中药,2014,16(4):343-347.
[8]易运红,吴功庆,曾富兰,等.大孔吸附树脂纯化黄酮类化合物的研究[J].安徽农业科学,2011,39(14):8364-8366.
[9]陆林玲,束艳,钱大玮,等.大鼠灌胃四逆散提取物后血浆、尿液、粪便、胆汁中主要代谢产物的鉴定[J].药学学报,2011,46(11):1374-1379.
[10]胡凤英,王婷,潘桂湘,等.高分辨质谱在药物代谢产物鉴定中的应用进展[J].辽宁中医杂志,2014,41(8):1764-1767.
[11]李行诺.山豆根化学成分及其黄酮类化合物在电喷雾质谱中的裂解规律研究[D].沈阳:沈阳药科大学,2009.
[12]周桂芬,吕圭源.基于高效液相色谱-二级管阵列光谱检测-电喷雾离子化质谱联用鉴定铁皮石斛叶中8种黄酮碳苷化合物及裂解规律研究[J].中国药学杂志,2012,47(1):13-19.
[13]Xiang C,Qiao X,Wang Q,et al.From single compounds to herbal extract:a strategy to systematically characterize the metabolites of licorice in rats[J].Drug metabolism and disposition,2011,39(9): 1597-1608.
[14]董世奇,樊慧蓉,李全胜,等.甘草苷在大鼠体内的代谢途径研究[J].中草药,2014,45(17):2499-2505.
[15]王坤,葛春林.胆汁成分改变及其相关疾病研究进展[J].中国医学工程,2012,20(7):187-188.
[16]王立萍,王新春.黄酮类化合物的代谢研究进展[J].中国实验方剂学,2014,20(11):226-229.
[17]汤泓,汤丽玲,徐瑞娟,等.部分黄酮类化合物的Ⅱ相代谢产物及其药理活性研究进展[J].中国新药杂志,2012,21(2):144-150.
(本文编辑:高杉,马英)
Characterization of metabolites of liquirtigenin in rats by UPLC-Q-TOF/MS
LI Yuan-yuan1,2,JIANG Zhen-zuo1,2,ZHANG Lei1,2,CHAI Xin1,2,WANG Yue-fei1,2
(1.Tianjin State Key Laboratory of Modern Chinese Medicine,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.Tianjin International Joint Academy of Biotechnology and Medicine,Research and Development Center of Traditional Chinese Medicine,Tianjin 300457,China)
[Objective]To systemically study metabolites of liquirtigenin in rats,an UPLC-Q-TOF/MS method was developed.[Methods]UPLC-Q-TOF/MS method was employed to identify metabolites of liquirtigenin in plasma,urine,feces and bile samples from rats after iv and ig administration of liquirtigenin(20 mg/kg).[Results]A total of 15 metabolites were characterized in those biological samples,including isoliquirtigenin,glucuronides and sulfates of(iso)liquirtigenin,davidigenin and its sulfates,methylated isoliquirtigenin,dehydrogenated liquirtigenin.The main metabolic pathways of liquirtigenin were isomerization,glucuronidation and sulfation,methylation,dehydrogenation.[Conclusion]The UPLC-Q-TOF/MS method established in this study is successfully applied to identify metabolites of liquirtigenin in rats.
liquirtigenin;metabolite;UPLC-Q-TOF/MS;isomerization;glucuronidation;sulfation
R284
A
1672-1519(2015)12-0757-06
10.11656/j.issn.1672-1519.2015.12.14
国家自然科学基金资助项目(81202877)。
李元元(1988-),女,硕士在读,主要研究方向中药质量控制。
王跃飞,E-mail:wangyuefei_2006@hotmail.com。
(2015-07-03)
