滨海区黄花鸢尾的耐盐碱性及氮磷去除效果
2015-08-25陈广琳陈友媛王翔宇李胜玲孙鹏鹏中国海洋大学环境科学与工程学院山东青岛26600中国海洋大学海洋环境与生态教育部重点实验室山东青岛26600
陈广琳,陈友媛,2*,孙 萍,王翔宇,李胜玲,孙鹏鹏(.中国海洋大学环境科学与工程学院,山东 青岛 26600;2.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 26600)
滨海区黄花鸢尾的耐盐碱性及氮磷去除效果
陈广琳1,陈友媛1,2*,孙 萍1,王翔宇1,李胜玲1,孙鹏鹏1(1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100)
为探究黄花鸢尾(Iris pseudoacorus)在滨海区的耐盐碱程度及对盐碱污染水体中氮磷的去除能力,采用水培实验,分析其幼苗在盐碱交互胁迫下的生长状况、生理响应及其对水体中氮磷的去除效果.结果表明,黄花鸢尾耐盐碱范围:pH值为7、8、9时,盐度分别低于9‰、6‰、3‰.在其耐盐碱范围内,植株的含水量和叶绿素含量与对照相差在5.0%以内,而Na+、Cl-与甜菜碱、可溶性糖含量随盐度和pH值的升高而增加,但增幅均低于130.0%.在低盐弱碱(pH 7、盐度为3‰、6‰与pH 8、盐度为3‰)条件下,黄花鸢尾幼苗相对生长速率比对照高0.6~6.1%,对水体中总氮、总磷的最大去除率分别为0.046mg/(g·d)、0.020mg/(g·d).在其耐盐碱范围外,Na+与脯氨酸含量与对照相比增幅高达14.0倍和91.4倍;黄花鸢尾生长受阻,对水体中氮磷的去除效果较差.因此,黄花鸢尾仅适用于滨海低盐弱碱水体的生态修复.
黄花鸢尾幼苗;盐碱胁迫;渗透调节;耐受能力;水质净化
滨海河口区水体中的盐碱一方面来自海水的潮汐运动,另一方面来自底质盐碱土和咸化浅层地下水的传质作用[1].盐碱环境不利于大多数淡水植物生存,使得河口区水生态景观萧条,因此,亟需筛选耐盐碱水生植物来修复滨海河口区生态系统.
植物可以通过吸收、吸附以及根系微生物的降解等途径去除水体中污染物[2].研究显示,植物的耐盐能力、种植密度、植株大小和根系发达程度等因素直接影响植物去除含盐碱水体中氮磷的能力[3].其中,耐盐碱能力是限制其净化效率最重要的因素.盐碱会对植物产生渗透胁迫、离子毒害、造成营养亏缺、打破能量平衡等影响[4],使不耐盐碱植物的生长受到抑制,降低植物去除氮磷的能力.而在盐碱胁迫下,有些植物通过积累无机离子和脯氨酸等有机小分子物质调节渗透平衡[5],并能够通过细胞的选择性吸收、区域化作用以及跨膜转运蛋白维持离子平衡[6],提高植物的耐盐碱能力,增加植物在盐碱环境中对氮、磷的吸收.植物的成活率、相对生长速率可直观地反映植物耐盐碱性强弱[7];含水量、根系活力、叶绿素含量、膜渗透性等生理指标能更准确的表征植物耐盐碱程度[8].植物净化淡水水体的研究已有大量报道[9-10],而水生植物耐盐碱机理及盐碱交互胁迫下的生长规律、净化水体等方面的研究较少.
本研究选用青岛滨海河口区较为常见且有较好景观效果的水生植物,黄花鸢尾,为研究对象,针对其最敏感的幼苗阶段,通过测量其相对生长速率、新增分蘖数等生长指标和含水量、根系活力、叶绿素含量、叶片相对电导率、渗透调节能力等生理指标,研究黄花鸢尾盐碱耐受性,分析其去除盐碱水体中氮、磷能力和影响因素,以期为滨海河口区盐碱水体的植物修复提供理论依据.
1 材料与方法
1.1供试植物
黄花鸢尾(Iris Pseudoacorus),多年生草本,根状茎粗壮,须根生长旺盛,喜水湿,较耐盐,喜含石灰质弱碱性土壤.实验所用黄花鸢尾通过种子萌发获得长势均一的幼苗.实验前用霍格兰营养液水培 1个月,让植物适应无土水培环境,温度在20~24℃之间,自然光照.
1.2实验设计
实验水质依据青岛李村河下游 8个监测断面的水质分析结果配制(表1).实验前水体中氮、磷实测值为:氨氮 3.6mg/L,硝氮 2.6mg/L,总氮6.4mg/L,总磷 3.4mg/L.用NaCl调整水体盐度分别为 0‰、3‰、6‰、9‰、12‰、15‰;用NaHCO3-Na2CO3按照0:0、1:0、10:1的比例调整水体pH值依次为7、8、9.因pH值用碱性盐调节,故文中将pH值胁迫简称为碱胁迫.按照设定的盐度和pH值梯度进行正交实验,共18个盐碱胁迫组,每组3个平行.盐度为0‰,pH 7的实验组中的植株为对照组植株.

表1 青岛李村河下游水体理化性质Table 1 Physicochemical properties of the Licun river in Qingdao
实验用高20cm,上口直径10cm的烧杯作为实验容器,水体体积1L.每个容器种植3~4长势一致株幼苗.每组黄花鸢尾幼苗初始鲜重为(7.1± 0.2)g.种植密度为127株/m2.
为避免植株的盐激效应,实验开始前需对植株进行驯化,采用每天递增3‰盐度、0.5pH值的方式增加实验水体中盐度与 pH值,当达到设定值时,维持设定盐度与pH值,没有达到的继续增加,直到第 7d完成全部植株的驯化.实验的 15d期间,每天用蒸馏水补充蒸发的水分,保证盐度在±0.2‰范围内,pH值在±0.1范围内变化.
1.3实验仪器
TU-1810(普析,中国)紫外可见分光光度计.离子色谱仪(CS-3000,USA).
1.4分析方法
1.4.1植物生长、生理指标的测定 胁迫前后,测量植物鲜重、干重、分蘖数等生长指标,相对生长速率(RGR)通过公式(1)计算.选取各组植物的相同部位测定其生理指标,其中叶绿素含量采用乙醇提取法测定[11];根系活力采用氯化三苯基四氮唑法测定[12];叶片相对电导率采用浸泡法[12];叶片鲜重含水量采用烘干称重法测定[12].
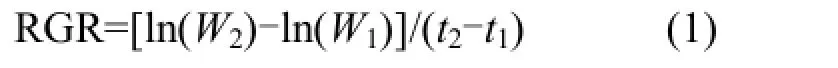
式中:W1为初始时刻 t1(d)的植物干重,g;W2为结束时刻t2(d)的植物干重,g.
1.4.2植物体无机离子和有机溶剂的测定 植物体内无机离子 K+、Na+、Cl-含量用离子色谱法测定[13].脯氨酸含量用酸性茚三酮比色法测定[11];可溶性糖含量用蒽酮比色法测定[11];甜菜碱含量用雷氏盐比色法测定[14].
1.4.3水体氮、磷质量浓度的测定 水体中,总氮、硝氮采用紫外分光光度法测定[15];氨氮采用纳氏试剂分光光度法测定[15];总磷采用钼酸铵分光光度法测定[15].实验始末分别测各组水体中的氮磷质量浓度,用水体中氮磷减少质量减去空白对照组氮磷减少质量的值除以植株质量和时间,计算单位时间、单位质量植物体对水体中氮、磷的去除率.
1.5统计分析
数据采用统计软件 SPSS 16.0,通过双因素方差分析比较各项测试指标在实验条件下的显著性差异,显著性水平设置为P < 0.05.
2 结果与分析
2.1盐碱胁迫下黄花鸢尾的生长状况
黄花鸢尾在盐碱胁迫下的相对生长速率(RGR)、新增分蘖数见表2.pH 7时,RGR随盐度增加而先升高后降低;盐度为 3‰时达到最大,比对照高 6.1%;盐度为 9‰时,与对照持平;盐度为12‰时,RGR大幅下降(P<0.05).pH 8、pH 9胁迫下,RGR均随盐度的升高而降低,盐度为 3‰时,RGR分别比对照高0.6%、低16.9%;盐度分别达9‰与6‰时,盐碱交互胁迫使植株RGR显著降低(P<0.05).说明pH 7、盐度为3‰、6‰与pH 8、盐度为3‰(本文定义为低盐弱碱)可促进黄花鸢尾幼苗的生长,但pH 8、盐度高于9‰与pH 9、盐度高于 6‰的盐碱交互胁迫对其生长有较大的阻碍作用;盐度相同条件下,pH值越高对植物生长阻碍作用越大.
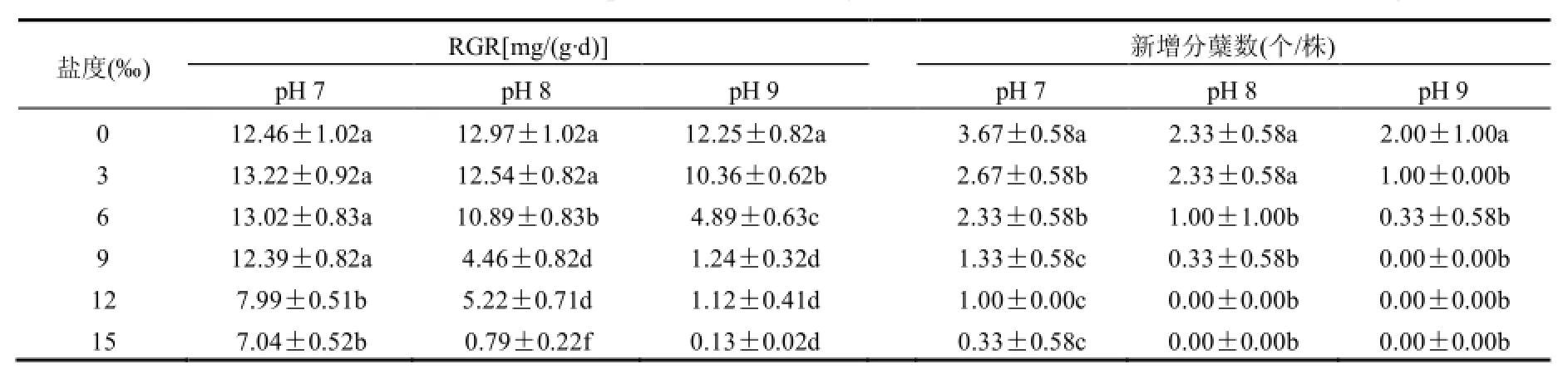
表2 盐度、pH值胁迫对黄花鸢尾的生长指标的影响Table 2 Effects of various salt and pH stresses on the growth indices of Iris Pseudoacorus seedlings
黄花鸢尾的分蘖能力随盐度、pH值的升高而降低.对照植株的新增分蘖数显著高于盐碱胁迫组植株(P<0.05).低盐弱碱胁迫下,植株的新增分蘖数仍能维持在对照的50.0%以上.在pH值为8、9,盐度分别为12‰与9‰的交互胁迫下,植株几乎停止分蘖(P>0.05).
2.2盐碱胁迫下黄花鸢尾的生理响应
细胞含水量充足时,植物的生理活动较为活跃.盐碱胁迫下,黄花鸢尾的含水量见图1a.总体来说,植株的含水量随盐度、pH值的升高而降低.在pH值为7、8、9,盐度分别为9‰、6‰、3‰时,含水量均维持在与对照相差 5.0%范围以内,盐度达12‰、9‰、6‰时,含水量显著降低(P<0.05).
叶绿素含量高低反映了植物光合作用的强弱[16].黄花鸢尾叶绿素含量见图 1b.叶绿素含量总体趋势是随着盐度和 pH值的升高而降低.在pH值为7、8、9,盐度分别为9‰、6‰、3‰时,叶绿素含量维持在与对照相差5.0%范围以内,盐度为 12‰、9‰、6‰时,叶绿素含量显著降低(P<0.05).低盐促进、高盐抑制黄花鸢尾幼苗叶绿素合成,且随着盐度和pH值的升高,盐碱胁迫增大了对该过程的阻碍作用.
叶片相对电导率是表征植物膜损伤的典型指标之一.相对电导率增大,代表膜透性增大,其选择透过性功能减弱或丧失[17].盐碱胁迫下黄花鸢尾的叶片相对电导率变化如图 1c.随盐度和pH值的升高而增大.在pH值为7、8、9,盐度分别为9‰、6‰、3‰时,叶片相对电导率与对照相比增幅均低于50.0%,盐度为12‰、9‰、6‰时,叶片相对电导率开始显著升高(P<0.05).
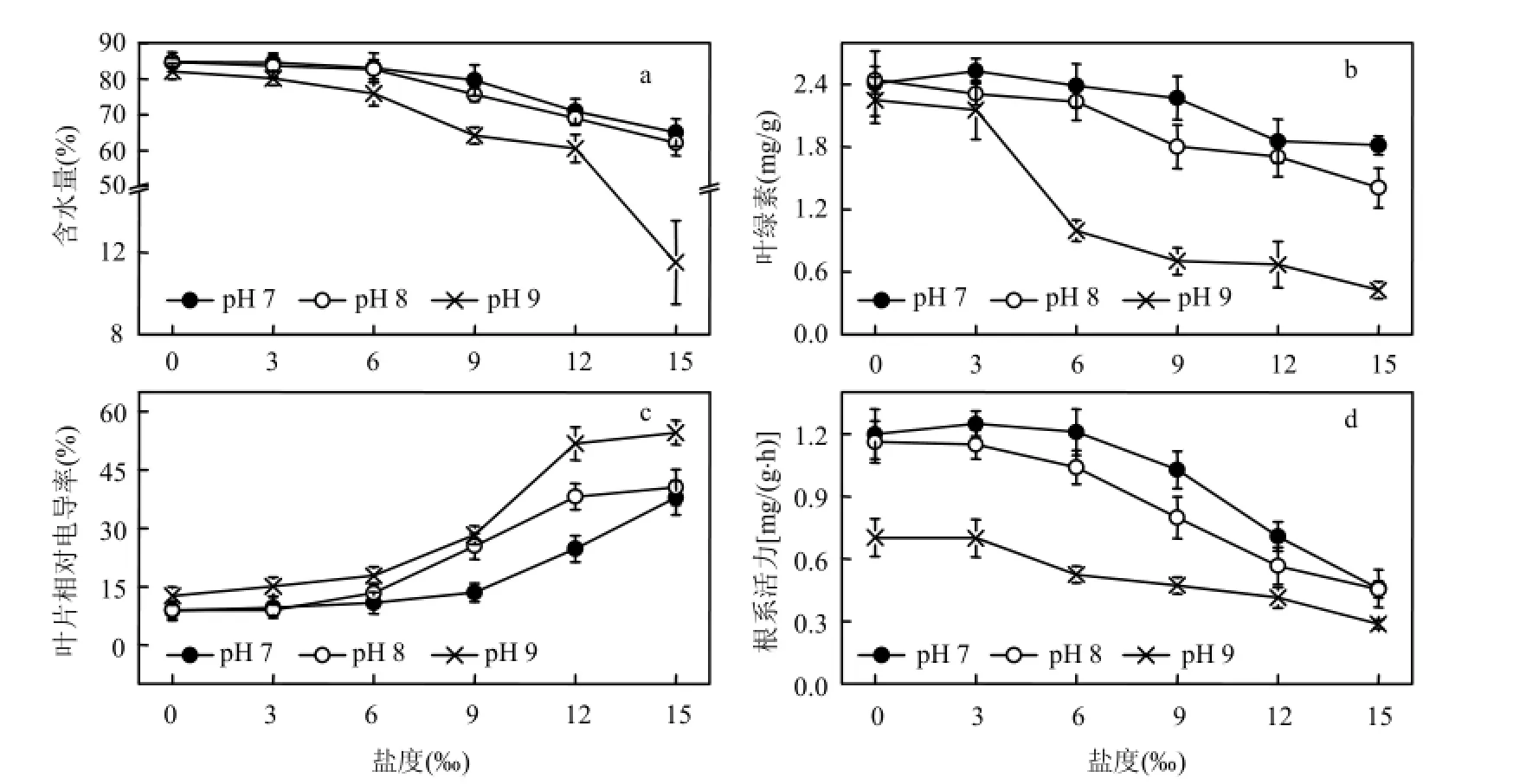
图1 盐度、pH值胁迫对黄花鸢尾生理指标的影响Fig.1 Effects of various salt and pH stresses on the physiological indices of Iris Pseudoacorus seedlings
根系活力与植物对水分、营养盐的吸收过程联系密切[18].图1d为黄花鸢尾在盐碱胁迫下根系活力的变化趋势.在pH值为7、8,盐度分别为6‰与3‰时,根系活力与对照相比相差在5.0%以内,其中,pH 7条件下,盐度为3‰时达到最大.盐度为9‰以及pH 9胁迫使得植株根系活力大幅下降(P <0.05).说明低盐胁迫能刺激黄花鸢尾幼苗根系活力的升高,但高pH值严重抑制其根系活力.
2.3盐碱胁迫下黄花鸢尾的渗透调节
2.3.1无机离子调节 盐碱胁迫下,黄花鸢尾叶片和根系中Na+含量如图2a、图2b所示.叶片与根系中Na+含量均随盐度和pH值的升高而增加.叶片与根系中Na+含量在pH值为7、8、9,盐度分别为9‰、6‰、3‰时,与对照相比增幅均低于130.0%;盐度为12‰、9‰、6‰时,Na+含量开始显著升高(P<0.05),与对照相比增幅最高达 14.0 倍.盐碱胁迫下,盐度升高是黄花鸢尾体内 Na+含量增加的主要因素,随着盐度和pH值的升高,盐碱胁迫增大了进入植株体内 Na+的含量,且叶片中Na+增幅明显高于根系(P<0.05).
盐碱胁迫下叶片和根系中K+含量如图2c、图2d所示.随着盐度和pH值的升高,K+含量逐渐降低.叶片与根系中K+含量在pH 7、8,盐度分别为9‰、6‰时,与对照相比降幅均在40.0%以内,而盐度为12‰或pH值为9的胁迫对K+的吸收产生较大的阻碍作用,且叶片受到的影响更大(P<0.05).
盐碱胁迫下叶片和根系中Cl-含量如图2e、图2f所示.叶片和根系中Cl-含量均随盐度的升高逐渐增大,但随pH值升高而降低.pH 7、pH 8条件下,盐度为 12‰时,Cl-含量开始急剧升高(P<0.05).盐碱胁迫对叶片中Cl-含量的影响大.
2.3.2有机溶质调节 黄花鸢尾在盐碱胁迫下,叶片、根系中脯氨酸含量如图 3a、图 3b所示.随着盐度和 pH值的升高,植株叶片和根系中脯氨酸含量显著升高(P<0.05).叶片脯氨酸含量在pH 7、pH 8,盐度为6‰与pH 9,盐度为3‰时,与对照相比增幅在50.0%以内.盐度为15‰时,比对照高91.4倍.根系脯氨酸含量较少,与对照相比最大增幅为3.1倍.盐度和pH值较高时,叶片中脯氨酸含量急剧升高(P<0.05),最高达根系的35.1倍.
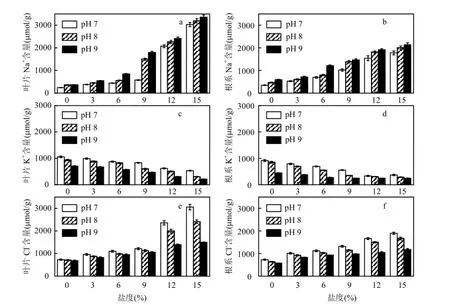
图2 盐度、pH值胁迫对黄花鸢尾叶片和根系中离子浓度的影响Fig.2 Effects of various salt and pH stresses on the ions concentrations in the leaves and roots of Iris Pseudoacorus seedlings
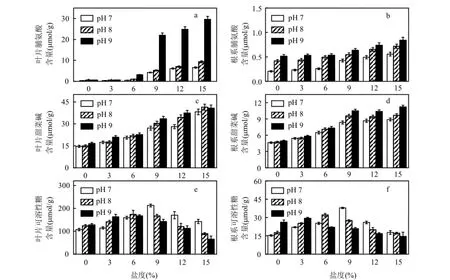
图3 盐度、pH值胁迫对黄花鸢尾有机溶质浓度的影响Fig.3 Effects of various salt and pH stresses on the organic solutes concentrations in the leaves and roots of Iris Pseudoacorus seedlings
盐碱胁迫下叶片、根系中甜菜碱含量如图3c、图3d所示.植株中甜菜碱含量均随盐度、pH值的升高而增加.盐度是导致其含量增加的主要因素,主要在叶片中积累.叶片甜菜碱含量在 pH值为 7~9、盐度为 6‰时,比对照高50.0%以内;盐度为9‰时其含量显著升高(P<0.05).根系与叶片中的甜菜碱含量变化规律一致.
盐碱胁迫下叶片、根系中可溶性糖含量见图3e、图3f.随着盐度的升高,叶片和根系中的可溶性糖含量先升高后降低.主要在叶片中积累.pH 7、盐度为9‰时,叶片中可溶性糖含量最高,比对照高1倍.pH8与pH9胁迫下,叶片中可溶性糖含量分别在盐度为6‰、3‰时达到最大,比对照高60.0%和50.0%.盐碱胁迫下根系中可溶性糖含量变化趋势与叶片一致.低盐胁迫下,pH值升高对黄花鸢尾体内可溶性糖的积累有促进作用,而盐度和 pH值较高时,可溶性糖的积累受到抑制作用显著(P<0.05).
2.4黄花鸢尾对盐碱水体氮、磷的去除效果
2.4.1对氨氮、硝氮、总氮的去除率 盐碱胁迫下,黄花鸢尾对水体中氨氮、硝氮、总氮的去除率见图4a、图4b、图4c.实验期间,对照植株对氨氮、硝氮、总氮的去除率最高,随着盐度、pH值的升高,植株对水体中3种形态氮的去除率逐渐降低.低盐弱碱条件下,植株对水体中总氮的去除率维持在 0.046mg/(g·d)以上,与对照相比降幅在7.0%以内;在pH 7、8、9,盐度分别为9‰、6‰、0‰时,植株对水体中氨氮、硝氮与总氮的去除效率开始开始显著降低(P<0.05).
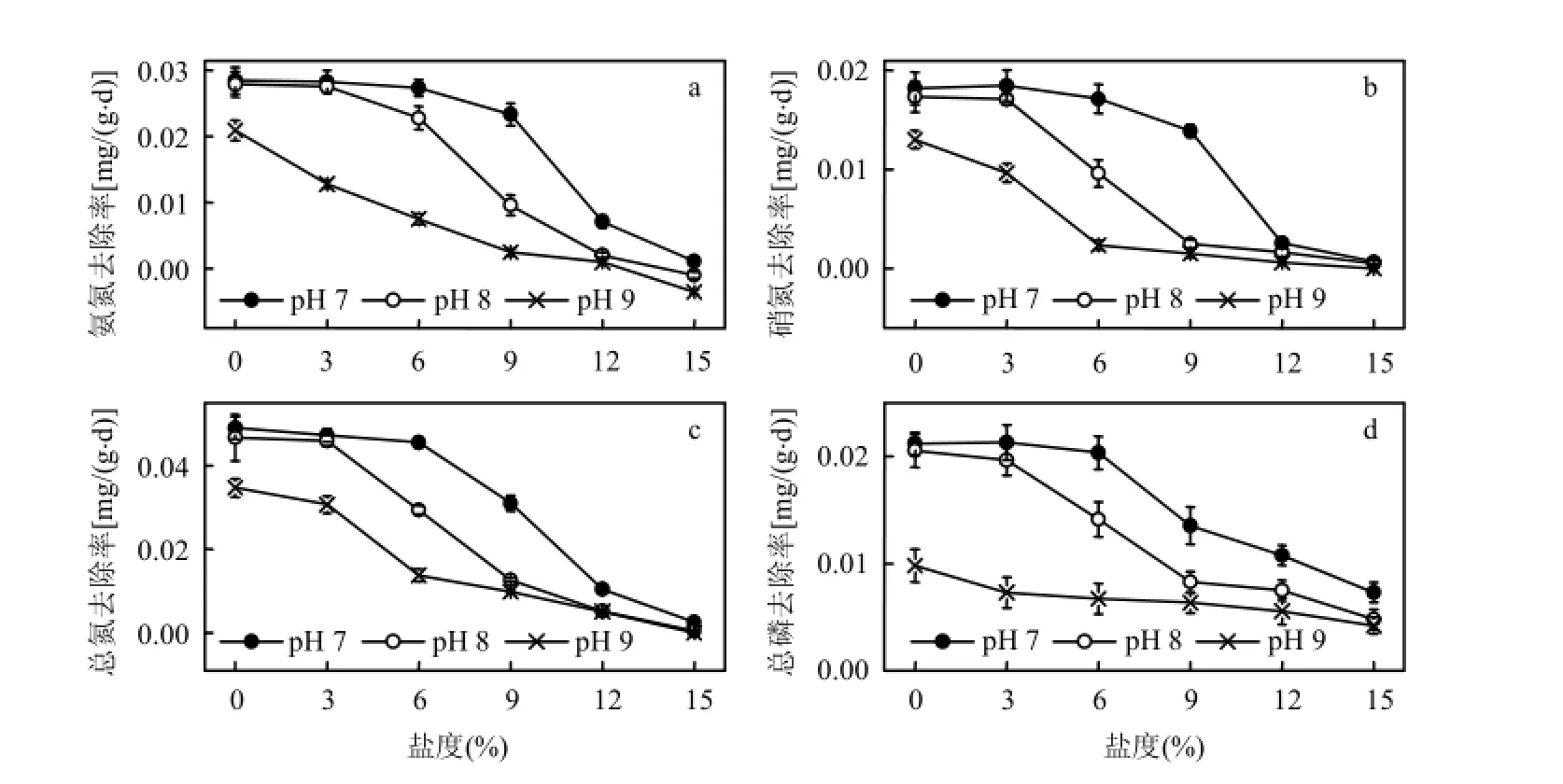
图4 黄花鸢尾对盐碱水体中氮磷的去除率Fig.4 The removal efficiency for nitrogen and phosphorus of the saline-alkaline water by Iris Pseudoacorus seedlings
2.4.2对总磷的去除率 黄花鸢尾对水体中总磷去除率见图4d.植物对水体中总磷去除率随盐度和 pH值的升高而呈现明显的下降趋势.低盐弱碱条件下,植株对水体中总磷去除率均维持在0.020mg/(g·d)以上,仅比对照低 4.1%和 7.3%;在pH 7、8、9,盐度分别为9‰、6‰、0‰时,植株对水体中总磷的去除效率开始显著降低(P<0.05).
3 讨论
3.1黄花鸢尾的盐碱耐受能力
综合黄花鸢尾的生长指标和生理指标,可以得出黄花鸢尾幼苗的耐盐碱范围:pH值为7、8、9时,盐度分别低于9‰、6‰、3‰.在其耐盐碱范围内,黄花鸢尾通过对无机离子和有机溶质不同程度的累积来调节渗透平衡,其中 Na+、Cl-与甜菜碱和可溶性糖含量与对照相比最大增幅均低于 130.0%,脯氨酸含量较少,但比对照高出 12.1 倍.与植株生长有关的含水量与叶绿素含量与对照上下相差在5.0%以内,保障了黄花鸢尾正常的光合作用、呼吸作用和营养盐的吸收等生理代谢活动;在低盐弱碱条件下,根系活力维持在较高的水平,有利于对营养盐的吸收,促进了该植物在盐碱环境中生长;在pH 7、盐度为3‰条件下,黄花鸢尾幼苗的含水量、叶绿素含量和根系活力均比对照高,是其生长的最优条件.
在其耐盐碱范围外,质膜透性增加,导致大量Na+流入而K+外渗,细胞内离子平衡失调[19].叶片中 Na+含量远远高于根系,说明此时黄花鸢尾地上部分细胞膜已受到较大的损伤,这与盐碱胁迫下其叶片相对电导率变化趋势得出的结论一致.盐碱交互胁迫对黄花鸢尾幼苗根系产生伤害,根系活力迅速下降表明根系的呼吸作用减弱,产生的能量减少,不利于对营养盐的吸收,造成植物生长缓慢.同时,合成大量有机溶质,消耗了更多能量和物质,阻碍植物的正常生理代谢活动[20].结果导致含水量、叶绿素含量快速降低,生理代谢紊乱,植株生长、分蘖受到极大的抑制.
3.2无机离子的调节作用
盐碱胁迫下,Na+、K+和 Cl-是黄花鸢尾渗透调节的主要物质,对降低细胞内渗透势的贡献率较高.研究表明,无机离子调节渗透平衡耗能少,植物更趋向于积累无机离子来降低细胞水势[21].在其耐盐碱范围内,黄花鸢尾体内Na+与Cl-升高平缓、K+降幅较小,表明在该盐碱胁迫下,植株对离子的选择性吸收能力较强,限制了无机离子的过度积累,有利于细胞持续吸收水分,并维持了细胞内离子平衡,对其正常生长生存起重要作用,是其耐盐碱的机制之一.叶片中Na+与Cl-含量低于根系,而K+高于根系,说明黄花鸢尾阻止了Na+与Cl-向地上部分的运输,限制了叶片中的 K+大量流失,有助于减缓Na+与Cl-对叶片的损伤,这也是其耐盐碱的重要机制.
在其耐盐碱范围外,渗透胁迫加剧,刺激了细胞对Na+与Cl-的大量吸收,使植株受到离子毒害.已有研究发现,高浓度的 Na+会置换细胞质膜上结合的 Ca2+,破坏膜结构的完整性,并且不利于Na+在液泡内积累,从而进入细胞质对其生理代谢过程产生抑制作用[22].叶片中Na+与Cl-急剧升高并高于根系说明盐碱胁迫对叶片的选择性吸收与外排能力受到较大阻碍.K+含量迅速降低一方面由于黄花鸢尾对 Na+和K+的吸收上可能存在竞争性抑制;另一方面因为高 pH值对该植物根系活力抑制作用较大,无法为K+的主动运输提供足够的能量.高pH值对Cl-的积累有抑制作用,根部尤为明显.这可能是因为在碱性环境中,氨基酸的羧基多发生解离而处于负电状态,根细胞对外部阴离子产生排斥作用,而更易吸收外部阳离子,导致细胞内部负电荷亏缺[23],植株体内离子严重失衡,对植物损伤严重.
3.3有机溶质的保护作用
盐碱胁迫下,黄花鸢尾会积累脯氨酸、甜菜碱和可溶性糖等有机溶质来维持渗透平衡,并可作为渗透保护物质,减缓高浓度离子对细胞的损伤.叶片中合成的有机溶质比根系高,可能是因为叶片中共质体空间比根系大,且叶片对无机离子的忍受能力较低,需要无毒害作用的相溶性物质进行调节,这有利于维持叶片的吸水能力及膜功能,使叶片光合、呼吸过程正常进行[24].
在其耐盐碱范围内,甜菜碱、可溶性糖对细胞的渗透调节作用更大,可维持细胞膜和酶的稳定性,提高植物的耐盐碱能力.其中,可溶性糖作为碳源为植物进行各种生理代谢活动补充能量[25].在其耐盐碱范围外,脯氨酸急剧增加,以调节渗透平衡,而且作为一种抗氧化剂具有清除活性氧的功能[26].盐碱交互胁迫使得黄花鸢尾光合过程受到抑制,能量积累无法传递出去,结果会造成活性氧大量增加而破坏细胞质膜,从而需要合成脯氨酸来清除细胞中的活性氧,降低对细胞质膜的损伤.甜菜碱持续增加,可平衡液泡中大量无机离子产生的高渗透势,还可促进幼苗体内脯氨酸的积累.可溶性糖减少,一方面是因为植物需要较高的能量抵抗盐碱胁迫而被消耗,另一方面可能转化成脯氨酸等兼容性更大的有机溶质来保护植物免受盐碱的迫害.
3.4氮、磷去除效果
黄花鸢尾对盐碱污染水体中氮磷的去除能力受限于其耐盐碱程度.在黄花鸢尾生长状况良好的情况下,对水体中氮磷的去除效率较高.因此水质净化效果较好时的盐碱范围小于其能够耐受的盐碱范围.
当黄花鸢尾的生长维持在正常水平以上时,根系活力较高,有利于植株对氮磷的正常吸收,且叶片光合过程的正常运转也有利于其根系泌氧功能,促进根系微生物对氮磷的去除[27].且中性环境中,无机磷主要以的形式存在,该形态有利于植物对磷的吸收[28].
而在其生长受到抑制时,植物氮磷吸收能力减弱,且严重超过黄花鸢尾耐盐碱范围时,植株不但无法正常吸收氮素,反而由于植株根系腐烂将氮素释放到水环境中,导致水体中氨氮、总氮浓度高于初始值.pH 9时,水体中分子态氨比例增加,占总氨氮浓度的 30%左右[29],对植物的伤害较大,导致黄花鸢尾不能高效的去除水体中的氮素;且占无机磷元素的 98.5%.当水体中Ca2+较高,形成微溶的CaHPO4,植物难以吸收.
因此,在筛选能够净化滨海河口区盐碱水体的植物时,确定植物在盐碱水体中的耐受能力是首要任务.
4 结论
4.1黄花鸢尾幼苗在低盐弱碱条件下可保持较好的生长、生理状况与水体净化效果.其耐盐碱范围为pH 7、8、9,盐度分别低于9‰、6‰、3‰.在其耐盐碱范围外,盐碱交互胁迫加大了对黄花鸢尾的伤害(P<0.05).
4.2耐盐碱范围内,黄花鸢尾幼苗能积累适量无机离子与有机溶质,维持植株含水量、叶绿素含量等生理指标在正常水平.耐盐碱范围外,Na+、Cl-与脯氨酸含量急剧升高,其中,叶片受到的影响比根系大,植株的生长受到较大的阻碍.
Zhao W Y, Wang Q S, Wu L B, et al. Qualitative anlysis and quantitative simulation on Yin-Huang water salinization mechanism in Bei-Da-Gang Reservoir [J]. Journal of Environment Science, 2005,10,17(5):853-856.
向速林,朱梦圆,朱广伟,等.太湖东部湖湾大型水生植物分布对水质的影响 [J]. 中国环境科学, 2014,34(11):2881-2887.
Keizer-Vlek H E, Verdonschot P, Verdonschot R, et al. The contribution of plant uptake to nutrient removal by floating treatment wetlands [J]. Ecological Engineering, 2014,73:684-690.
Brown C E, Pezeshki S R, DeLaune R D. The effects of salinity and soil drying on nutrient uptake and growth of Spartina alterniflora in a simulated tidal system [J]. Environmental and Experimental Botany, 2006,58:140-148.
Benzarti M, Rejeb K B, Messedi D, et al. Effect of high salinity on Atriplex portulacoides:Growth, leaf water relations and solute accumulation in relation with osmotic adjustment [J]. South African Journal of Botany, 2014,95:70-77.
Belkheiri O, Mulas M. The effects of salt stress on growth, water relations and ion accumulation in two halophyte Atriplex species [J]. Environmental and Experimental Botany, 2013,86:17-28.
Katschning D, Broekman R, Rozema J. Salt tolerance in the halophyte Salicornia dolichostachya Moss: Growth, morphology and physiology [J]. Environmental and Experimental Botany,2013,92:32-42.
Pedro C A, Santos M S, Ferreira S M, et al. The influence of cadmium contamination and salinity on the survival, growth and phytoremediation capacity of the saltmarsh plant Salicornia ramosissima [J]. Marine Environmental Research, 2013,92:197-205.
Zhao Y, Xia X, Yang Z. Growth and nutrient accumulation of Phragmites australis in relation to water level variation and nutrient loadings in a shallow lake [J]. Journal of Environmental Sciences,2013,25(1):16-25.
Zhao F, Xi S, Yang X, et al. Purifying eutrophic river waters with integrated floating island systems [J]. Ecological Engineering,2012,40:53-60.
董树刚,吴以平.植物生理学实验技术 [M]. 中国海洋大学出版社,2006:33-34.
郝建军,刘延吉.植物生理学实验技术 [M]. 沈阳:辽宁科学技术出版社, 2001:56-57.
赵可夫.植物抗盐生理 [M]. 北京:中国科技出版社, 1999: 22-23.
黄红娜,张丹参,郑晓霞,等.甜菜碱的提取,分离及测定含量方法的研究进展 [J]. 医学综述, 2009,15(22):3492-3494.
国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:12-13.
Shafer D J, Kaldy J E, Sherman T D, et al. Effects of salinity on photosynthesis and respiration of the seagrass Zostera japonica: A comparison of two established populations in North America [J]. Aquatic Botany, 2011,95:214-220.
廖宝文,邱凤英,张留恩.盐度对尖瓣海莲幼苗生长及其生理生态特性的影响 [J]. 生态学报, 2010,30(23):6363-6371.
李志霞,秦嗣军,吕德国,等.植物根系呼吸代谢及影响根系呼吸的环境因子研究进展 [J]. 植物生理学报, 2011,47(10):957- 966.
Sahu B B, Shaw B P. Salt-inducible isoform of plasma membrane H+ATPase gene in rice remains constitutively expressed in natural halophyte, Suaeda maritime [J]. Journal of Plant Physiology,2009,166:1077-1089.
Zhang P, Fu J, Hu L. Effects of alkali stress on growth, free amino acids and carbohydrates metabolism in Kentucky bluegrass [J]. Ecotoxicology, 2012,21:1911-1918.
Touchette B W. Seagrass-salinity interactions: Physiological mechanisms used by submersed marine angiosperms for a life at sea [J]. Journal of Experimental Marine Biology and Ecology,2007,350:194-215.
Brant W T. Seagrass-salinity interactions: Physiological mechanisms used by submersed marine angiosperms for a life at sea [J]. Journal of Experimental Marine Biology and Ecology,2007,350:94-215.
Yang C W, Chon J N, Li C Y, et al. Osmotic adjustment and ion balance traits of an alkali resistant halophyte Kochia sieversiana during adaptation to salt and alkali conditions [J]. Plant Soil, 2007,294:263-276.
Hartley N P, Hartley J, Shabala L, et al. Salinity-induced accumulation of organic osmolytes in barley and wheat leaves correlates with increased oxidative stress tolerance: In planta evidence for cross-tolerance [J]. Plant Physiology and Biochemistry,2014,83:32-39.
唐中华,郭晓瑞,于景华,等.弱光对长春花幼苗中可溶性糖、生物碱及激素含量的影响 [J]. 生态学报, 2007,27(11):4419-4424.
孙瑞莲,王文兴,周启星.球果蔊菜脯氨酸的积累及与Cd耐性的关系[J]. 中国环境科学, 2009,29(2):142-146.
孔祥龙,叶 春,李春华,等.苦草对水-底泥-沉水植物系统中氮素迁移转化的影响 [J]. 中国环境科学, 2015,35(2):539-549.
刘晶晶,李 敏,曲 博,等.湿地挺水植物根系土壤中的磷形态变化与分析 [J]. 中国环境科学, 2013,33(11):2040-2046.
Collos Y, Harrison P J. Acclimation and toxicity of high ammonium concentrations to unicellular algae [J]. Marine Pollution Bulletin,2014,80:8-23.
致谢:感谢青岛市科技攻关项目与青岛市政府采购项目提供的支持,感谢中国海洋大学环境科学与工程学院水土污染分析实验室成员对采样及实验过程提供的帮助!
The Iris Pseudoacorus' tolerant ability and removal efficiency for nitrogen and phosphorus in saline-alkaline waterof coastal region.
CHEN Guang-lin1, CHEN You-yuan1,2*, SUN Ping1, WANG Xiang-yu1, LI Sheng-ling1, SUN Peng-peng1(1.College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;2.Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China).
China Environmental Science, 2015,35(11):3422~3430
The study investigated the saline-alkaline tolerant ability of Iris pseudoacorus seedlings in coastal regions as well as the nitrogen and phosphorus removal capability under hydroponic culture. The growth characteristics,physiological response of I. pseudoacorus and the removal efficiency for nitrogen and phosphorus by I. pseudoacorus were analyzed in saline-alkaline water. The results showed the limits of salinities that I. pseudoacorus could tolerate were less than 9‰, 6‰ and 3‰, corresponding the pH values of the water were 7, 8, 9, respectively. Within the limits, the differences of water content and leaf chlorophyll content between the plants in salt-alkali treated groups and those in control group (without salt or pH stress) were less than 5.0%. The concentrations of Na+, Cl-, betaine and soluble carbohydrates increased by 130% at most within the limits. At low salinities and low alkalinities (salinities were 3‰ and 6‰ while the pH was 7and salinity was 3‰ while the pH was 8), the relative growth rate of the plants in treated groups was 0.6~6.1% higher than those in control group, and I. pseudoacorus removed 0.046mg/(g·d) and 0.020mg/(g·d) of total nitrogen and total phosphorus, respectively. Beyond the limits, however, the concentrations of Na+and proline of I. pseudoacorus were 14.0 and 91.4 times higher than those in control group in response to salt-alkali stresses. In addition,the growth of I. pseudoacorus were inhibited and the removal efficiency for nitrogen and phosphorus reduced significantly. In summary, I. pseudoacorus could be chosen to purify the coastal water with low salinity and low alkalinity.
Iris Pseudoacorus seedlings;salt-alkaline stress;osmotic adjustment;tolerant ability;water purification
X55
A
1000-6923(2015)11-3422-09
2015-04-01
青岛市科技攻关项目(12-4-1-58-HY);青岛市政府采购项目(T-20150205-018)
* 责任作者, 副教授, youyuan@ouc.edu.cn
陈广琳(1990-),女,山东潍坊人,中国海洋大学硕士研究生,研究方向为近海水体污染控制与修复技术研究.发表论文1篇.
