聚硫酸铁强化混凝除锑(V)作用机制探讨
2015-08-25贺维鹏湖南大学土木工程学院湖南长沙410082
高 源,贺维鹏,施 周,童 丽,向 帆 (湖南大学土木工程学院,湖南 长沙 410082)
聚硫酸铁强化混凝除锑(V)作用机制探讨
高 源,贺维鹏*,施 周,童 丽,向 帆 (湖南大学土木工程学院,湖南 长沙 410082)
以聚硫酸铁(PFS)为絮凝剂,考察强化混凝去除饮用水源水中五价锑(Sb(V))时原水pH值、PFS投量、共存阴离子和)及腐殖酸(HA)等对其去除效果影响及作用机制.结果表明,原水pH值对强化混凝过程Sb(V)存在形态及PFS的水解产物有重要影响,表现为较低pH值和较高PFS投量均有利于提高Sb(V)的去除率;由于竞争吸附作用的存在,共存阴离子与HA均对Sb(V)的混凝去除产生负面效应.此外, PFS除Sb(V)过程较为符合准二级动力学模型.
絮凝;吸附;动力学;聚硫酸铁(PFS);腐植酸(HA)
锑(Sb)因具有强烈的毒性和致癌作用而受到人们广泛关注,被美国环保署(USEPA)及欧盟(EU)列入优先控制污染物范畴[1].它对人体的危害途径除吸入与直接接触外,以饮用水为主[2].好氧地表水中,主要以Sb(V)形式存在[3],但以铝盐为絮凝剂的常规处理工艺对其去除效果极为有限[4],因而研究去除 Sb(V)的高效方法十分必要.
目前,较常用的除Sb方法有沉淀法、吸附法、氧化还原法和离子交换法等[5-10].然而,以往研究主要关注的是污废水中锑污染物的去除,对饮用水源水的涉及较少[11].强化混凝可通过适当调整或改善混凝条件(包括药剂种类和投量、投加位置和顺序及原水水质等)来加强常规混凝沉淀工艺对污染物的去除效果,是一种适用范围广、见效迅速且能以较低的成本换取较高的出水水质,更适合我国国情[12].
本研究模拟湖南省某市级自来水厂含Sb水源水,对不同絮凝剂投量以及共存阴离子和腐殖酸浓度等条件下的聚硫酸铁(PFS)强化混凝除Sb(V)效果进行评价,并借助吸附动力学对其去除过程进行描述,以期深入探究强化混凝除Sb(V)作用机制,为现行水厂的降锑达标及应急处理提供理论依据与指导.
1 材料与方法
1.1试验水样
称取 0.41688g焦锑酸钾(分析纯),溶于100mL去离子水,配制成浓度为2g/L的Sb(V)母液;将母液稀释成浓度为 20mg/L储备液后,在4℃下存贮待用.
称取 2g高岭土(分析纯;SiO2:46%,Al2O3:39%),溶于1000mL去离子水,配制成浊度储备液待用.
向1000mL自来水中加入10mL浊度储备液,搅拌至浊度稳定后加入 1mL Sb(V)储备液,进一步搅拌均匀制成试验模拟水样[Sb(V)含量为20μg/L,浊度为(25±1)NTU].
此外,根据研究需要,向试验水样中加入碳酸氢钠(分析纯)、磷酸三钠(分析纯)或腐殖酸(化学纯)等,并利用盐酸和氢氧化钠(均为分析纯)来调整水样pH值.
1.2絮凝剂
絮凝剂采用聚硫酸铁(PFS;工业纯,全铁≥19%),用去离子水溶解,配制成浓度为 20g/L的溶液.
1.3试验方法
将装有事先配制好的含 Sb(V)试验水样的烧杯置于六联搅拌仪(TA6-2,武汉)中进行混凝烧杯试验.先以200r/min快速搅拌1min至水样浊度稳定,而后按照试验设定的剂量投加絮凝剂,再以200r/min快搅2min,以60r/min慢搅10min,静置沉淀10min.
取沉后水上清液,经0.45μm微孔滤膜(上海)过滤后,分别用pH测定仪(PHS-3C,上海)和原子荧光分光光度计(AFS-9700,北京)测量 pH值和Sb(V)浓度.
2 结果与讨论
2.1原水pH值对Sb(V)去除率的影响
利用盐酸和氢氧化钠调整含 Sb(V)试验水样的初始pH值,并分别设定PFS投量为10,30,50,70,90,110mg/L进行混凝烧杯试验,考察不同原水pH值时絮凝剂投加量对Sb(V)去除效果的影响,结果见图1.由图1可知,PFS投量和原水pH值对Sb(V)的去除率影响均较大,相同PFS投量时,pH值越低,去除率越高;相同pH值时,PFS投量越多,去除率越高,即pH值降低和PFS投量增加,都有助于改善Sb(V)去除效果.

图1 PFS投量和pH值对Sb(V)去除率的影响Fig.1 Effect of PFS dosage and pH value on antimony (V)removal effect
Wu等[8]在研究氯化铁(FC)混凝去除饮用水中 Sb(V)污染时指出,其主要作用机制为 FC水解产物水合氧化铁(HFO)的表面吸附和内吸附.杜星等[13]在分析高锰酸盐复合药剂(PPC)和PFS联用去除水源水中的Tl和Sb复合污染的作用机理时也认同此观点.已有研究表明[14],HFO在水中会因表面羟基化而在不同pH值时以不同官能团的形式存在于水中,如当pH=4.0~9.0时,其以FeOH官能团形式存在,且存在如下平衡形式[15]:

2.2重碳酸根对Sb(V)去除率的影响

图2 浓度对Sb(V)去除率的影响Fig.2 Effect of bicarbonate on antimony (V) removal effect
分析造成上述现象的可能原因有二:首先,由2.1节可知,较低pH值更有利于Sb(V)的去除,而能够通过消耗 PFS水解产生的氢离子(H+)抑制溶液pH值的减小;其次,结合针铁矿(α-FeOOH)吸附碳酸盐)的机理为前者表面与后者之间形成单核单配位基络合物或多核内层络合物[19],可推测Sb(V)去除率降低是由于PFS强化混凝过程中产生的与其竞争 HFO上的吸附位点所致[8].另外,若溶液 pH值基本维持稳定(H+浓度变化不大),此时强化混凝过程产生的的量也基本稳定,此即为浓度大于50mg/L时Sb(V)去除率变化极小的原因.
2.3磷酸根对Sb(V)去除率的影响

图3 浓度对Sb(V)去除率的影响Fig.3 Effect of phosphate on antimony(V) removal effect
磷(P)与Sb元素属同一主族,外层电子排布均为 s2p3,拥有类似的原子结构和化学性质,这使其吸附行为与或极为相似.通过形成一种特殊的内层络合物[21],占据HFO表面的羟基官能团(-OH),与Sb(V)竞争吸附位点,且竞争吸附能力强,抑制效果显著.同时能够与PFS中的三价铁Fe(Ⅲ)形成复合物[4],减少有效絮凝剂的量,降低除Sb效果.
2.4腐殖酸对Sb(V)去除率的影响
腐殖酸(HA)是一种常见的天然有机质,因其含有大量的含氧官能团,能够与多种重金属离子反应,进而影响其迁移、转化与去除[22].向含Sb(V)试验水样中各投加0,5,10mg/L的HA,并按试验设定条件(PFS投量90mg/L,初始pH=8.0;PFS投量50mg/L,初始pH=6.0)进行混凝烧杯试验,考察HA的存在对除Sb(V)效果的影响,结果见图4.
由图4可知,两组试验条件下,随着HA浓度由0增至10mg/L,Sb(V)的去除率均逐渐减小,分别由68.7%降至58.9%和由80.5%降至73.9%.其可能原因是,HFO表面的活性部位与HA上的官能团相互配位络合,形成稳定的络合物,减少了或的吸附位点,导致反应速率和去除率均下降.陈桂霞等[23]及于春艳等[24]在考察Fe盐絮凝剂对水中重金属离子去除的抑制作用时,也提出类似的机制.

图4 HA浓度对Sb(V)去除率的影响Fig.4 Effect of humic acid on antimony(V) removal effect
2.5PFS除Sb(V)动力学
为进一步探寻PFS强化混凝除Sb(V)的作用机制,现对其开展吸附动力学研究.将试验模拟水样的 Sb(V)含量暂调至 40μg/L,设置温度分别为283.15,298.15,308.15K,在初始 pH=7.5(原水 pH值)及 PFS投量为 90mg/L,按前述水力条件(1.3节)进行一系列混凝烧杯试验. 试验过程中,每隔一段时间(快搅阶段,时间间隔 30s;慢搅阶段,时间间隔120s;沉淀阶段,时间间隔300s) 于液面下4cm处取样一次,并测定样品膜滤后Sb(V)含量,得出的吸附量q与时间t关系曲线(图5).由图5可知,Sb(V)的吸附行为主要发生在快搅阶段(前2min),此时去除率高达 90%以上,而后吸附速率变慢,其吸附量出现波动(慢搅阶段),但最终趋于稳定,且不同温度下的平衡吸附量分别为0.387,0.391,0.396μg/mg,几近相同.

图5 吸附关系曲线Fig.5 Relation curves of adsorption
Lagergren准一级动力学、准二级动力学和颗粒内扩散动力学方程的线性表达式分别见如下式(3)、式(4)和式(5):

式中:qe和qt分别表示平衡时和t时刻时的吸附容量,μg/mg;k1、k2、kT分别表示Lagergren准一级动力学、准二级动力学和分子内扩散动力学吸附速率常数,单位依次为 s-1、μg/(mg·s)和 μg/ (mg·s0.5).分别采用式(3)~式(5)的各级动力学方程对本试验数据进行拟合,结果见图6和表1.
准一级动力学模型和颗粒内扩散动力学模型拟合的相关性均较差,其相关系数 R2范围分别为0.4936~0.7549和0.4817~0.6745(表1).其中,采用 Lagergren准一级动力学方程无法得到较好的拟合结果(图6a)表明,HFO对Sb(V)的吸附并非单一机制,因此超出了准一级动力学范畴,并且由于扩散作用是限制准一级速率的重要因子,故可推断该吸附过程不只受到液膜扩散阻力的影响;采用颗粒内扩散动力学方程拟合时,若只描述吸附前期(图6c中虚线以前部分),数据拟合较好,但拟合曲线不经过原点,并且从整个吸附过程而言,其拟合结果欠佳,这表明该吸附过程受颗粒内扩散控制,但它并非唯一的速率控制步骤[25].
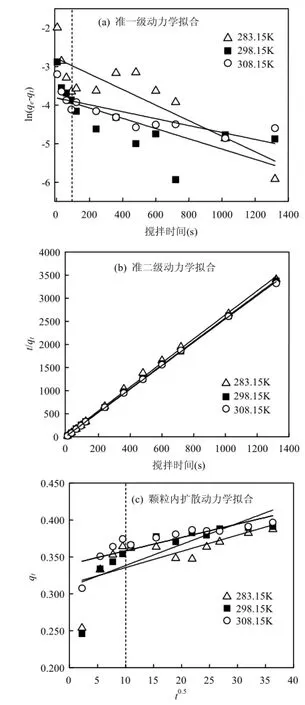
图6 吸附动力学的拟合结果Fig.6 Fitting results of adsorption kinetics
由图 6b并结合表 1可知,3组试验条件下,准二级动力学均能够很好地拟合HFO对Sb(V)的吸附过程,其相关系数R2均接近于1,且拟合所得的平衡吸附量与试验测得的平衡吸附量基本吻合(误差小于 0.5%).因化学键形成是影响准二级动力学吸附作用的主要因子[26],故可推测或主要是以形成化学键的形式吸附于 HFO上,这也与前文分析的共存阴离子或)及HA的竞争吸附机制相互佐证.此外,准二级动力学模型还包含了外部液膜扩散、表面吸附和粒子内扩散等吸附过程,因此能够更为真实全面地反映 HFO吸附或的动力学机制.

表1 HFO吸附Sb(V)动力学模型拟合参数Table 1 Fitting parameters for adsorption kinetics of Sb(V)on HFO
综上所述,对以常规净水工艺为主体的水厂而言,由于原水中Sb含量通常较低,且混凝停留时间足以使 Sb(V)吸附达到动态平衡,所以采用强化混凝法进行降锑达标时,仍可按规范要求的停留时间进行设计.同时,温度虽然能够影响Sb(V)的吸附速率,但对平衡吸附量的影响极其有限,故可忽略水温因素对混凝阶段除 Sb(V)效果的影响,但仍需考虑其对絮体沉降性能的影响.
3 结论
3.1PFS强化混凝除Sb(V)效果随pH值的降低和PFS投量的增加而提高.在pH6.0、PFS投量为110mg/L时,Sb(V)的去除率高达97.7%.
3.3准二级动力学能够很好地描述PFS水解产物对Sb(V)的吸附过程.
3.4 实际运行中,可按规范上的混凝停留时间进行设计,且可忽略水温因素对混凝阶段降Sb(V)效果的影响.
Ungureanu G, Santos S, Boaventura R, et al. Arsenic and antimony in water and wastewater: overview of removal techniques with special reference to latest advances in adsorption [J]. Journal of Environmental Management, 2015,151:326-342.
张 燕,庞志华,雷育涛,等.混凝沉淀法处理锑离子的影响因素及动力学研究 [J]. 安全与环境学报, 2013,13(3):50-53.
何孟常,万红艳.环境中锑的分布、存在形态及毒性和生物有效性 [J].化学进展, 2004,16(1):131-135.
Guo X, Wu Z, He M. Removal of antimony(V) and antimony (III) from drinking water by coagulation-flocculation-sedimentation (CFS)[J]. Water Research, 2009,43(17):4327-4335.
Wang L, Wan C, Zhang Y, et al. Mechanism of enhanced Sb (V)removal from aqueous solution using chemically modified aerobic granules [J]. Journal of Hazardous Materials, 2015,284:43-49.
Li X, Dou X, Li J. Antimony (V) removal from water by iron-zirconium bimetal oxide: performance and mechanism [J]. Journal of Environmental Sciences, 2012,24(7):1197-1203.
Xu W, Wang H, Liu R, et al. The mechanism of antimony (III) removal and its reactions on the surfaces of Fe-Mn Binary Oxide [J]. Journal of Colloid and Interface Science, 2011,363(1): 320-326.
Wu Z, He M, Guo X, et al. Removal of Antimony (III) and Antimony (V) from drinking water by ferric chloride coagulation: competing ion effect and the mechanism analysis [J]. Separation and Purification Technology, 2010,76(2):184-190.
张家兴,王 超,杨 波,等.电混凝去除水中锑污染物 [J]. 环境工程学报, 2014,8(10):4244-4248.
Miao Y, Han F, Pan B, et al. Antimony (V) removal from water by hydrated ferric oxides supported by calcite sand and polymeric anion exchanger [J]. Journal of Environmental Sciences, 2014,26(2):307-314.
Du X, Qu F, Liang H, et al. Removal of antimony (III) from polluted surfacewaterusingahybridcoagulation-focculationultrafiltration (CF-UF) process [J]. Chemical Engineering Journal,2014,254:293-301.
施 周,贺维鹏.饮用水水源中重金属污染防控技术与对策 [J]. 给水排水, 2012,38(8):1-3,94.
杜 星,梁 恒,瞿芳术,等. PPC和PFS联用去除水源水中Tl和Sb复合污染 [J]. 哈尔滨工业大学学报, 2013,45(6):33-37.
许建红,高乃云,唐玉霖,等.浅析水合氧化铁的研究进展 [J]. 水处理技术, 2011,37(8):22-25,34.
Jang M, Min S, Kim T, et al. Removal of arsenite and arsenate using hydrous ferric oxide incorporated into naturally occurring porous diatomite [J]. Environmental Science and Technology,2006,40(6):1636-1643.
席建红,何孟常,林春野,等.Sb(V)在三种矿物表面的吸附行为 [J]. 土壤通报, 2010,41(1):38-41.
Buschmann J, Sigg L. Antimony (III) binding to humic substances:influence of pH and type of humic acid [J]. Environmental Science and Technology, 2004,38(17):4535-4541.
黄君礼.水分析化学 [M]. 3版.北京:中国建筑工业出版社,2007:102-103.
Villalobos M, Leckie J O. Surface complexation modeling and FTIR study of carbonate adsorption to goethite [J]. Journal of Colloid and Interface Science, 2001,235(1):15-32.
郭会超,李文军,王环颖,等.几种水合金属氧化物的磷酸根吸附性能[J]. 环境科学与技术, 2011,34(3):15-18.
Kwon K D, Kubicki J D. Molecular orbital theory study on surface complex structures of phosphates to iron hydroxides: Calculation of vibrational frequencies and adsorption energies [J]. Langmuir,2004,20(21):9249-9254.
张 珍,沈珍妙,范天恩,等.腐植酸对nZVI去除水中Cr(VI)的抑制及抑制作用的消除 [J]. 中国环境科学, 2013,33(1):63-68.
陈桂霞,胡承志,朱灵峰,等.铝盐混凝除砷影响因素及机制研究 [J].环境科学, 2013,34(4):1386-1391.
于春艳,赵慧敏,陈 硕,等.水体中腐殖酸与Fe(III)的络合物对2,4-D光降解的作用 [J]. 环境科学, 2010,31(2):379-384.
柏静儒,王 擎,秦 宏,等.油页岩飞灰对重金属离子的吸附动力学及热力学 [J]. 燃料化学学报, 2011,39(5):378-384.
孙小莉,曾庆轩,冯长根.多胺型阴离子交换纤维吸附铬(Ⅵ)的动力学[J]. 物理化学学报, 2009,25(10):1951-1957.
Discussion on action mechanisms of antimony(V) removal by enhanced coagulation with polymeric ferric sulphate.
GAO Yuan, HE Wei-peng*, SHI Zhou, TONG Li, XIANG Fan (College of Civil Engineering, Hunan University,Changsha 410082, China).
China Environmental Science, 2015,35(11):3346~3351
The impact of raw-water pH value, polymeric-ferric-sulphate (PFS) dosage, coexisting anion (i.e., bicarbonate and phosphate ions), and humic acid (HA) was explored on antimony (V) removal effect from drinking water sources by enhanced coagulation with PFS (as flocculant). In addition, the action mechanisms of removal process were also discussed. The results showed that pH value of raw water significantly affects antimony (V) existing forms and PFS hydrolysates during enhanced coagulation, reflected by an increase of antimony (V) removal efficiency with reducing pH value or increasing PFS dosage. As a result of competitive adsorption, coexsiting anion and HA have a negative influence on the removal of antimony (V) by coagulation. Moreover, antimony (V) removal process by PFS coagulation has been found to be more in line with the pseudo-second-order kinetic model.
flocculation;adsorption;kinetics;polymeric ferric sulphate (PFS);humic acid (HA)
X52,TU991.2
A
1000-6923(2015)11-3346-06
2015-05-08
国家自然科学基金资助项目(51308199);湖南省自然科学基金资助项目(15JJ6021;13JJ6027);中央高校基本科研业务费资助项目(227201401073)
* 责任作者, 讲师, heweipengwater@163.com
高 源(1989-),男,河北唐山人,湖南大学硕士研究生,主要从事水质净化理论及其工艺优化研究.
