苦草不同生命阶段对水体、底泥中氮迁移转化的影响
2015-08-24叶斌吴蕾李春华张来甲魏伟伟
叶斌,吴蕾,李春华,张来甲,魏伟伟
苦草不同生命阶段对水体、底泥中氮迁移转化的影响
叶斌2,吴蕾3,李春华1,张来甲1,魏伟伟1
1.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京100012 2.环境保护部环境工程评估中心,北京100012 3.中国环境科学学会,北京100082
沉水植物的生长发育、衰亡过程会对水体中氮循环产生一定影响。为了研究氮在水体-底泥-沉水植物系统中的迁移转化规律,构建了人工模拟的水体-底泥-沉水植物(苦草)系统,连续270 d测定了苦草整个生命周期内水体、底泥、苦草中总氮(TN)及各形态氮浓度的变化。结果表明,在苦草生长期的前90 d中,苦草生物量增长了近30倍,水体和底泥中的TN浓度都有所降低;90 d之后苦草陆续进入衰减期及腐解期,整个体系的TN浓度持续下降,在第180天时苦草组的水体及底泥TN浓度都小于空白组。至试验结束的第270天,苦草已经完全腐解,底泥中TN浓度比第180天下降了9.11%,但水体中的TN浓度与第90天时相当,是第180天的2.42倍。苦草组底泥及苦草中的N-N和N-N浓度在试验周期内变化较大,N-N和N-N在生长期由底泥迁移到苦草中,被植物吸收和利用,随着苦草的逐渐衰亡腐解,N-N和N-N大量释放,一部分沉积在底泥中;而空白组N-N和N-N浓度在底泥及水体中波动不大。
沉水植物;底泥;氮;迁移转化;生长周期
叶斌,吴蕾,李春华,等.苦草不同生命阶段对水体、底泥中氮迁移转化的影响[J].环境工程技术学报,2015,5(6):485-491.
YE B,WU L,LIC H,et al.Effect of different life stage Vallisneria natans(Lour.)hara on migration and transformation of nitrogen in water and sediment[J].Journal of Environmental Engineering Technology,2015,5(6):485-491.
沉水植物是湖泊营养循环的核心环节之一[1-2],重建以沉水植物为主的水生植被对富营养化湖泊的恢复至关重要[3-4]。然而在沉水植物的生长发育、衰亡过程中,伴随着有机物及营养盐的积累和释放,会对湖泊中的氮等有机物循环产生影响[5]。沉水植物残体的分解过程是否会对湖泊产生“二次污染”也日益受到关注[6-7]。目前对于沉水植物腐解过程中氮的迁移转化研究已经有陆续报道,但对于其整个生命周期内氮的迁移转化研究较少。苦草(Vallisneria natans(Lour.)Hara)属水鳖科苦草属多年生沉水植物,又名扁担草、面条草、水韭菜,广泛分布于湖泊、河流等水域,是我国最为常见的沉水植物之一。由于苦草有很好的生态适应性、较强的吸污能力和耐污性,而常被作为富营养化水体植被恢复工程的主要选用品种[8]。笔者将水体-底泥-沉水植物(苦草)视为一个系统,探究沉水植物生命周期内该系统氮含量的变化,以及氮在各介质中分配比例的变化,以期为湖泊中沉水植物的生态管理提供科学依据。
1 材料与方法
1.1试验材料
采用彼得逊采泥器采集太湖竺山湾湖区(31°26'55.07″N,120°2'29.47″E)的底泥,去除粗粒及动植物残体,冷冻干燥,研磨过 100目(0.149 mm)筛后,充分混匀作为试验用土。苦草种子取自西太湖宜兴市新庄街道农业生态园(31°18'23.08″N,119°55'35.48″E),在步入式模拟实验室(HSR-100D,无锡市泰诺试验设备有限公司)内培育成苦草幼苗,作为试验用苦草。试验用水采用超纯水(出水电阻率为18.2 MΩ·cm)。
1.2试验设计
取30个聚乙烯塑料桶(直径150 mm,高500 mm;预先经过5%的HCl处理后用超纯水冲洗干净),将充分混匀的底泥等量(1 647.20 g,厚约8 cm)装入塑料桶内,加入1 L超纯水,浸泡3 d,以使底泥充分湿润,与水均匀混合;将培育好的苦草幼苗(株高5 cm左右)以簇为单位移植至塑料桶内(每簇8株,共5簇),移植过程中先将苦草幼苗用超纯水洗净,避免外部营养盐的带入,移植完成后,向塑料桶内添加超纯水至刚没过苦草幼苗,稳定3 d后加水至45 cm处。共移植15桶苦草,剩余15桶作为空白对照,其加水流程与苦草组相同。为减少人为不可控因素的影响,整个装置始终置于步入式模拟实验室内,温度为28℃,相对湿度为85%,光照强度为8 000 lx,光照时间为12 h。每隔2周向试验装置内添加超纯水,以保证装置内水平面稳定在45 cm处。
1.3取样与分析
测定各项指标作为试验初始值,之后每90 d采集一次样品,采样时间均为上午10:00,至第270天装置内苦草完全腐解,试验结束,共采集4次样品。每次采样均随机选取3桶苦草组及3桶空白组,将试验装置内的水、泥、植物全部采出。采用虹吸法将上覆水吸出并精确计量其体积;苦草分离出底泥后用少量超纯水洗净植株上附着的底泥(洗净水倒入试验装置内)并测量其生物量;底泥采集后留取10 g用于检测微生物,其他全部冷冻干燥,研磨过100目筛后用于营养盐的测定。
测定项目包括水体pH及溶解氧(DO)、叶绿素a(Chl-a)、TN、N-N、N-N浓度;底泥TN、N-N、N-N、TOC浓度,及菌活性、氨化菌、硝化菌、反硝化菌的数量;苦草生物量及株高。DO浓度采用HQ30荧光溶解氧仪(HACH,美国)测定;pH采用SG23-SevenGo DuoTMpH/电导率仪(METTLER TOLEDO,瑞士)测定;Chl-a浓度采用90%丙酮法测定。水体中TN浓度采用碱性过硫酸钾消解法测定;N-N浓度采用纳氏试剂比色-分光光度法测定;N-N浓度采用紫外分光光度法测定[9]。微生物计数检测采用MPN法[10]。根据Kim S.等所述方法测定底泥中菌活性值,即用碘硝基氯化四氮唑蓝(INT)加入到悬菌液中,2 h后测定其代谢产物INTF的浓度[11-13]。底泥中 TN浓度采用凯氏法测定;TOC浓度采用K2CrO7-H2SO4消化法测定;前处理采用H2SO4-H2O2氧化法[14]。
采用SPSS19.0软件进行数据分析。
2 结果与分析
2.1苦草生物量及株高的变化
图1为苦草在生长周期内植物株高和生物量的变化。由图1可见,生物量和株高最大值分别出现在试验的第90天和第180天,分别为初始值的29.35和13.47倍。180~270 d,苦草的株高仍有增长,但苦草生物量却有所下降,主要原因是苦草进入衰亡期,叶片变薄,体内部分不稳定有机物分解释放致使其生物量减少[15]。到第270天,水体发黑,底泥表层也无苦草残体覆盖,说明苦草已完全腐解。

图1 苦草生物量及株高的变化Fig.1 Changes of biomass and plant height in life cycle
2.2水体中pH及DO、Ch l-a浓度的变化
图2为水体pH及DO、Chl-a浓度的变化。由图2可见,苦草组水体DO浓度与pH变化趋势基本一致;而空白组pH在第90天略有升高,其余时间较为稳定;水体DO浓度一直处于稳定状态。
pH主要受水体中CO2浓度的影响,而苦草组水体中CO2浓度主要受植物生长过程的影响。在试验的前90 d,苦草幼苗迅速生长,光合作用消耗了水体中的CO2,并释放出大量O2,促使水体DO浓度及pH明显上升,且在第90天达到最大值。第180天,苦草逐渐进入衰亡期,其体内部分不稳定有机物进入水体[15],被微生物快速分解,并释放出CO2,同时光合作用逐渐减弱,造成水体DO浓度及pH显著下降。而水体DO浓度和pH的急剧改变,也加剧了苦草的衰亡,最终致使其完全腐解。
由图2(c)可知,苦草组及空白组水体中Chl-a浓度随着时间的增长不断增加,苦草组增幅大于空白组,180~270 d苦草组水体Chl-a浓度有极为明显的增加。由于底泥本身存在丰富的种子库,虽对底泥进行了相应的处理,但随着时间的增加仍有少量残存的浮游植物的种子萌发并生长,导致空白组水体Chl-a浓度的增加,但增幅有限,试验周期内Chl-a浓度最高仅为3.93 mg/m3。180~270 d,苦草衰亡并腐解,有大量叶绿素释放到水体,致使水中Chl-a浓度急剧增加,第270天时 Chl-a浓度达到73.70 mg/m3。
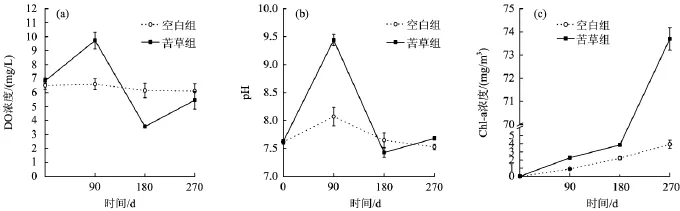
图2 水体中pH及DO、Ch l-a浓度的变化Fig.2 The changes of pH,dissolved oxygen,Chl-a in water
2.3系统中氮的变化
2.3.1系统及各介质中TN的变化
图3为系统及各介质中TN质量的变化。由图3可见,苦草组及空白组系统 TN质量(水体 +底泥+苦草中 TN质量)降幅分别为4.03%和 8.84%,90~180 d TN质量减少速率最快,后期减少速率明显放缓。底泥TN质量变化趋势与系统TN变化趋势极为相似。苦草组水体中TN质量在0~90 d时急剧减少;90~180 d时虽然仍在减少,但下降速度减缓;试验结束时,又略有增加。空白组水体TN质量在0~90 d内明显减少,而后趋于稳定,至试验结束无明显波动。植物中的TN质量在第90天达到峰值,而后不断减少直至为0。苦草组底泥中TN质量的降幅小于空白组,这表明苦草残体分解过程中TN不仅向系统外迁移,而且还向底泥中迁移。至试验结束,迁移量约占苦草TN质量的39.38%。大量有关沉水植物腐解的研究[6-7,16-17]表明,腐解结束时,底泥TN含量均有不同程度的增加。
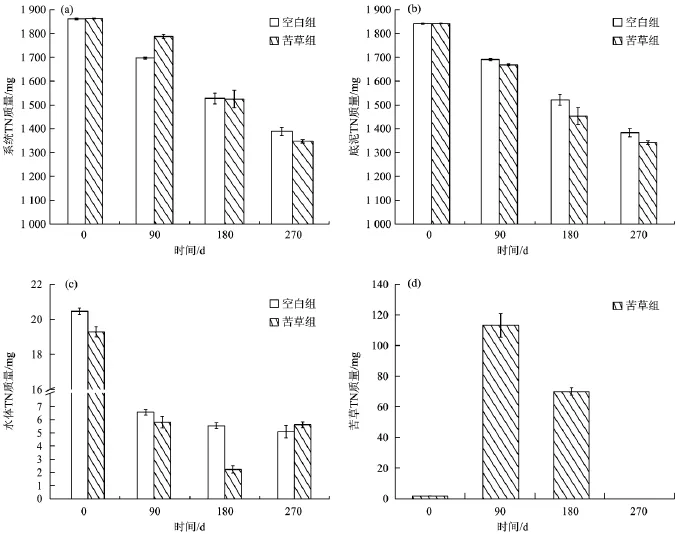
图3 系统及各介质中TN质量的变化Fig.3 The content changes of total nitrogen in the system,sediment,water and plant in life cycle
图4为系统中各介质TN所占比例。其中,空白组TN数据为底泥和水体TN数据之和;苦草组中的TN数据为底泥、水体和苦草三者TN数据之和。由图4可见,在试验初期,水体向底泥释放少量的氮,之后两介质TN比例趋于稳定状态。在苦草生命的不同阶段,各介质中TN所占比例有较大差异,在试验初期的0~90 d,水体和底泥TN比例都有所降低,说明TN被苦草吸收和利用,在90~270 d,底泥TN比例逐渐增加,而苦草TN比例逐渐减少直至为0,水体中TN比例几乎无变化,说明随着苦草的逐渐衰亡,TN从苦草体内释放后,大部分又回到底泥中。

图4 系统各介质中TN所占比例Fig.4 The proportion of TN in the system,sediment,water and plant
图5为系统及各介质中NH4+-N和N-N质量的变化。由图5可见,苦草组系统NH4+-N质量在试验周期内一直减少,但其减少速率随着时间的推移不断降低;空白组系统N-N质量在试验前期明显减少,之后无明显变化。苦草组系统N-N质量在试验开始的90 d内明显减少,之后稳定在较低水平,至试验结束无明显变化。空白组系统N-N质量的变化趋势与苦草组几乎相同,只是减少幅度较小。底泥N-N和N-N质量的变化类似于系统形态氮浓度的变化,也是前期明显减少,之后较为稳定。试验初期,水体N-N质量处于较高水平(图5(c)),主要是由于底泥中部分氮解吸并迁移至水体所致。空白组与苦草组N-N的初始质量略有偏差,这主要是由于苦草幼苗移植过程中,破坏了苦草组底泥尤其是泥-水界面的稳定,使得水体DO浓度略高于空白组(图3)。水体N-N质量在试验周期内波动较大,且空白组N-N质量始终大于苦草组。水体N-N质量前期下降明显,之后趋于稳定。植物形态氮质量前期迅速增长并在第90天达到最大值,之后不断减少直至为0。
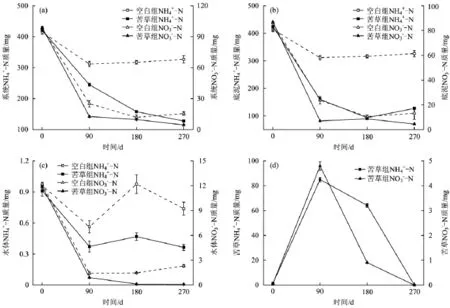
图5 系统及各介质中N-N及N-N质量的变化Fig.5 The content changes of N-N and N-N in the system,sediment,water and plant in life cycle
2.4底泥中微生物活性及氮循环菌数量的变化
图7为底泥中微生物活性及氮循环菌数量的变化。由图7可见,试验初期底泥微生物活性较低,而后明显增强,随后略有减弱。与空白组相比,苦草组底泥微生物活性变化幅度较大。苦草组氨化菌数量在试验的前90 d增加了4个数量级,随后逐步下降;空白组氨化菌数量在试验的前90 d也有明显的增长,而后基本稳定,至试验结束无明显变化。在苦草生长阶段由于光合作用释放氧气到水体,致使该阶段的DO浓度高于空白组(图3),从而有利于氨化菌的生长[18]。硝化菌数量的变化与氨化菌类似,只是其数量级总体偏小。苦草组反硝化菌数量在0~180 d内逐步增长,而后有所下降;空白组反硝化菌数量在试验的前90 d增幅较大,而后趋于稳定。

图6 系统中各介质N-N、N-N所占比例Fig.6 The proportion of N-N and N-N in the system,sediment,water and plant

图7 底泥中微生物活性及氮循环菌数量的变化Fig.7 The changes of activity and amount of nitrogen cycle bacteria in sediment in life cycle
90~180 d空白组水体DO浓度依然较高,有利于浅层底泥中有机氮的矿化,但是由于硝化菌数量比氨化菌和反硝化菌数量低2~3个数量级,使得底泥中的N-N不能被及时硝化,造成底泥N-N的富集并迫使其向水体中迁移,导致水体N-N浓度增加(图5(b)、(c));而反硝化作用从硝化作用中得到的N-N有限,从而加剧了水体及底泥中的N-N质量的减少。这一阶段,空白组系统TN质量降低了9.96%,略高于前180 d的8.84%(图3(a)),这主要是由于硝化菌数量的增加所致(图7(c)),另外水体N-N浓度较高有利于氨挥发。苦草在这一阶段开始进入衰亡期,同化作用大大减弱,而此时,苦草组底泥中各类微生物活性较强、数量较多(图7(a)),使得这一时期苦草组系统TN急剧减少,降幅高达14.67%(图3(a)),反硝化作用致使底泥及水体N-N质量维持在极低的水平(图5(b)、(c))。第180~270天,空白组系统TN浓度继续降低,其原因仍然是反硝化作用以及氨挥发[19-21]。这一时期,苦草被完全腐解,生物量降至0(图1),这是由于持续性的高温及大量高活性微生物的存在,苦草腐解率高达100%。由于微生物对苦草残体的分解,加速了苦草组的系统氮循环速率[22-23],致使该阶段苦草组系统TN质量的降幅高于空白组(图2)。
3 结论
(2)苦草的存在有利于系统中微生物活性及数量的提高,在苦草生长阶段氨化菌数量较高,在其衰亡阶段,反硝化作用致使底泥及水体N-N质量维持在极低水平。氮循环菌中不同菌种数量的多少随着苦草不同生命周期而波动,从而对整个系统氮循环产生影响。
[1]GESSNER M O.Breakdown and nutrient dynamics of submerged Phragmites shoots in the littoral zone of a temperate hard water lake[J].Aquatie Botany,2000,66(1):9-20.
[2]MARION L,PAILLISSON JM.A mass balance assessment of the contribution of floating-leaved macrophytes in nutrient stocks in an eutrophic macrophyte-dominated lake[J].Aquatic Botany,2003,75(3):249-260.
[3]邱东茹,吴振斌.富营养化浅水湖泊沉水水生植被的衰退与恢复[J].湖泊科学,1997,9(1):82-88.
[4]颜昌宙,许秋瑾,赵景柱,等.五里湖生态重建影响因素及其对策探讨[J].环境科学研究,2004,17(3):44-47.
[5]厉恩华.大型水生植物在浅水湖泊生态系统营养循环中的作用[D].北京:中国科学院研究生院,2006.
[6]张来甲,叶春,李春华,等.沉水植物腐解对水体水质的影响[J].环境科学研究,2013,26(2):146-151.
[7]孔祥龙,叶春,李春华,等.苦草对水-底泥-沉水植物系统中氮素迁移转化的影响[J].中国环境科学,2015,35(2):539-549.
[8]陈开宁,兰策介,史龙新,等.苦草繁殖生态学研究[J].植物生态学报,2006,30(3):487-495.
[9]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:243-284.
[10] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2009:39-60.
[11]KIM S,CHOID H,SIM D S,et al.Evaluation of bioremediation effectiveness on crude oil-contaminated sand[J].Chemosphere,2005,59(6):845-852.
[12]TREVOR J T.Measurement of electron transport system(ETS)activity in fresh water sediment[J].Water Research,1984,18(5):581-584.
[13] HOURI-DAVIGNON C,RELEXANS J C,ETCHEBER H. Measurement ofactualelectron transportsystem(ETS)activity in marine sediment by incubation with INT[J].Environmental Technology Letter,1989,10(1):91-100.
[14] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:146-163.
[15]吴振斌,邱东茹,贺锋,等.沉水植物重建对富营养水体氮磷营养水平的影响[J].应用生态学报,2003,14(8):1351-1353.
[16]李文朝,陈开宁,吴庆龙,等.东太湖水生植物生物质腐烂分解试验[J].湖泊科学,2001,13(4):331-336.
[17]潘慧云,徐小花,高士祥.沉水植物衰亡过程中营养盐的释放过程及规律[J].环境科学研究,2008,21(1):64-68.
[18]岳冬梅,田梦,宋炜,等.太湖沉积物中氮循环菌的微生态[J].微生物学通报,2011,38(4):555-560.
[19]周群英,高廷耀.环境工程微生物学[M].北京:高等教育出版社,2000.
[20] REDDY K R,PATRICK W H,LINDAU C W.Nitrificationdenitrification at the plant root-sediment interface in wetlands[J].Limnol Oceanogr,1989,34(6):1004-1013.
[21]ROGERS K H,BREER P F,CHLICK A J.Nitrogen removal in experimental wetland treatment systems:evidences for the role of aquatic plants[J].Research Journal of the Water Pollution Control Federation,1991,63(7):934-941.
[22]王国祥,濮培民,黄宜凯,等.太湖人工生态系统中氮循环细菌分布[J].湖泊科学,1999,11(2):161-164.
[23]BURNSD A,MURDOCH P.Effects ofa clear cuton the net rates of nitrification and N mineralization in a northern hardwood forest, CatskillMountains,NewYork,USA[J]. Biogeochemistry,2005,72:123-146.◁
Effect of Different Life Stage Vallisneria natans(Lour.)Hara on M igration and Transformation of Nitrogen in Water and Sediment
YE Bin2,WU Lei3,LIChun-hua1,ZHANG Lai-jia1,WEIWei-wei1
1.State Key Laboratory of Environmental Criteria and Risk Assessment,Chinese Research Academy of Environmental Sciences,Beijing 100012,China 2.Appraisal Center for Environment&Engineering,Ministry of Environmental Protection,Beijing 100012,China 3.Chinese Society for Environmental Sciences,Beijing 100082,China
The growth and decomposition of submerged macrophytes affects the nitrogen cycle in water body.In order to investigate themigration and transformation rule of nitrogen in the water-sediment-submerged macrophytes system,a simulated system was constructed.The changes of nitrogen in water,sediment and submerged macrophytes(Vallisneria natans(Lour.)Hara,V.natans)as well as itsmigration and transformation in the life cycle of V.natans were studied for 270 days.The results show that the biomass of V.natans increased by more than 30 times in the first threemonths,and the total nitrogen(TN)amount in water and sediment decreased.After 90 days,V.natans grew slowly and stepped into decaying stage and TN of the whole system decreased gradually. TN in both water and sediment from the group with V.natans was less than that of the control group in the 180th day.In the 270th day,the decomposition rate of V.natans reached 100%and TN in sediment decreased by 9.11%compared with that in the 180th day,while the content of TN in waterwas similar to that of the 90th day,and was 2.42 times as that in the 180th day.N-N and N-N in water and sediment of the control group fluctuated slightly,whereas those in sediment and plant of the group with V.natans changed greatly.During the growth period,N-N and N-N in sediment transferred into V.natans,while they were released in a large amount during decomposition process of V.natans,some ofwhich deposited into sediment.
submerged macrophytes;sediment;nitrogen;migration and transformation;growth cycle
X173
1674-991X(2015)06-0485-07doi:10.3969/j.issn.1674-991X.2015.06.076
2015-04-28
国家水体污染控制与治理科技重大专项(2012ZX07101-009);国家自然科学基金项目(40971277)
叶斌(1974—),女,工程师,硕士,主要从事环境影响评估方面研究,yebin@acee.org.cn
*责任作者:李春华(1977—),女,副研究员,博士,从事湖泊水生态修复、微生物降解方面研究,lich@craes.org.cn
