正交实验优化独活总香豆素的渗漉提取工艺*
2015-08-24王春鹏马文芳刘二伟常艳旭
王春鹏,罗 倩,李 晋,何 俊,马文芳,刘二伟,常艳旭
正交实验优化独活总香豆素的渗漉提取工艺*
王春鹏,罗倩,李晋,何俊,马文芳,刘二伟,常艳旭
(天津市现代中药重点实验室,天津中医药大学,天津300193)
[目的]研究独活总香豆素的最佳渗漉提取工艺。[方法]采用L9(34)正交实验法,考察乙醇浓度、料液比、浸泡时间对独活提取物中蛇床子素、二氢山芹醇乙酸酯、二氢山芹醇、二氢山芹醇当归酸酯含量的影响。[结果]乙醇浓度为影响独活总香豆素渗漉提取效果的主要因素,最佳提取工艺为75%乙醇,料液比为1∶8,浸泡8 h。[结论]此方法可作为独活总香豆素的最佳渗漉提取工艺。
独活;渗漉提取;正交实验;HPLC
独活(Radix Angelicae Pubescentis)始载于《神农本草经》,具有祛风除湿、通痹止痛、宣通百脉等功效。独活是伞形科植物重齿毛当归(Angelica pubescens Maxim.f.biserrata Shan et Yuan)的干燥根及根茎,现代临床常用于治疗风湿性关节炎、类风湿性关节炎、中风偏瘫、头痛、慢性气管炎等病症[1]。近年来,随着相关研究的不断深入,在独活药理作用[2]和主要成分含量测定方面[3-5]的研究取得进一步发展。独活主要化学成分为香豆素和挥发油类,还含有多糖、有机酸和甾醇等成分[6]。研究证明,独活中香豆素为其主要的药理活性成分[7]。为进一步促进独活香豆素的开发利用,对其提取方法的研究是十分必要的。目前常用独活香豆素的提取方法以热回流法[8]和超声提取[9]报道最多。热回流法不仅耗时过长,而且有机溶剂用量多,超声提取虽然省时、提取效率高但是其价格昂贵且不适用于大规模的生产,而本实验中渗漉提取法具有操作简便、提取率高的优点,并且可以避免因加热和超声时间过长引起的化合物受热损失。本研究以独活香豆素中蛇床子素、二氢山芹醇乙酸酯、二氢山芹醇、二氢山芹醇当归酸酯为评价指标,通过正交实验设计[10-13],考察乙醇浓度、料液比、浸泡时间3个因素对提取效果的影响,确定渗漉提取独活总香豆素的最佳工艺条件。
1 仪器、试剂与样品
Waters 2695高效液相色谱仪,包括二元梯度泵,自动进样器、柱温箱、二极管阵列检测器(DAD),Empower色谱工作站。
蛇床子素、二氢山芹醇乙酸酯、二氢山芹醇当归酸酯对照品均购于成都曼斯特生物科技有限公司,对照品二氢山芹醇为本课题组从独活中分离鉴定,经高效液相色谱(HPLC)分析,其含量达98%以上,乙腈为色谱纯,其他试剂均为分析纯,实验用水为超纯水。
独活药材为作者购自河北安国,经天津中医药大学常艳旭副研究员鉴定为独活(Radix Angelicae Pubescentis)。粉碎后过4号筛,备用。
2 方法与结果
2.1独活总香豆素的HPLC测定
2.1.1色谱分离条件色谱条件参考文献[5],色谱柱为Phenomenex Luna C18(4.6mm×250mm,5μm),流动相:乙腈(A)-水(B),二元梯度洗脱:0~5min,20%~25%A;5~10 min,25%~30%A;10~15 min,30%~38%A;15~35 min,38%~60%A;35~40 min,60%~80%A;40~50 min,80%A;50~55 min,80%~20%A;55~60min,20%A。检测波长为325nm,进样量为10μL,流速1mL/min,柱温25℃。
2.1.2标准曲线制备精密称取蛇床子素、二氢山芹醇乙酸酯、二氢山芹醇、二氢山芹醇当归酸酯对照品适量,加甲醇溶解,配制成蛇床子素、二氢山芹醇乙酸酯、二氢山芹醇、二氢山芹醇当归酸酯浓度均为2 g/L的标准溶液。分别移取各标准品溶液适量,加入甲醇稀释得到浓度各为0.08,0.16,0.24,0.32,0.40,0.80 g/L的混合标准溶液,备用。
2.1.3测定精密吸取对照品溶液与供试品溶液各10μL,注入液相色谱仪,测定,即得。
2.2正交实验设计本次研究主要考察了使用不同乙醇浓度、不同料液比、不同浸泡时间对于独活总香豆素的影响,各选取3个水平,以L9(34)正交表安排实验,实验设计因素水平见表1。
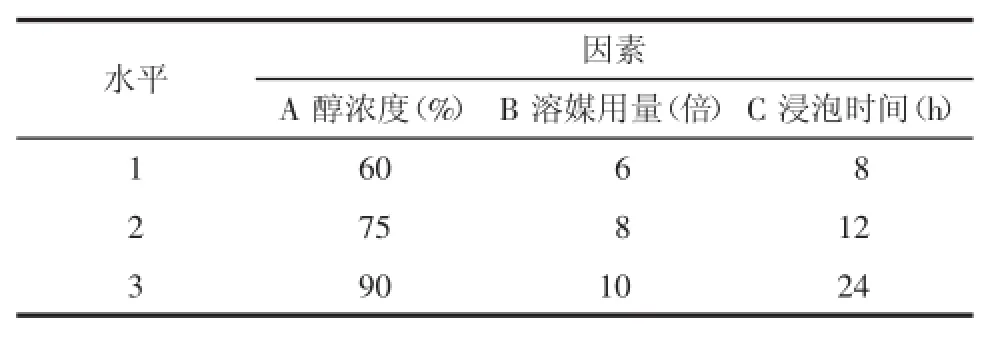
表1 正交实验因素水平表Tab.1 Factor and level in theorthogonaldesign
3 实验结果
3.1方法学考察
3.1.1线性关系考察按照2.1.1色谱条件分别测定各混合标样,以对照品进样浓度(X),各单体香豆素峰面积(),进行线性回归,得线性方程:蛇床子素=57 373X-105,r2=0.999 3;二氢山芹醇乙酸酯= 45 990X+22 958,r2=0.999 4;二氢山芹醇=41 000X+ 16 057,r2=1.000;二氢山芹醇当归酸酯=35 363X+ 17 226,r2=9 995。
3.1.2精密度实验取同一样品溶液连续进样5次,测定峰面积后计算RSD分别为蛇床子素2.04%,二氢山芹醇乙酸酯0.67%,二氢山芹醇1.87%,二氢山芹醇当归酸酯2.54%,表明仪器精密度良好。
3.1.3重现性实验取同一样品溶液5份平行操作,测定峰面积后计算RSD分别为蛇床子素0.56%,二氢山芹醇乙酸酯1.22%,二氢山芹醇1.09%,二氢山芹醇当归酸酯1.94%。说明实验方法重现性较好。
3.1.4稳定性实验取同一样品分别于0、2、4、6、8和24h进样,峰面积RSD分别为蛇床子素1.82%,二氢山芹醇乙酸酯1.88%,二氢山芹醇1.53%,二氢山芹醇当归酸酯0.94%。说明样品在24 h内稳定。
3.2渗漉提取方法和供试品溶液处理取独活药材粉末10.0 g,精密称定,乙醇润湿2 h后装柱,用以上各条件进行实验,渗滤速度为0.5mL/min,收集渗漉液,浓缩干燥,加入40mL甲醇溶解,摇匀,取1mL溶液过0.45μm有机滤膜,测定含量。结果见表2。
4 讨论
本研究对正交实验中不同排列组合条件进行了综合比较,结果显示A2B3C1的得率最高为4.44%。方差分析表明,影响渗漉提取液中蛇床子素、二氢山芹醇乙酸酯、二氢山芹醇、二氢山芹醇当归酸酯和总香豆素含量因素的大小分别为乙醇浓度>料液比>浸泡时间,其中乙醇浓度(A)为影响蛇床子素、二氢山芹醇、二氢山芹醇当归酸酯和总香豆素含量的主要因素,各水平之间差异有统计学意义(P<0.05),而料液比(B)和浸泡时间(C)均为次要因素,各水平之间差异无统计学意义。直观分析表明,料液比在B2水平下,蛇床子素、二氢山芹醇乙酸酯、二氢山芹醇当归酸酯和总香豆素的含量均最高。在B3水平下,二氢山芹醇含量最高,但B2和B3差异未达到显著水平,根据极差值及节约溶剂、降低成本的生产实际,综合蛇床子素、二氢山芹醇乙酸酯、二氢山芹醇、二氢山芹醇当归酸酯和总香豆素的正交实验结果,确定最佳渗漉工艺为A2B2C1,即75%乙醇,料液比1∶8,浸泡时间8 h。
香豆素类能溶于水、甲醇、乙醇,而难溶于乙醚、苯等极性小的溶剂[14]。考虑对总香豆素的溶解与安全等因素,本实验选择乙醇作为提取独活总香豆素的溶剂。正交实验表明,75%乙醇渗漉提取的总香豆素含量高于60%乙醇及95%乙醇的提取效果,原因可能是75%乙醇对总香豆素不仅有较好的溶解性,同时对药材细胞还有较强的穿透能力。
独活总香豆素中含有挥发性成分,且欧前胡素容易受热产生成分变化[15],不宜加热提取,有关其他成分稳定性的报道也较少[16],因此,渗漉法对于独活总香豆素的提取是可取的。该提取方法工艺简单,节约能耗,对研究香豆素类成分的提取分离具有一定的参考价值。
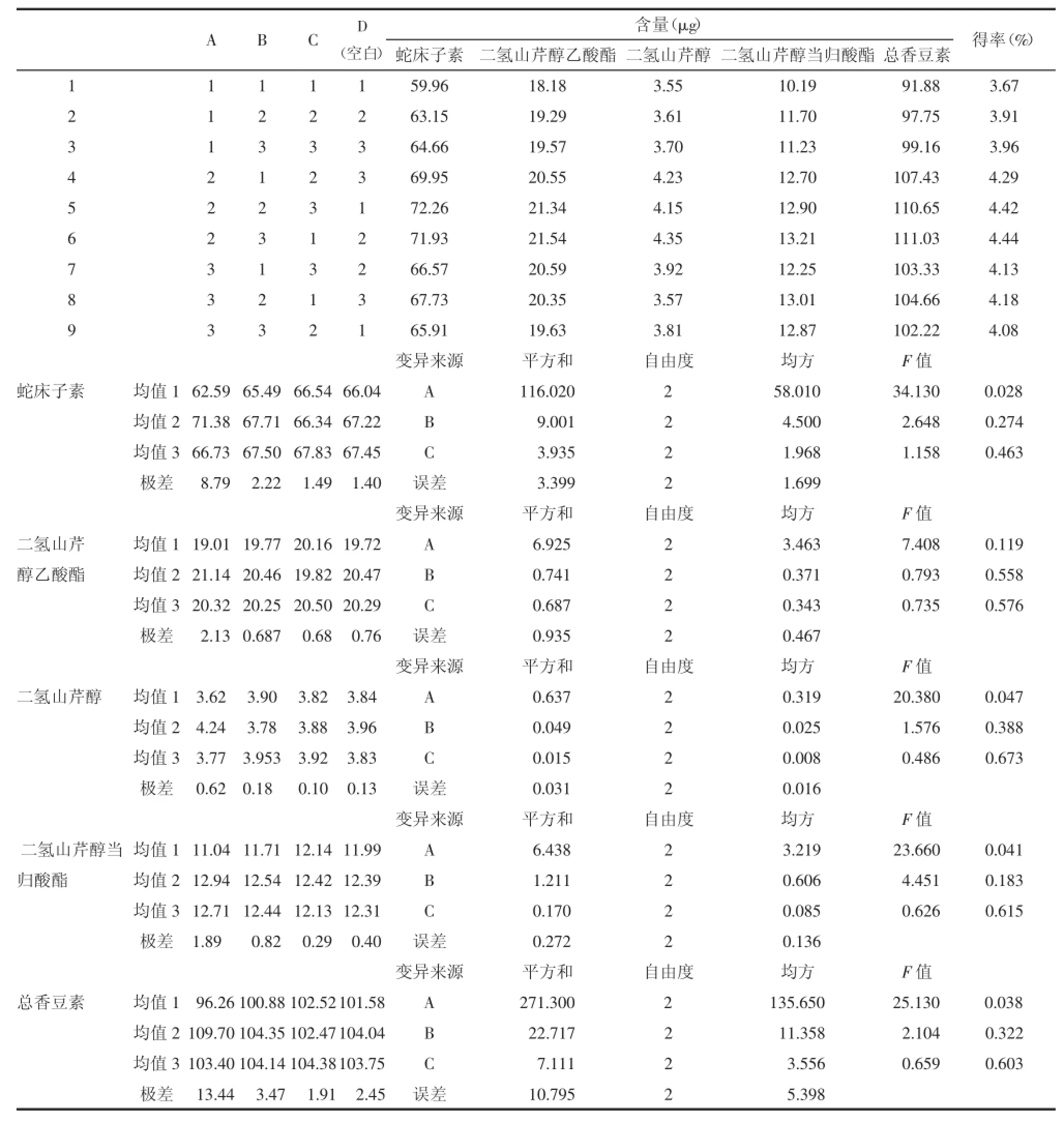
表2 正交实验结果及数据分析Tab.2 The resu ltsand data analysisof orthogonaldesign
[1]国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2010:246.
[2]林黎,钱晓萍,刘宝瑞.中药独活的化学成分及其抗肿瘤活性的研究进展[J].现代肿瘤医学,2011,19(2):373-376.
[3]谢显珍,王玉林,潘向军,等.GC-MS分析香独活挥发油成分[J].光谱实验室,2012,29(1):317-319.
[4]李晋,郭新荣,张秋红,等.中药独活中总香豆素高通量分析方法的建立[J].中国民族民间医药,2011,20(9):48-49.
[5]CHANG YX,ZHU ZW,LI J,et al.Simultaneous determination of the seven major constituents for quality control of Radix Angelicae pubescentisby HPLC coupledwith chemometricsmethods[J].内蒙古大学学报(自然科学版),2011,42(2):215-223.
[6]梁晓天.常用中药基础研究 [M].北京:科学出版社,2003:4052-4391.
[7]柳江华,徐绥绪,姚新生.独活的化学成分与药理研究进展[J].沈阳药科大学学报,1994,11(2):143-150.
[8]贾爱珍.用正交试验法探讨独活的提取[J].现代中医药,2000,19(2):41-42.
[9]郭新荣,张秋红,朱子微,等.超声波法提取独活总香豆素工艺研究[J].中国民族医药杂志,2011,17(8):57-59.
[10]熊 文,彭四威,刘海涛,等.补骨脂不同提取工艺的比较研究[J].天津中医药大学学报,2013,32(2):98-100.
[11]刘毅.复方益肾软胶囊提取工艺研究[J].天津中医药,2007,24(5):416-418.
[12]李棣华.厚朴正交提取工艺的初步研究[J].天津中医药,2005,22(1):68-70.
[13]佟杰,李进,陈涛,等.正交实验优选银屑灵涂膜剂的提取工艺[J].天津中医药大学学报,2007,26(1):34-36.
[14]肖崇厚.中药化学[M].上海:上海科学技术出版社,2002:227.
[15]姚新生.天然药物化学[M].第2版.北京:人民卫生出版社,1997: 132.
[16]刘芳,刘虹,姜佳,等.独活提取液浓缩过程中蛇床子素稳定性研究[J].天津中医药大学学报,2011,30(1):48-49.
(本文编辑:高杉,于春泉)
Optim ization orthogonalofpercolation extraction processof Radix Angelicae Pubescentiscoumarin
WANGChun-peng,LUOQian,LIJin,HE Jun,MAWen-fang,LIUEr-wei,CHANGYan-xu
(Tianjin State Key Laboratory ofModern ChineseMedicine,Tianjin University of TraditionalChineseMedicine,Tianjin 300193,China)
[Objective]To investigate the bestpercolation extraction condition of Radix Angelicae Pubescent coumarin.[M ethods]L9(34)orthogonalexperimentalmethod wasused to study the effectsofethanol concentration,solid-liquid ratio,soaking time on the contents of osthole,columbianetin acetate,columbianetin and columbianadin in Radix Angelicae Pubescentextract.[Results]Ethanol concentration was themain factor of affecting percolation,and the optimum extraction was 75%ethanol,solid-liquid ratio of 1∶8,soak 8 hours.[Conclusion]Thismethod could beused as the bestpercolation extraction processof Radix Angelicae Pubescentis coumarin.
Radix Angelicae Pubescentis;percolation;orthogonal test;HPLC
R282.4
A
1672-1519(2015)02-0113-04
10.11656/j.issn.1672-1519.2015.02.13
高等学校博士学科点专项科研基金资助项目(201012101 20007)。
王春鹏(1987-)男,硕士研究生,从事中药药效物质基础研究。
常艳旭,E-mail:tcmcyx@126.com。
(2014-09-23)
