苦碟子注射液中4种氨基酸含量的测定*
2015-08-24李遇伯张艳军
孙 璐,刘 睿,赵 雯,李遇伯,张艳军
苦碟子注射液中4种氨基酸含量的测定*
孙璐,刘睿,赵雯,李遇伯,张艳军
(天津中医药大学,天津300193)
[目的]建立同时测定苦碟子注射液中4种氨基酸类成分(缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸)含量的2,4-二硝基氟苯(DNFB)柱前衍生化法。[方法]采用DiamonsilC18(2)色谱柱(200mm×4.6mm,5μm);流动相A为超纯水,B为pH=6.40的30mmol/L乙酸钠(含1%N,N-二甲基甲酰胺),C为乙腈,梯度洗脱。流速为1.0m L/min,柱温25℃,检测波长为350 nm。[结果]对10批苦碟子注射液中4种氨基酸含量进行了测定,缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸分别在0.138 8~4.440、0.124 4~3.980、0.135 0~4.320、0.131 9~4.220mg/L范围内线性关系良好(r≥0.999 4)。平均回收率分别为98.49%、100.60%、98.50%、98.56%,相对标准偏差(RSD)≤2.0%(n=6)。[结论]该方法简便、准确,可靠,为苦碟子注射液质量控制提供参考。
苦碟子注射液;柱前衍生化;2,4-二硝基氟苯;氨基酸;高效液相色谱法
苦碟子注射液是以抱茎苦荬菜[Ixeris sonchifolia(Bge.)Hance]为原料制成的中药注射剂,具有抗肿瘤、扩冠及改善心肌缺血等功能[1],在脑梗死、冠心病等治疗方面有重要价值[2-3]。苦碟子注射液的主要成分为氨基酸类和黄酮类[4],早期研究认为这两种成分具有抗肿瘤作用[5-6]。常用的氨基酸含量测定方法有自动分析仪法、高效液相色谱法、毛细管电泳法等[7]。其中自动分析仪法仪器价格昂贵,毛细管电泳法方法复杂,因此笔者采用柱前衍生化法,建立了同时测定苦碟子注射液中4种氨基酸的分析方法,并对10批注射液中的氨基酸进行了含量测定,为实际生产中的质量控制提供依据。
1 仪器和材料
Waters-e2695高效液相色谱系统(含四元泵,在线真空脱气机,自动进样器,柱温箱,2998光电二极管阵列检测器,Empower 2色谱工作站,美国Waters公司),BT125D型分析天平[赛多利斯科学仪器(北京)有限公司],THZ-82型水浴恒温振荡器(金坛市荣华仪器制造有限公司),KH 2200B型超声波清洗器(昆山禾创超声仪器有限公司)。
缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸对照品(中国药品生物制品检定所,批号:140624-200805,所有对照品纯度经高效液相色谱峰面积归一化法计算均大于99%)。乙腈(色谱纯,SIGMA公司),2,4-二硝基氟苯、N,N-二甲基甲酰胺(天津一方科技有限公司),水为超纯水,其他试剂均为分析纯。
苦碟子注射液(吉林通化华夏药业有限公司,批号:120625、110601、120312、120109、111105、120438、111011、120209、111218、120532)。
2 方法与结果
2.1混合对照品溶液的配制精密称取缬氨酸标准品4.44mg,异亮氨酸标准品3.98mg,亮氨酸标准品4.32mg,苯丙氨酸标准品4.22mg,分别置10mL量瓶中,先加少量80%(V/V)乙醇溶解再定容至刻度,摇匀,即得对照品储备液。分别精密吸取对照品储备液适量,制成含缬氨酸44.40mg/L、异亮氨酸39.80mg/L、亮氨酸43.20mg/L、苯丙氨酸42.20mg/L的混合对照品溶液。
2.2供试品溶液的配制精密量取样品1.00 mL置10mL量瓶中,加5%碳酸氢钠溶液1.00mL与1%2,4-二硝基氟苯乙腈溶液1.00mL,摇匀,60℃水浴中暗处加热30 min后取出。用0.01 mol/L KH2PO4溶液定容至10mL,经0.45μm微孔滤膜滤过,即得供试品溶液。
2.3色谱条件Diamonsil C18(2)色谱柱(200mm× 4.6mm,5μm),柱温:25℃;检测波长:350 nm,流速:1.0mL/min,进样量:10μL。流动相A:水;流动相B:30mmol/L乙酸钠(含1%N,N-二甲基甲酰胺),pH 6.40;流动相C:乙腈;按“表1”进行梯度洗脱。

表1 流动相梯度Tab.1 Gradient of them obile phase
2.4专属性实验及系统适用性实验在2.3项色谱条件下,空白溶液,缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸在混合对照品溶液及苦碟子注射液供试品溶液中的高效液相色谱(HPLC)图中4种氨基酸分离效果良好。见图1。
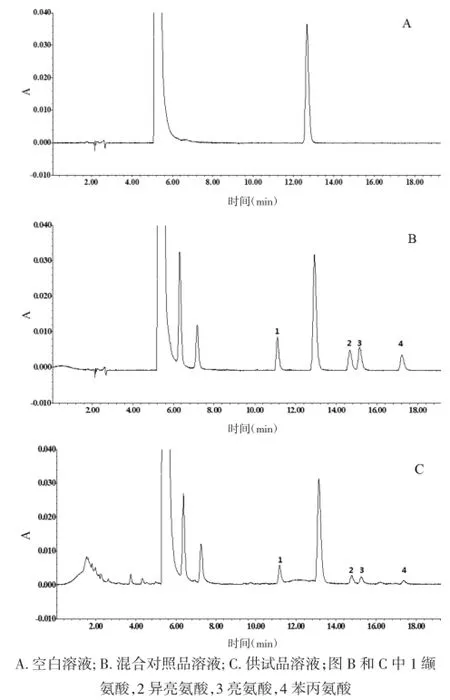
图1 空白溶液、混合对照品溶液和供试品溶液的HPLC色谱图Fig.1 Chromatogramsof blank solution,m ixed standard am ino acidssolution and sam ple solution
2.5线性关系考察精密吸取2.1项下混合对照品溶液1.00mL,加入80%(V/V)乙醇溶液1.00mL,摇匀,再精密量取该稀释溶液1.00mL,按上述步骤逐级稀释,即得混合对照品的系列对照溶液。将溶液按2.2项下供试品的制备方法进行衍生,然后将溶液按2.3项下色谱条件进行测定,记录色谱图和峰面积。分别以峰面积(Yˆ)为纵坐标,对照品浓度(X)为横坐标,进行线性回归,得出各个氨基酸的回归方程及相关系数。见表2。

表2 4种氨基酸的回归方程、相关系数及线性范围Tab.2 Regression equations,correlation coefficien tsand linear rangesof four am ino acids
2.6精密度实验按2.1项下方法制备含缬氨酸8.880mg/L、异亮氨酸7.960mg/L、亮氨酸8.640mg/L、苯丙氨酸8.440mg/L的混合对照品溶液,按2.3项下色谱条件连续进样6次,记录峰面积。缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸峰面积的RSD分别为0.30%、0.39%、0.97%、0.39%,表明仪器精密度良好。
2.7重复性实验取6份苦碟子注射液(批号:110601)1.0mL,按2.2项下方法平行制成供试品溶液,按2.3项下色谱条件进样测定,计算重复性。缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸含量分别为0.681 2、0.4159、0.3159、0.2678mg/L,RSD分别为1.3%、1.2%、2.3%、2.0%。结果表明,该方法重复性良好。
2.8稳定性实验取苦碟子注射液(批号:110601)按2.2项下方法制备供试品溶液6份,室温放置,分别于放置后0、0.5、1、2、4、6 h取样,按2.3项下色谱条件进样测定,记录峰面积。苯丙氨酸2 h后峰面积的RSD值为5.0%,缬氨酸、亮氨酸、异亮氨酸6 h后峰面积的RSD分别为5.0%、5.5%和6.2%,表明实验中所需样品在短时间内能够保持稳定,但仍应现用现制。
2.9加样回收率实验精密量取已知含量的苦碟子注射液(批号:110601)0.5mL,平行6份,分别置于10m L量瓶中,分别精密加入含有一定质量氨基酸的混合对照品溶液,其中缬氨酸3.330μg、异亮氨酸1.592μg、亮氨酸1.728μg、苯丙氨酸1.266μg,按2.2项下方法制成供试品溶液,按2.3项下色谱条件进样分析,记录峰面积,每种氨基酸分别计算加样回收率,结果见表3。结果符合方法学测定要求,表明本方法可准确测定供试品溶液中的氨基酸含量。
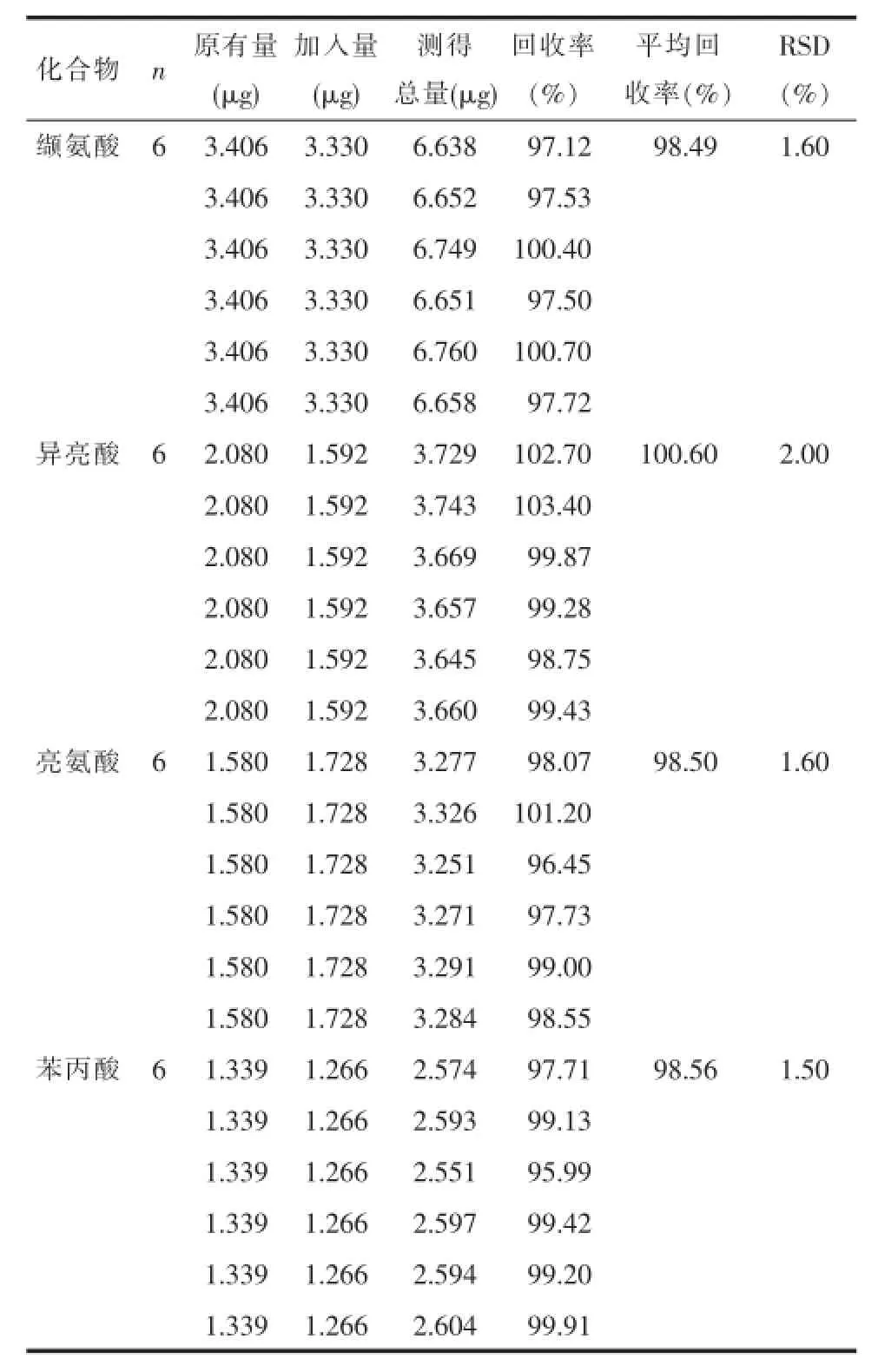
表3 4种氨基酸的加样回收率Tab.3 Recovery ratesof four am ino acids
2.10含量测定取苦碟子注射液1.00mL,按2.2项下方法制备10批不同批号的注射液为供试品溶液,按2.3项下色谱条件进样分析,记录峰面积,计算4种氨基酸类化合物的含量,结果见表4。

表4 苦碟子注射液中4种氨基酸的质量浓度Tab.4 Contentof four am ino acids in Kudiezi injection mg/L
3 讨论与结论
苦碟子注射液的主要成分为氨基酸类、黄酮类、皂苷类和有机酸类,然而由于药材中黄酮类成分含量较大,近期对苦碟子的研究一般集中于黄酮类成分[8-9]。但是氨基酸水平异常是缺血性脑血管疾病的发病机制之一[10],苦碟子注射液中的氨基酸类成分在其临床治疗心脑血管疾病的过程中具有重要意义。且本实验中测定的4种氨基酸均为人体必需氨基酸,能够为患者提供营养成分和主要氮源,提高患者的生命质量。在建立全面质量控制方法时,对氨基酸建立可靠的分析方法极其重要。在预实验中对常见的20种氨基酸进行了筛查[11-13],结果发现必需氨基酸中缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸在苦碟子注射液中含量较大,故针对这4种氨基酸进行进一步实验条件的优化。
在柱前衍生化-高效液相色谱法测定氨基酸含量的过程中,衍生化后的检测方法通常可选择荧光法或紫外法[14-15]。荧光检测器灵敏度高,检测限低,适用于微量乃至痕量样品的检测[7],但不适用于成分复杂的中药注射液。考虑到一机多用,降低检测成本,提高方法的重复性和精确度,本研究选用了紫外法对苦碟子注射液中的氨基酸含量进行了测定,结果较为理想。在梯度洗脱条件下,流动相pH值及比例是保证高效液相色谱法测定氨基酸具有良好重现性的关键环节[16]。首先参考文献[17-19]并结合本实验中待分离氨基酸的特征,选择pH=6.4,分离效果良好。其次由于氨基酸的极性不同,用同一梯度分离多种氨基酸,保留时间相差很大,导致分析时间过长,出峰效果不佳。经实验确定了最佳条件,使4种氨基酸和衍生化试剂及其衍生物在较短的时间内被分离。此外,由于衍生化试剂与氨基酸反应的产物较不稳定[20],此类衍生化法实验反应时间均小于2 h。故本实验中所有样品均应新用新制,及时进行含量测定。
分析实验结果可发现,不同批次间各氨基酸成分含量差异较大,这可能与原料药材的引种来源、种植区域、种植手段、采收季节等多个生产环节密切相关,提示应进一步对药材质量进行控制,以期全面有效地控制注射液质量。
采用DNFB柱前衍生高效液相色谱法测定苦碟子注射液中4种氨基酸的含量,具有操作简便易行、准确度高、重现性好等优点,衍生后剩余的DNFB及其衍生物对氨基酸的测定无干扰,该方法为苦碟子注射液的质量控制方法研究奠定了基础。
[1]沈阳双鼎制药有限公司.苦碟子注射液的质量控制方法:中国,200510047381.X[P].2006-04-26.
[2]温静,张连城,张玉莲,等.苦碟子注射液治疗痰热腑实型急性期脑梗死临床研究[J].天津中医药大学学报,2010,29(1):13-16.
[3]廖星,申浩,谢雁鸣,等.苦碟子注射液(碟脉灵)疗效评价文献的分析[J].中国中药杂志,2012,37(18):2810-2813.
[4]罗浩铭.苦碟子注射液中有效物质基础的研究[D].长春:吉林大学,2010:1-6.
[5]孟宪贞,倪素芳,索鸿勋,等.苦碟子化学成分的研究[J].中草药,1981,12(12):4.
[6]黄海.抱茎苦荬菜的化学成分研究[D].长春:吉林大学,2006:4.
[7]贾薇,陈涛,李进.中药中氨基酸含量测定的研究概况[J].天津药学,2009,21(5):50-52.
[8]陈英红,姜翔之,罗浩铭,等.高效液相色谱法同时测定苦碟子中四种黄酮的含量[J].中国药师,2011,14(3):308-310.
[9]马思萌,刘睿,任晓亮,等.HPLC-DAD同时测定苦碟子注射液中7种黄酮类成分含量[J].中国实验方剂学杂志,2014,20(7): 63-66.
[10]王硕,康立源,秦秀德,等.丹红注射液抗脑损伤作用研究进展[J].天津中医药大学学报,2012,31(3):183-186.
[11]武文,李卓明,苏冀彦,等.鹿茸柱前衍生化高效液相指纹图谱研究[J].中国实验方剂学杂志,2010,16(9):58-61.
[12]王立华.清开灵注射液生产中板蓝根提取液中氨基酸组分分析[J].中国医药指南,2011,9(25):211-212.
[13]汪振宇,李琳,李平.针刺治疗脑出血时效关系的实验研究[J].天津中医药,2006,23(6):467-469.
[14]高年发,李磊,邓旭衡,等.反相高效液相色谱法测定葡萄酒中23种氨基酸的研究[J].中国酿造,2011,30(2):155-157.
[15]张丽,叶翠飞,沈芊,等.高效液相荧光法测定大鼠脑内氨基酸类神经递质方法的改良[J].中国实验动物学报,2012,19(5): 377-380.
[16]李东,孙家义.2,4-二硝基氟苯柱前衍生高效液相色谱法测定18种氨基酸[J].化学分析计量,2004,13(1):18-20.
[17]蔡青,张伯礼,黄淑芸,等.丹参酮B钠盐对局灶性脑缺血/再灌注损伤大鼠海马神经递质含量的影响[J].天津中医药,2010,27(6):486-489.
[18]王芳,史丽萍,马佐英,等.养肝柔筋方对运动性中枢疲劳大鼠血、脑游离色氨酸和脑5-羟色胺含量的影响[J].天津中医药大学学报,2006,25(4):222-224.
[19]张利,李志远,李惠.高效液相色谱法测定康复新液中5种游离氨基酸含量[J].医药导报,2013,32(5):650-652.
[20]朱曙东,赵皓.氨基酸的高效液相色谱分析[J].色谱,1994,12(1):20-24.
(本文编辑:高杉,于春泉)
Determ ination of four am ino acids in Kudieziinjection
SUN Lu,LIURui,ZHAOWen,LIYu-bo,ZHANGYan-jun
(Ti anjin University of Traditional Chinese Medicine,Tianjin 300193,China)
[Objective]Toestablish a pre-column deriving determinationmethodwith 2,4-dinitrofluorobenzene(DNFB)for simultaneous quantification of four am ino acids(valine,isoleucine,leucine and phenylalanine)in Kudiezi injection.[M ethods]The determination was performed on a DiamonsilC18(2)column(200mm×4.6mm,5μm).Themobile phase consisted of ultra purewater,30mmol/LNaAc(containing 1%N,N-dimethylformamide,pH=6.40)and acetonitrile with gradient elution.The flow rate was 1.0m L/min.The column temperaturewassetat25℃and the detectionwavelengthwas350 nm.[Results]Fouraminoacidsof10 batches Kudieziinjectionwere quantified and showed good linear relationship in 0.138 8~4.440,0.124 4~3.980,0.135 0~4.320 and 0.131 9~4.220mg/L,respectively. Themean recoveriesof fouressentialamino acidswere98.49%,100.60%,98.50%and 98.56%,RSD≤2.0%(n=6).[Conclusion]The method is simp le,accurate,and reliable for quality controlof the Kudiezi injection.
Kudieziinjection;pre-column;2,4-dinitrofluorobenzene;aminoacid;HPLC
R284.2
A
1672-1519(2015)02-0106-04
10.11656/j.issn.1672-1519.2015.02.11
国家“重大新药创制”科技重大专项(2011ZX09401-305-42);国家自然科学基金项目(81303142);教育部高等学校博士学科点专项科研基金项目(2012121012 0001);天津市应用基础与前沿技术研究计划(14JCQNJC13100)。
孙璐(1990-),女,硕士研究生,主要从事中药注射液安全性再评价及中药新型给药系统研究。
刘睿,E-mail:lr_8000@163.com;张艳军,E-mail: zyjsunye@163.com。
(2014-09-23)
