五味子乙素对HK-2细胞缺氧损伤的保护作用
2015-08-24卢爱龙谭小月张勉之吴银娜
卢爱龙,谭小月,张勉之,吴银娜
五味子乙素对HK-2细胞缺氧损伤的保护作用
卢爱龙1,谭小月2,张勉之3△,吴银娜1
目的 探讨五味子乙素(Sch B)对氯化钴(CoCl2)诱导的人类近端肾小管上皮(HK-2)细胞缺氧损伤的保护作用及其可能机制。方法 取离体培养HK-2细胞,随机分为4组。对照(C)组:细胞未经任何处理。CoCl2组(化学乏氧组):加入600 μmol/L的CoCl2处理24 h。Sch B预保护(CoCl2+Sch B)组:分别加入终浓度为1 μmol/L和10 μmol/L Sch B预处理2 h后,其余操作同CoCl2组。Sch B组:分别加入终浓度1 μmol/L和10 μmol/L Sch B处理2 h。CCK-8试剂盒检测各组细胞活性;AnnexinV-FITC/PI双标记流式细胞仪检测各组细胞凋亡率;Western Blot检测各组缺氧诱导因子-1α(HIF-1α)蛋白表达;RT-PCR检测各组HIF-1α和诱导型一氧化氮合酶(iNOS)mRNA表达。结果 与对照组相比,CoCl2组细胞活性明显降低,细胞凋亡率、HIF-1α蛋白表达量和iNOS mRNA表达量显著增加,HIF-1α mRNA表达量差异无统计学意义;Sch B预保护组较CoCl2组细胞活性显著增加,细胞凋亡率、HIF-1α蛋白表达量、HIF-1α及iNOS mRNA表达量均显著减少;Sch B组与对照组细胞活性、细胞凋亡率差异无统计学意义,Sch B组几乎不表达HIF-1α蛋白。结论 Sch B可能通过抑制HIF-1α蛋白和iNOS mRNA的表达减少HK-2细胞的凋亡,从而对HK-2细胞缺氧损伤起保护作用。
细胞凋亡;缺氧诱导因子1,α亚基;一氧化氮合酶;五味子乙素;HK-2细胞;氯化钴;诱导型一氧化氮合酶
肾缺血再灌注损伤是一种严重的临床并发症,常见于失血性休克、肾移植、腹主动脉瘤手术等危重症患者。探索对缺血再灌注损伤具有保护作用的药物一直是研究热点。五味子乙素(schisandrin B,Sch B)是从中药五味子中分离的联苯环辛二烯木脂素类有效成分,是五味子中含量较多的有效成分之一,具有抗氧化、抗衰老、抗肿瘤、护肝等作用。研究表明,Sch B对心[1]、脑[2]缺血再灌注损伤均具有保护作用。而且,Sch B具有显著的肾脏保护作用,对急性汞中毒引起的肾小球和肾小管损伤[3],以及环孢素A[4]、顺铂[5]等肾毒性药物造成的肾损害均有保护作用。但目前关于Sch B对肾缺血再灌注损伤的研究尚较少。缺氧是缺血再灌注损伤中的关键环节。肾脏管状上皮细胞的高水平氧耗量及肾脏的特殊脉管系统结构使得肾脏对缺氧非常敏感,而近曲肾小管上皮细胞对缺氧损伤尤为敏感。基于此,本实验拟从体外水平检测Sch B对氯化钴(CoCl2)诱导的肾小管上皮细胞缺氧损伤的保护作用,并初步探讨其可能机制。
1 材料与方法
1.1 材料 人类近端肾小管上皮(HK-2)细胞购自美国模式菌种收集中心(ATCC)细胞库。
1.2 主要试剂与仪器 五味子乙素(纯度99%)购自上海融禾医药科技发展有限公司,二甲基亚砜溶解配制成10 mmol/L母液,CoCl2(美国,Sigma),CCK-8试剂盒(日本,dojindo),AnnexinV-FITC/PI凋亡检测试剂盒(美国,BD),缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)多克隆抗体(美国,proteintech),β-actin单克隆抗体(美国,Santa Cruz),RNA抽提试剂Trizol(美国,Invitrogen),逆转录聚合酶链反应(RTPCR)试剂盒(北京全式金),聚合酶链反应(PCR)扩增仪、台式高速离心机及凝胶成像系统(美国,Bio-Rad),酶标仪(美国,Thermo),引物由上海生工生物有限公司合成。
1.3 细胞培养 细胞在含10%胎牛血清,1%双抗(100 U/mL青霉素+100 mg/L链霉素)的DMEM-F12培养基中,于5% CO2、37℃、饱和湿度培养箱中培养。细胞贴壁生长,每2 d进行细胞换液,长至80%左右融合后以0.25%胰酶消化传代。
1.4 分组及处理 以HK-2细胞培养皿或孔板为观察单位,随机分为4组:对照(C)组:细胞未经任何处理。CoCl2组(化学乏氧组):加入600 μmol/L的CoCl2处理24 h。Sch B预保护(CoCl2+Sch B)组:分别加入终浓度为1 μmol/L和10 μmol/L Sch B预处理2 h后,其余操作同CoCl2组。Sch B组:分别加入终浓度1 μmol/L和10 μmol/L Sch B处理2 h。
1.5 指标检测
1.5.1 CCK-8试剂盒检测HK-2细胞活性 在96孔板培养细胞,每孔5 000个细胞,细胞贴壁后,换无血清培养基培养16 h使细胞周期同步化,然后按上述分组进行处理。处理完成后每孔加CCK-8试剂10 μL,37℃孵育1 h,选择450 nm波长,在酶联免疫检测仪上测定各孔的光密度(OD)值,并计算细胞活性。细胞活性(%)=(OD加药-OD空白)/(OD对照-OD空白)×100%
1.5.2 AnnexinV-FITC/PI双标记流式细胞仪检测细胞凋亡率 待细胞在6孔板中培养至对数生长期,换无血清培养基培养16 h使细胞周期同步化,再按上述分组加药处理后,胰酶消化收集各组细胞,2 000 r/min离心5 min,用PBS洗涤细胞2次(2 000 r/min离心5 min),用500 μL缓冲液重悬细胞后,先加入5 μL AnnexinV-FIFC染色液混匀后,再加入5 μL PI染色液,混匀后室温避光孵育10 min。筛网过滤后,用流式细胞仪检测细胞凋亡率。FlowJo软件计算分析各组细胞AnnexinV-FIFC和PI染色细胞百分含量。
1.5.3 Western Blot检测HIF-1α蛋白表达 接种于6孔板中的各组细胞以预冷PBS液洗2次,加入50 μL预冷蛋白裂解液,冰上裂解30 min,细胞刮刀收集样本。2,2-联喹啉-4,4-二甲酸二钠(BCA)法蛋白定量、配样,100℃、10 min变性后上样。经10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,将目的蛋白转移至硝酸纤维素膜上,5%脱脂奶粉封闭1 h。用等渗盐溶液加Tris-HCL缓冲液(TBST)冲洗后加HIF-1α及β-actin的一抗,4℃孵育过夜。TBST液冲洗,加标记辣根过氧化物酶的二抗孵育。洗膜后ECL显色,X线片曝光,冲洗,扫描。以β-actin为内参,检测HIF-1α蛋白的表达。
1.5.4 RT-PCR检测HIF-1α、诱导型一氧化氮合酶(iNOS)mRNA的表达 采用Trizol试剂盒从接种到6孔板中的各组细胞提取总mRNA。紫外分光光度仪检测mRNA的含量和纯度。用逆转录试剂盒将其逆转录成cDNA,琼脂凝胶电泳,凝胶成像系统成像后以GAPDH为内参,用Image J数码图像分析软件进行分析,以扩增片段与GAPDH的灰度比值表示产物多少,进行半定量分析。HIF-1α引物上游 5′-GGAAACTTCTGGATGCTGGTG-3′,下游5′-TTCCTCGGCTAGTTAGGGTAC-3′,扩增片段330 bp;iNOS引物上游5′-CCACCAACAATGGCAACATCAGG-3′,下 游 5′-AGGCAGGGCGTACCACTTTAGCT-3′,扩增片段350 bp;GAPDH引物为上游5′-CGGGAAACTGTGGCGTGAT-3′,下游5′-AGTGGGTGTCGCTGTTGAAGT-3′,扩增产物片段为299 bp。逆转录反应条件:42℃30 min,85℃5 min。PCR条件:94℃变性5 s,58℃退火15 s,72℃延伸10 s,33个循环。
1.6 统计学方法 用SigmaStat 3.5统计软件分析数据,计量资料采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,多重比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 细胞活性 与对照组相比,CoCl2组细胞活性明显降低,Sch B预保护组较CoCl2组细胞活性显著增加(P<0.01),Sch B组与对照组差异无统计学意义(P>0.05),见表1。
2.2 细胞凋亡率 见图1、表1。与对照组相比,CoCl2组细胞凋亡率显著增加(P<0.001),Sch B预保护组较CoCl2组细胞凋亡率显著降低(P<0.05),Sch B组与对照组差异无统计学意义(P>0.05)。
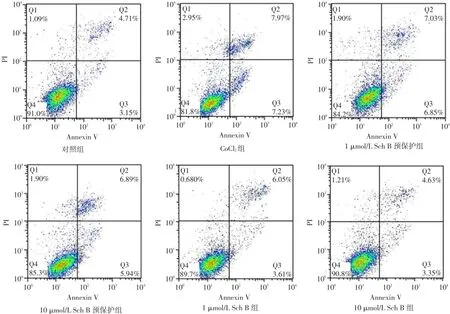
Fig.1 Results of apoptosis detected by flow cytometry in six groups of cells图1 各组细胞流式细胞检测凋亡图
Tab.1 Comparison of the cell viability and apoptotic rates in six groups of cells表1 各组细胞的细胞活性和凋亡率比较(n=3,%,±s)
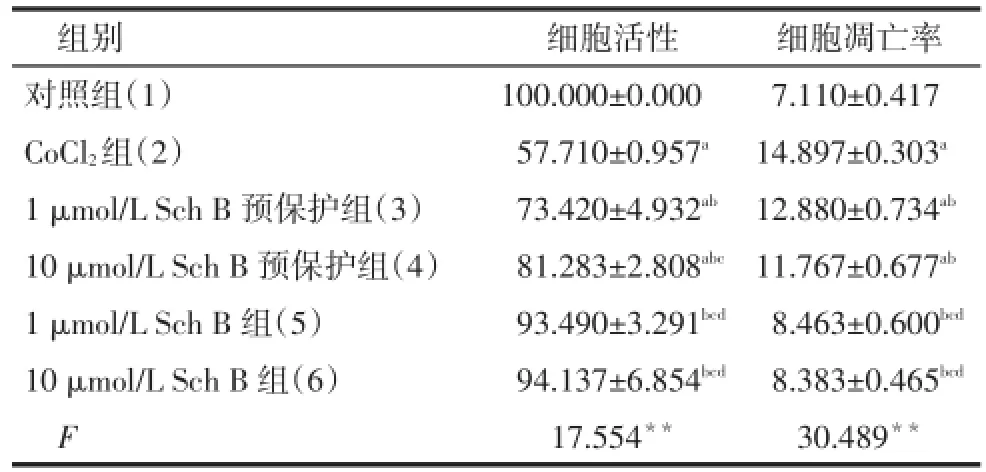
Tab.1 Comparison of the cell viability and apoptotic rates in six groups of cells表1 各组细胞的细胞活性和凋亡率比较(n=3,%,±s)
**P<0.01;a与(1)组比较,b与(2)组比较,c与(3)组比较,d与(4)组比较,P<0.05
组别对照组(1)CoCl2组(2)1 μmol/L Sch B预保护组(3)10 μmol/L Sch B预保护组(4)1 μmol/L Sch B组(5)10 μmol/L Sch B组(6)F细胞活性100.000±0.000 57.710±0.957a73.420±4.932ab81.283±2.808abc93.490±3.291bcd94.137±6.854bcd17.554**细胞凋亡率7.110±0.417 14.897±0.303a12.880±0.734ab11.767±0.677ab8.463±0.600bcd8.383±0.465bcd30.489**
2.3 对HIF-1α蛋白表达量的影响 与对照组相比,CoCl2组HIF-1α蛋白表达量显著增加(P<0.001),Sch B预保护组较CoCl2组显著降低(P<0.01),Sch B组几乎不表达HIF-1α蛋白,见图2、表2。
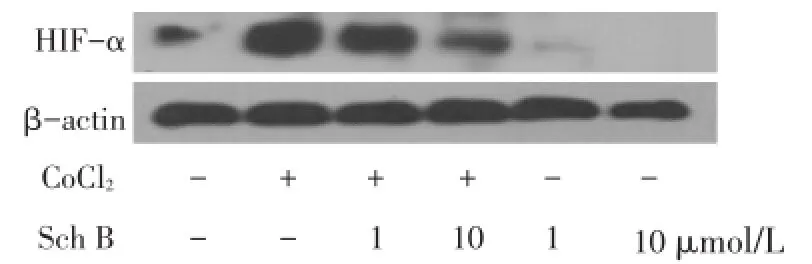
Fig.2 The expression of HIF-1α in six groups of cells图2 各组细胞HIF-1α的表达情况
2.4 对HIF-1α、iNOS mRNA表达的影响 与对照组相比,CoCl2组HIF-1α mRNA表达量差异无统计学意义(P>0.05),iNOS mRNA表达量显著增加(P<0.01),Sch B预保护组HIF-1α及iNOS mRNA表达量均较CoCl2组显著减少(P<0.05),见图3、表2。
3 讨论
3.1 凋亡在细胞缺氧损伤中的作用 细胞凋亡是在正常生理或病理状态下机体细胞发生的一种自发的、程序化的死亡过程,是缺氧诱导肾小管上皮细胞损伤的主要机制之一[6]。本实验结果表明,CoCl2诱导的HK-2细胞缺氧导致细胞活性显著下降,凋亡率显著增加。

Fig.3 The expressions of HIF-1α mRNA and iNOS mRNA in six groups of cells图3 各组细胞HIF-1α及iNOS mRNA的表达情况
Tab.2 Comparison of HIF-1α expression and HIF-1α,iNOS transcription between six groups表2 各组HIF-1α蛋白及HIF-1α、iNOS mRNA表达水平比较 (n=3,±s)

Tab.2 Comparison of HIF-1α expression and HIF-1α,iNOS transcription between six groups表2 各组HIF-1α蛋白及HIF-1α、iNOS mRNA表达水平比较 (n=3,±s)
**P<0.01;a与(1)组比较,b与(2)组比较,c与(3)组比较,d与(4)组比较,e与(5)组比较,P<0.05
?
3.2 HIF-lα在细胞缺氧损伤中的作用 在缺氧条件下机体或细胞会产生一系列的缺氧应答反应,而这些缺氧应答反应主要通过缺氧诱导因子(HIF)来调控。HIF作为氧自稳调节的关键性转录因子,能够调节百余种靶基因的表达,从而使得机体或细胞对缺氧缺血性损伤产生适应性反应。目前发现HIF家族共有3个成员,包括HIF-l、HIF-2和HIF-3,其中HIF-l广泛分布于哺乳动物和人体细胞内。在肾脏缺氧缺血损伤中,HIF-1主要表达在肾小管上皮细胞上。HIF-1是由α亚基和β亚基组成的一种异二聚体,其中α亚基是功能性亚基,β亚基是结构性亚基。缺氧诱导细胞产生HIF-lα,通过调控一系列与适应缺氧有关的转录基因的表达,调节机体针对缺氧环境的适应性。HIF-1α介导一系列适应性反应的同时也诱导了很多病理性反应,如细胞凋亡[7]。本实验结果表明,HIF-1α蛋白的高表达与HK-2细胞的活性下降及凋亡增加相关,说明HIF-1α蛋白可能诱导HK-2细胞的凋亡。HIF-1α蛋白非缺氧时容易降解,但在缺氧时则降解阻止。研究发现:除啮齿类动物外,缺氧条件下HIF-1的调节性亚基HIF-1α在mRNA转录水平上并没有显著性变化,而是经过阻滞蛋白酶体通路活性,使本应降解掉的HIF-1α蛋白堆积,进而影响下游各个基因的表达[8]。本实验结果表明,对照组与CoCl2组HIF-1α mRNA表达无显著差异,但CoCl2组HIF-1α蛋白表达较对照组显著增加,与既往研究结果一致。
3.3 iNOS在细胞缺氧损伤中的作用 内源性NO 由L-精氨酸氧化而来,催化该反应的酶即为一氧化氮合酶(Nitric Oxide Synthase,NOS)。NOS有3个同工酶亚型:神经型NOS(nNOS)、内皮型NOS(eNOS)和iNOS。iNOS在正常细胞内一般是少量表达的,当细胞受到缺氧等病理刺激时,iNOS催化合成非生理浓度的大量NO,产生一系列病理生理作用。尽管NO能维持黏膜的血管舒张和血管通透性,但是过多的NO也可直接引起细胞毒性作用,与氧自由基结合生成过氧亚硝酸等,从而引起组织损伤[9]。HIF-1α是iNOS基因转录活化的重要调节因子。有研究发现iNOS基因表达调控区内具有HIF-1α的结合位点;HIF-1α与iNOS基因调控区的特异位点结合进而调节其表达[10]。本实验结果表明,CoCl2组iNOS mRNA表达量显著增加,与HIF-1α的增加一致。
3.4 Sch B保护细胞缺氧损伤 五味子是临床常用中药之一,具有敛肺生津、补肾养心、收敛固涩等功效,其提取物对各种器官如肝脏、心脏、肾脏等的损伤具有保护作用,能拮抗阿霉素对体外培养足细胞的损伤作用[11]。Sch B是从五味子中提取的中药单体,既往研究结果表明,其具有抗氧化、抗肿瘤等作用,对心脑肝肾等重要器官均具有保护作用,而且对机体正常的细胞没有毒性作用。本研究初步证实Sch B可能通过抑制HIF-1α蛋白和iNOS mRNA的表达减少HK-2细胞的凋亡,从而对HK-2细胞缺氧损伤起保护作用,但其具体机制还需要进一步研究。
[1]Chen P,Pang S,Yang N,et al.Beneficial effects of schisandrin B on the cardiac function in mice model of myocardial infarction[J].PloS one,2013,8(11):e79418.doi:10.1371/journal.pone.0079418.eCollection 2013.
[2]Chen N,Chiu PY,Ko KM.Schisandrin B enhances cerebral mitochondrial antioxidant status and structural integrity,and protects against cerebral ischemia/reperfusion injury in rats[J].Biol PharmBull,2008,31(7):1387-1391.
[3]Stacchiotti A,Li Volti G,Lavazza A,et al.Different role of Schisandrin B on mercury-induced renal damage in vivo and in vitro[J].Toxicology,2011,286(1-3):48-57.doi:10.1016/j.tox.2011.05.005.
[4]Zhu S,Wang Y,Chen M,et al.Protective effect of schisandrin B against cyclosporine A-induced nephrotoxicity in vitro and in vivo [J].Am J Chin Med,2012,40(3):551-566.doi:10.1142/ S0192415X12500425.
[5]Bunel V,Antoine MH,Nortier J,et al.Protective effects of schizandrin and schizandrin B towards cisplatin nephrotoxicity in vitro[J].J Appl Toxicol,2014,34(12):1311-1319.doi:10.1002/jat.2951.
[6]Song H,Han IY,Kim Y,et al.The NADPH oxidase inhibitor DPI can abolish hypoxia-induced apoptosis of human kidney proximal tubular epithelial cells through Bcl2 up-regulation via ERK activation without ROS reduction[J].Life Sci,2015,126:69-75.doi: 10.1016/j.lfs.2015.02.004.
[7]Zhang Q,Qian Z,Pan L,et al.Hypoxia-inducible factor 1 mediates the anti-apoptosis of berberine in neurons during hypoxia/ischemia [J].Acta Physiol Hung,2012,99(3):311-323.doi:10.1556/ APhysiol.99.2012.3.8.
[8]Sarwat AM,Al-Salam S.Expression of HIF-1,galectin-3,cox-2 and Wilms tumor-1 protein in multiple schwannomas of the conus medullaris[J].J Neurooncol,2009,92(1):111-115.
[9]Liu HT,Mu DZ.Inducible nitric oxide synthase and brain hypoxicischemic brain damage[J].Chin J Contemp Pediatr,2014,16(9): 962-967.[刘海婷,母得志.诱导型一氧化氮合酶和缺氧缺血脑损伤[J].中国当代儿科杂志,2014,16(9):962-967].doi: 10.7499/j.issn.1008-8830.2014.09.022.
[10]Hu R,Dai A,Tan S.Hypoxia-inducible factor 1 alpha upregulates the expression of inducible nitric oxide synthase gene in pulmonary arteries of hyposic rat[J].Chin Med J(Engl),2002,115(12):1833-1837.
[11]Ai C,Tan XY,Zhang MZ,et al.Effects of Schisandra Chinensis Fruit Ethanol Extract on Nephrin and Desmin Expression in Adriamycin Induced Podocyte Injury[J].Tianjin Med J,2014,42(6): 526-529.[艾辰,谭小月,张勉之,等.五味子醇提液对阿霉素损伤足细胞中nephrin和desmin表达的影响[J].天津医药,2014,42 (6):526-529].doi:10.3969/j.issn.0253-9896.2014.06.004.
(2015-03-04收稿 2015-03-18修回)
(本文编辑 李鹏)
Protective effects of schisandrin B on hypoxia injury of HK-2 cells
LU Ailong1,TAN Xiaoyue2,ZHANG Mianzhi3△,WU Yinna1
1 Tianjin Medical University,Tianjin 300070,China;2 Medical School of Nankai University;3 Tianjin Gongan Hospital
△Corresponding Author E-mail:zhangmianzhi@vip.sina.com
Objective To explore the protective effects of schisandrin B(Sch B)on hypoxia injury induced by cobaltous chloride(CoCl2)in human proximal renal tubular epithelial(HK-2)cells,and the possible mechanism thereof.Methods HK-2 cells were randomly assigned to four groups:control group(Con,cells were untreated),CoCl2group(CoCl2,cells were treated with 600 μmol/L CoCl2for 24 h),Sch B pretreat group(CoCl2+Sch B,cells were pretreated with 1 μmol/L and 10 μmol/L Sch B for 2 h)and Sch B group(Sch B,cells were treated with 1 μmol/L and 10 μmol/L Sch B for 2 h).CCK-8 kit was used to detect the cell viability of four groups.Flow cytometry was used to detect the apoptotic rate of four groups.The protein expression of hypoxia-inducible factor 1α(HIF-1α)was assessed by Western blot assay.The expressions of HIF-1α and inducible nitric oxide synthase(iNOS)mRNA were determined by RT-PCR.Results Compared with the control group,after treated with 600 μmol/L CoCl2,the cell viability was decreased,and the apoptosis was increased,the expressions of HIF-1α and iNOS mRNA were up-regulated in HK-2 cells.There was no significant difference in the expression of HIF-1α mRNA between control group and CoCl2group.Compared with the CoCl2group,after pretreated with 1 μmol/L and 10 μmol/L Sch B,the cell viability was increased and the apoptosis was decreased,the expressions of HIF-1α and iNOS were down-regulated in HK-2 cells.There were no significant differences in the cell viability and apoptotic rate between control group and Sch B group.Conclusion Pretreatment with Sch B can reduce the apoptosis of HK-2 cells by inhibiting the expression of HIF-1α and iNOS mRNA,which shows protective effects on hypoxia injury.
apoptosis;hypoxia-inducible factor 1,alpha subunit;nitric oxide synthase;schisandrin B;HK-2 cells;cobaltous chloride;inducible nitric oxide synthase
R692
A DOI:10.11958/j.issn.0253-9896.2015.05.005
天津市应用基础与前沿技术研究计划(14JCYBJC28200)
1天津医科大学(邮编300070);2南开大学医学院;3天津市公安医院
卢爱龙(1988),男,硕士研究生在读,主要从事肾缺血再灌注损伤研究
△E-mail:zhangmianzhi@vip.sina.com
