亚热带天然常绿阔叶林转变为杉木人工林对土壤微生物呼吸的影响
2015-08-22冯建新高伟民胡双成陈光水
冯建新,高伟民,邓 飞,胡双成,陈光水*
(1.福建师范大学地理科学学院,福州350007;2.湿润亚热带山地生态国家重点实验室培育基地,福州350007)
土壤是陆地生态系统最大的碳库,全球大约有1500 Gt碳以有机质形态储存于土壤中[1-2],是陆地植被碳库的2~3倍,是全球大气碳库的2倍多[3]。常绿阔叶天然林重新造林后形成的人工杉木 (Cunninghamia lanceolata)林有机质质量发生了很大改变[4],其随着林分年龄的增长才能逐渐恢复到常绿阔叶天然林的最初状态。在天然林转变为杉木林期间,微生物的组成成分也发生了很大变化,生态系统、有机质质量也慢慢转变,环境压力也增加。土壤可溶性有机碳 (DOC)、可溶性总氮 (DN)、微生物生物量碳 (MBC)、微生物生物量氮 (MBN)、微生物呼吸 (BR)及呼吸商 (qCO2)可以用来指示土壤质量,尤其在天然林转变为人工林期间qCO2是衡量土壤微生物活性的有效指标[5],反映了有机碳被微生物利用的效率[6]。通过观测土壤DOC、DN、MBC、MBN含量及BR和qCO2的变化,可以用于反映常绿阔叶天然林转换为人工杉木林后土壤质量的变化。
至2005年,全球地区的人工林已经达到1.396×108hm-2,保持2%的增长率,而且在天然林上重新造林大约已达到亚热带人工林的一半以上[7]。常绿阔叶天然林在区域生态安全保障和碳吸存等方面均具有十分重要的作用。然而,在过去几十年中,大面积的常绿阔叶林经皆伐、炼山和整地后转变为针叶树人工林,其中杉木林作为一种最重要的人工商品林,已占中国南方人工林面积的1/3[8]。这种大量的常绿阔叶天然林被经济效益高的人工杉木林替代,必然导致土壤质量降低。所以研究常绿阔叶天然林转变为人工杉木林后土壤DOC、DN、MBC、MBN含量及BR和qCO2的变化对于揭示人为干扰对土壤呼吸和碳库的影响具有重要的意义。
近几十年,国内外学者对天然林转变为人工林后土壤DOC含量的变化已进行了大量研究工作,如林伟盛等[9]对米槠 (Castanopsis carlesii)天然林变成杉木人工林后土壤DOC含量的变化进行研究,发现米槠天然林土壤DOC含量高于杉木林,而且同一林分中,0~10 cm土层DOC含量大于10~20 cm土层;王清奎等[10]对亚热带地区森林植被转变对易变土壤有机质进行研究,发现次生阔叶林转变为杉木林后MBC、MBN、经过冷水和热水浸提后的DOC、可溶性有机氮 (DON)含量都下降了;胡亚林等[11]对杉木人工林取代天然次生阔叶林对土壤生物活性的影响进做了详细介绍,发现杉木人工林取代天然次生阔叶林后表层土壤总有机碳 (TOC)、土壤全氮 (TN)均减少。而对天然林转变为人工林后微生物呼吸只有少许研究,如辛勤等[12]对中国亚热带森林土壤呼吸的基本特点进行研究,但是对指示土壤质量好的其他因素 (TN、MBC、MBN、qCO2)的研究很少,尤其是土壤qCO2的研究更少。这限制了对维持和提高森林土壤质量以及对于常绿阔叶天然林转变为人工杉木林后土壤生态过程的更深层次的理解。本研究以福建建瓯万木林省级自然保护区常绿阔叶天然林和杉木人工林为研究对象,研究天然林转换为人工林对DOC、DN、MBC、MBN含量及BR和qCO2的影响,为深入了解森林类型转换对土壤碳吸存的影响机制提供基础数据。
1 材料与方法
1.1 试验地概况
试验样地位于福建省建瓯市万木林自然保护区 (27°02'28″~27°03'32″N,118°02'22″~118°09'23″E),已有600多年的历史,保护区森林覆盖率高达96.1%。该试验样地植被为常绿双子叶植物阔叶树种,其中以樟科 (Lauraceae)、木兰科 (Magnoliaceae)、壳斗科 (Fagaceae)、冬青科 (Aquifoliaceae)、杜英科 (Elaeocarpaceae)、山茶科(Theaceae)、山矾科 (Symplocaceae)和金缕梅科 (Hamamelidaceae)等为主。本研究选择该保护区内的常绿阔叶天然林及其邻近的由其转变的杉木人工林为研究对象。在每种林分类型中分别建立3块20 m×20 m固定标准样地。
常绿阔叶天然林试验样地海拔360 m,年龄约110 a,乔木层以罗浮栲 (Castanopsis fabri)、浙江桂(Cinnamomum chekiangense)、福建山矾 (Symplocos fukienensis)、木荷 (Schima superba)、虎皮楠(Daphniphyllum oldhami)、油茶 (Camellia oleifera)和桂北木姜子 (Litsea subcoriace)为主,树种组成复杂;灌木层主要以披针叶山矾 (Symplocos fukienensis)、沿海紫金牛 (Ardisia punctata)、狗脊 (Woodwardia japonica)等为主;草本层以团叶鳞始蕨 (Lindsaea orbiculata)等蕨类为主。
杉木人工林试验样地海拔350 m,西北坡向,坡度21°,1969年由常绿阔叶天然林砍伐后人工重新造林而成,人工杉木林与现存常绿阔叶天然林毗邻,本地土壤条件相似 (母岩、土层),密度1 117株·hm-2,杉木林平均树高为18 m,平均胸径为18.3 cm。灌木层以杜茎山 (Maesa japonica)、草珊瑚 (Sarcandra glabra)、狗骨柴 (Tricalysia dubia)为主,草本有狗脊 (Woodwardia japonica)、乌毛蕨(Blcehnum orientale)、五节芒 (Miscanthus floridulus)等[13]。
常绿阔叶天然林与杉木人工林土壤理化性质 (0~20 cm)见表1。

表1 常绿阔叶天然林和杉木人工林土壤理化性质 (0~20 cm)Table1 Soil physical and chemical properties in evergreen broad-leaved forest and Chinese fir plantation(0~20 cm)
1.2 研究方法
1.2.1 土壤取样
在2013年10月底去试验样地进行土壤取样。采用随机法分别在每个标准样地挖取3个大约1 m土壤剖面,用环刀取表层 (0~10 cm)和底层 (40~60 cm)土壤,放入自封袋,共计12份土样,做好记号并立即送回实验室。在实验室内用镊子挑除粗粒、细根和杂物,混合均匀后过2 mm筛,置于低温冰箱中保存。
1.2.2 土壤样品的测定方法
采用氯仿熏蒸浸提法测定土壤MBC、MBN含量。重要操作如下:准确称量10 g新鲜土样于100 mL烧杯中,每份土样重复3次,放入同一真空干燥器中,另放置盛有氯仿的小烧杯1只,烧杯内放少量瓷片,防止爆沸。同时放入盛有20 mL 5 mol·L-1NaOH溶液小烧杯1只,干燥器底部还应撒入少量水以保持湿度。在真空装置下进行抽真空,使氯仿剧烈沸腾5 min,完成后置于黑暗环境中1天。称取等量土样用于测定土壤含水量,并另称取等量的土样,同上处理但不进行氯仿熏蒸,作为空白对照,同时进行。熏蒸结束后,把烧杯的土样倒入离心管中,加入50 mL 0.5 mol· L-1K2SO4,在250 r·min-1速率下振荡30 min,在离心机上4 000 r·min-1离心率下离心10 min,上清液倒入装有0.45 μm滤膜的过滤器中并使用循环水真空泵减压过滤 (压力为-0.09 MPa)。所得滤液用TOC测定仪测定DOC浓度,用连续流动分析仪测定DN浓度。
土壤微生物生物量碳 (MBC)用公式:

式 (1)中,EC为熏蒸与未熏蒸土壤有机碳含量的差值;kEC为转换系数,取值0.38[14]。
土壤微生物生物量氮 (MBN)用公式:

式 (2)中,EN为熏蒸与未熏蒸土壤氮的差值;kEN为转换系数,取值0.45[15].
采用密闭碱液吸收滴定法来测定土壤基础呼吸[16]。重要实验步骤如下:把相当于烘干土50 g的新鲜土壤放入500 mL广口瓶中,土壤含水量调整为最大持水量的60%,同时瓶内放入盛20 mL 0.5 mol·L-1NaOH的小烧杯。广口瓶用凡士林密封,于28℃培养箱中培养48 h,准时取出小烧杯,以酚酞为指示剂,用0.5 mol·L-1HCl滴定,试验重复3次。同时,另取同样体积的广口瓶不加土壤,同上处理作为空白对照。根据滴定的体积之差,求出48 h内消耗于吸收土壤CO2的0.5 mol·L-1NaOH量。按每消耗0.5 mol· L-1NaOH 1 mL相当于11 mg CO2,计算出CO2释放量。
土壤基础呼吸 (BR)用公式:

式 (3)中,CO2-C为培养48 h土壤微生物呼吸放出的总碳[17],m为干土质量,d为培养天数。土壤微生物呼吸商 (%)用公式:

式 (4)中,CO2-C为培养48 h土壤微生物呼吸放出的总碳,MBC为土壤微生物生物量碳。
1.2.3 数据分析方法
采用双因素方差分析检验林分类型和土层对土壤各指标的影响,采用独立样本t检验分析同一林分类型不同土层或同一土层林分类型之间的差异。所有分析用SPSS 19.0软件进行统计分析,显著性水平设定为α=0.05。
2 结果与分析
2.1 土壤DOC、DN含量
从表2可以看出,林分类型和土层厚度及两者间的交互作用,均对土壤DOC和DN的影响达到了极显著水平 (P<0.01)。从图1、2中发现,杉木林取代天然林后,0~10 cm土层的DOC、DN含量均显著降低 (P<0.05),40~60 cm土层的DN含量亦显著降低 (P<0.05),但DOC含量的差异则不显著。同一林分中,不同土层DOC、DN含量均为0~10 cm土层显著大于40~60 cm土层 (P<0.05)。
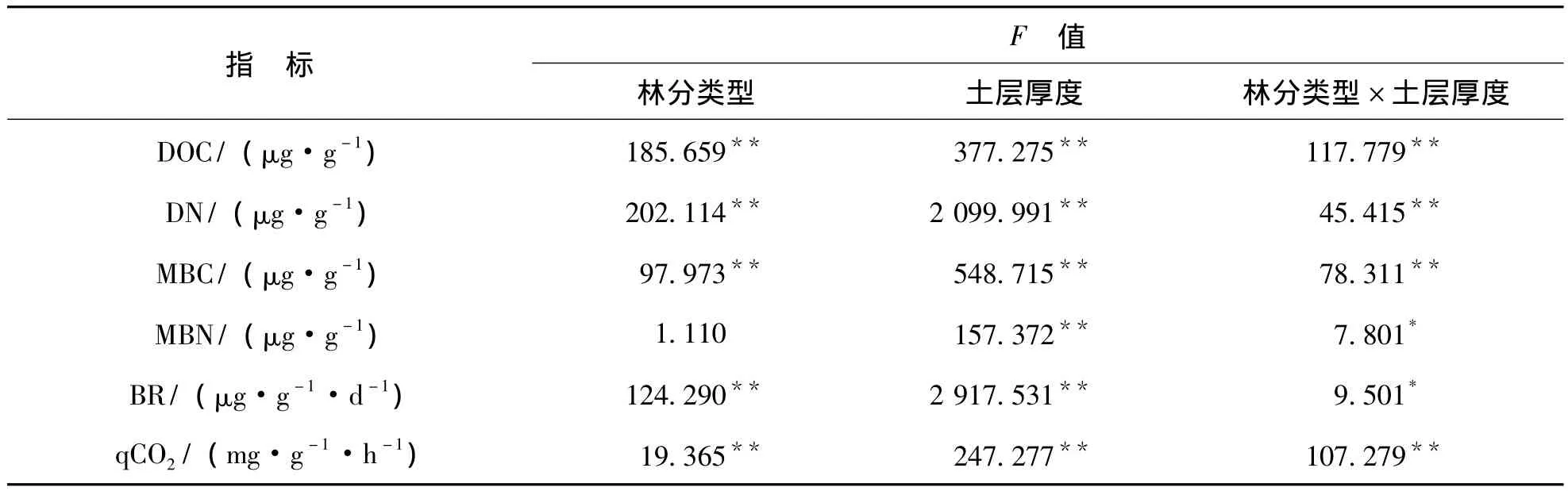
表2 林分类型与土层厚度对土壤各指标影响的双因素分析Table2 Two-way ANOVA of the effects of forest types and soil thickness on soil characteristics
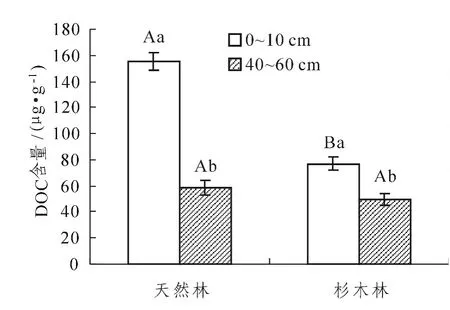
图1 不同林分不同土层的可溶性有机碳 (DOC)含量Figure1 Dissolved organic carbon(DOC)concentrations of soils with different stands and depths
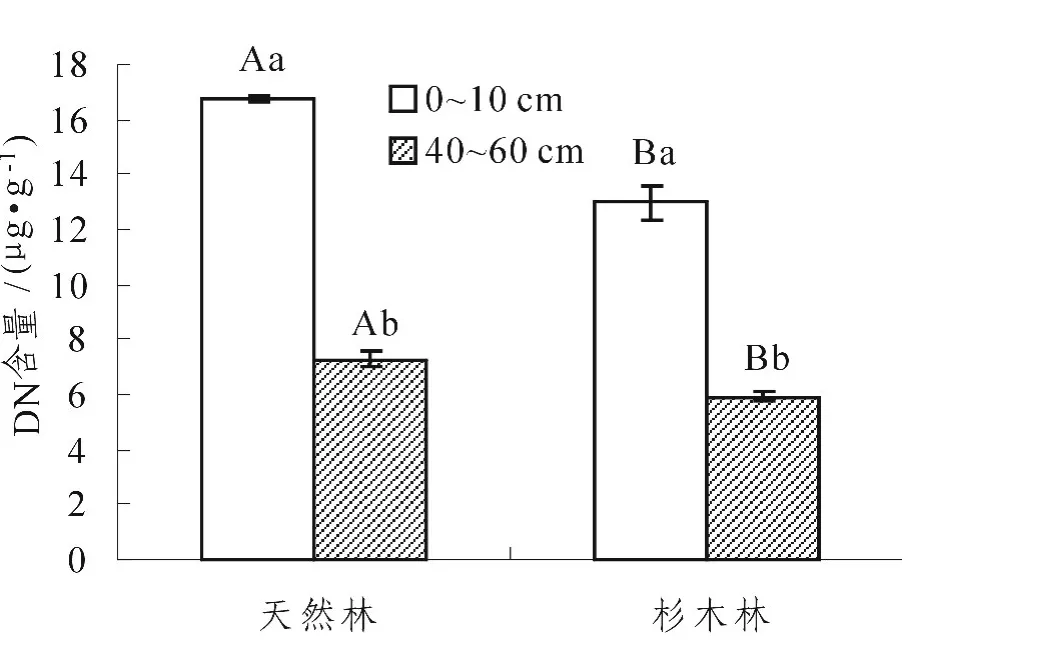
图2 不同林分不同土层可溶性总氮 (DN)含量Figure2 Dissolved total nitrogen(DN)concentrations of soils with different stands and depths
2.2 土壤MBC、MBN含量
从表2中可以看出,林分类型和土层厚度及两者间的交互作用对MBC的影响达到了极显著水平(P<0.01);土层厚度对MBN的影响达到了极显著水平 (P<0.01),林分类型与土层厚度之间的交互作用对MBN的影响达到了显著水平 (P<0.05),而林分类型对MBN的作用不显著 (P>0.05)。从图3中发现,与天然林相比,杉木林0~10 cm土层MBC含量显著降低 (P<0.05),但40~60 cm土层MBC含量差异则不显著降低 (P>0.05)。从图4中发现,与天然林相比,杉木林0~10 cm土层MBN含量差异不显著升高 (P>0.05),而40~60 cm土层MBN含量显著降低 (P<0.05)。同一林分中,不同土层的MBC含量、MBN含量均是0~10 cm土层显著大于40~60 cm土层 (P<0.05)。

图3 不同林分不同土层微生物生物量碳 (MBC)含量Figure3 Microbial biomass carbon(MBC)concentrations of soils with different stand and depths
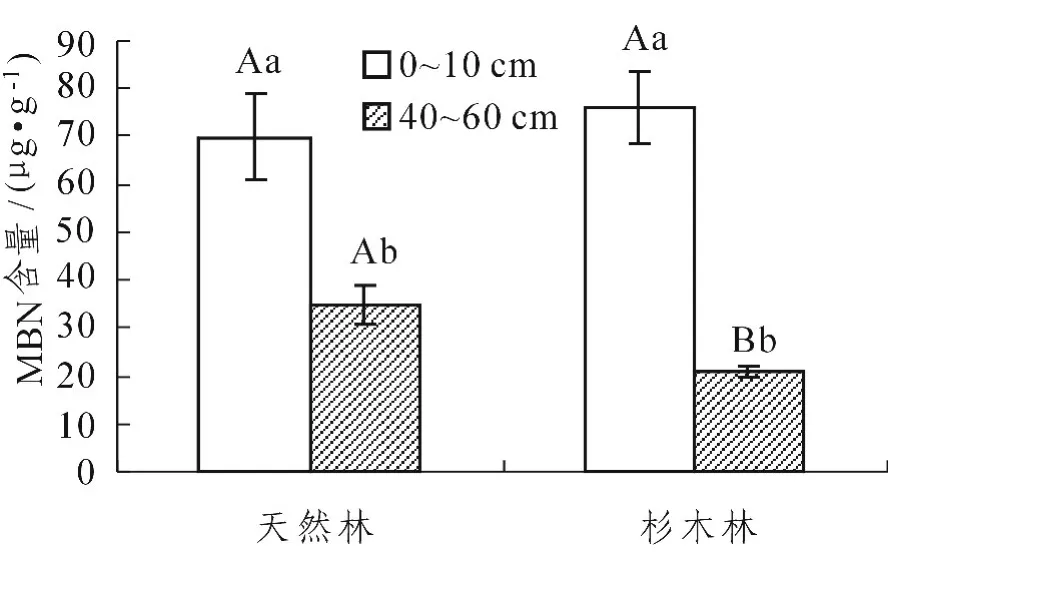
图4 不同林分不同土层微生物生物量氮 (MBN)含量Figure4 Microbial biomass nitrogen(MBN)concentrations of soils with of different stands and depths
2.3 土壤微生物呼吸 (BR)及呼吸商 (qCO2)
从表2可以看出,林分类型和土层厚度对BR的影响达到了极显著水平 (P<0.01),林分类型与土层厚度的交互作用对BR的影响达到了显著水平 (P<0.05)。林分类型和土层厚度及两者之间的交互作用对qCO2的影响达到了极显著水平 (P<0.01)。从图5中看出,与天然林相比,杉木林0~10 cm土层和40~60 cm土层BR强度均显著降低 (P<0.05);同一林分中,不同土层的BR强度均是0~10 cm土层显著高于40~60 cm土层 (P<0.05)。从图6中发现,与天然林相比,杉木林0~10 cm土层和40~60 cm土层qCO2均显著升高 (P<0.05);同一林分中,0~10 cm土层qCO2均显著低于40~60 cm土层 (P<0.05)。
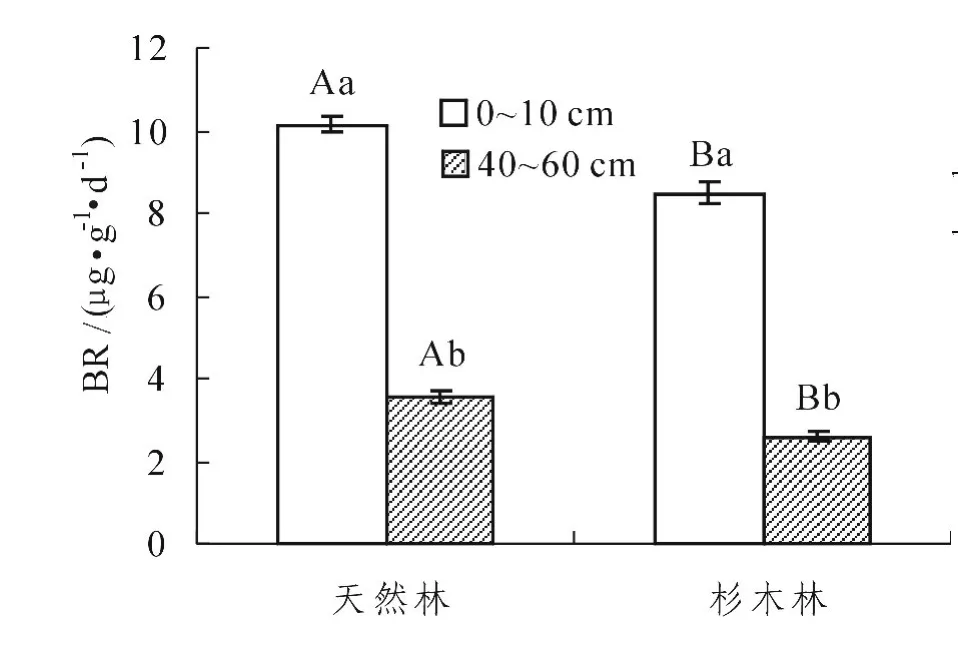
图5 不同林分不同土层的微生物呼吸 (BR)强度Figure5 Microbial respiration(BR)rates of soils with different stands and depths
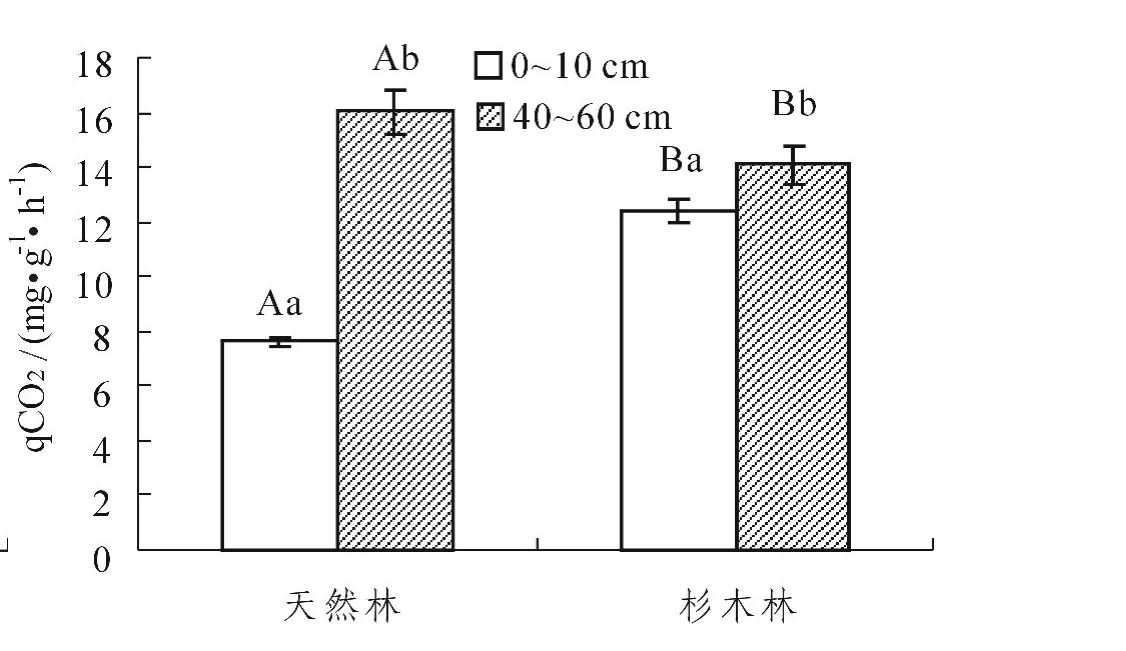
图6 不同林分不同土层的呼吸商 (qCO2)Figure6 Respiratory quotient(qCO2)of soils with different stands and depths
3 讨论
3.1 天然林转变为杉木林土壤DOC、DN含量变化
土壤DOC是土壤活性有机碳的重要组成部分,也是有机物质的增加与损失之间的平衡,它在提供土壤养分方面有着重要作用,并且在土壤生化循环方面有着重要作用。土壤DN是植物生长和发育的主要影响因素之一,可以很好地反映天然林转变为人工林植被的变化,对维持生态系统的功能、生物地球化学循环和森林的可持续发展具有重要作用。本研究结果显示,不同林分土壤DOC含量在63.27~106.94 μg·g-1之间,这与Qualls[18]等关于阿巴拉契亚山脉皆伐后的落叶林可溶性有机质和无机养分通量的研究结果 (10~150 μg·g-1)类似,同时也符合Linn和Doran[19]关于美国不同耕作方式土壤可溶性碳的研究结果,他们的研究表明,土壤DOC的含量一般不高,很少超过200 μg·g-1。不同林分土壤DN含量在9.46~12.03 μg·g-1之间,高于丁九敏等[20]关于雪灾对武夷山常绿阔叶林土壤有效氮的影响研究结果 (1.20~3.62 μg·g-1),导致这种差异的原因可能与土壤环境因素有关,也可能与人为干扰因素有关。天然林受人为干扰后转变为人工林,土壤有机质的矿化率一般都会提高,则土壤中的可溶性氮将会增加。
同一土层中,天然林土壤DOC含量高于杉木林,这一研究结果与国内一些针对阔叶林和针叶林土壤DOC含量的研究结果类似[21]。这与天然林转变为杉木林,凋落物数量的减少[22-23],水热养分条件变差,微生物数量的减少有关。同一林分中,0~10 cm土层土壤DOC含量均显著高于40~60 cm,这主要与凋落物归还量和细根均集中分布于表层土壤有关。
同一土层中,天然林土壤DN含量都高于杉木林,这一研究结果与王清奎等关于阔叶林与杉木林土壤可溶性总氮含量的研究结果相似[24]。这可能是因为天然林的凋落物数量大于杉木林,而凋落物数量越多,溶解于土壤中的可溶性总氮量就越多。同一林分中,0~10 cm土层的土壤DN含量高于40~60 cm。这是由于随着土层深度的不断增加,土壤环境逐渐变差,有机质含量越来越少,土壤微生物自身性质迅速下降,可溶性总氮矿化速率随之下降[25],所以DN积累的就少,也就是说40~60 cm的DN含量就比0~10 cm的DN含量少。
3.2 天然林转变为人工林微生物生物量 (MBC、MBN)含量变化
土壤微生物量是土壤养分和植物养分的来源,可以被用来指示天然林转变为人工林期间土壤肥力水平变化。土壤微生物量中MBC、MBN占了绝大部分比例,所以研究土壤微生物生物量的变化主要研究MBC、MBN。王清奎等研究表明,土壤MBC含量在第一代、第二代杉木纯林和地带性阔叶林中差别很大,范围为365.4~840.6 μg·g-1[26],与本研究结果 (土壤 MBC 变化幅度为 435.90 ~777.27 μg·g-1)相似。另外,本研究结果显示土壤MBN含量在48.58~52.36 μg·g-1之间,这与吴建国关于祁连山山地森林的MBN含量类似[27]。
同一林分中,土壤MBC、MBN集中在表层 (0~10 cm),并随土壤厚度的加深而减少,这与周焱等关于武夷山不同海拔梯度土壤微生物生物量的结果相似[28],也与刘爽等[29]关于五种温带森林土壤微生物生物量碳氮的研究结果相似。出现这种差异可能与表层土壤枯枝落叶层积累、有机质含量较高及良好的通气状况、水热条件有关[30]。在亚热带森林中,由于植物细根和地上凋落物的快速周转,土壤表层腐殖质的剧增提升了对土壤有机质的利用[31],有利于微生物繁殖和生长。而且随着土层厚度的加深,温度与湿度条件变差,微生物的生物量数量就越少,则其土壤MBC、MBN含量就明显低于上层[32]。
同一土层中,常绿阔叶天然林土壤MBC含量高于人工杉木林,本研究结论与朱志建等[33]的研究结论相似,朱志建等研究了4类森林植被下MBC含量,平均值是:常绿阔叶林>马尾松林>毛竹林>杉木林,而且阔叶林下土壤MBC含量明显高于其他3种林分。这可能与林地类型的凋落物数量、有机质含量有关。
0~10 cm土层,常绿阔叶天然林土壤MBN含量与人工杉木林没有显著差异,但在40~60 cm土层,常绿阔叶天然林土壤MBN含量显著高于人工杉木林。这是因为土壤MBN含量不仅与凋落物数量有关,还与复杂的季节动态[34]有关,很多环境因素和生物因素可能同时对其产生影响,加上本实验只有进行一次秋季的观测,所以不能准确地表明不同土层天然林转变为人工林后的土壤微生物量氮含量,这些有待于进一步研究。
3.3 天然林转变为人工林微生物呼吸 (BR)、呼吸商 (qCO2)变化
土壤BR是表征土壤质量和土壤肥力的重要生物学指标,它反映了土壤生物活性和土壤物质代谢的强度。尤其是土壤基础呼吸反映了土壤生物的活性和土壤物质新陈代谢的强度[35]。呼吸商 (qCO2)又称为代谢商,用来表征单位生物量的微生物在单位时间内的呼吸作用的大小,显示了比较低的微生物代谢,可以作为一个指标用来反映环境因素、管理措施变化等对微生物性质的影响[19]。
同一土层中,天然林转变为人工林后,不同土层微生物呼吸强度均显著降低,表明天然林转变为人工林后土壤微生物代谢强度降低,土层中的水热养分条件变差,土壤碳有效性降低。这与杨玉盛等[36]的研究结果相似,他们的研究显示天然林土壤呼吸年通量高于人工林,也与鼎湖山季风常绿阔叶林土壤呼吸高于马尾松林的结果相似[37]。同一林分中,表层 (0~10 cm)的土壤微生物基础呼吸显著高于底层 (40~60 cm)的土壤呼吸,主要和土壤微生物数量、土壤碳有效性、温度等有关。以往的研究表明,温度是土壤呼吸速率变化的主要驱动因子[38-39]。土壤呼吸与土壤温度,特别是土壤5 cm温度具有良好的相关性[40]。
国内外学者研究表明,土壤微生物呼吸速率高,而qCO2值小,可以保证土壤既有较高的代谢效率,又使土壤有充分的活性有机质,对维持土壤的优良特性和可持续利用潜力有益[41]。本研究显示qCO2随着土层的加深而升高,说明0~10 cm土层微生物呼吸消耗的碳比例小,40~60 cm土层微生物呼吸消耗的碳比例大。可能是因为表层比底层有更多的凋落物数量和相对更多的细根,因此表层中就有更好的水热、养分条件,当然就有更多的能量用于生物生长,呼吸消耗的少。还有一个原因可能是,表层 (0~10 cm)土壤和底层 (40~60 cm)土壤的细菌和真菌生物量的比值不同,细根产生很小的生物量,但表现出更高的呼吸速率,底层土壤细菌相对丰富度比表层的更多,因此底层土壤具有呼吸消耗的碳比例相对更大,引起了微生物呼吸商的加大[42]。在表层 (0~10 cm),天然林转变为杉木林后,土壤qCO2显著升高了,而在底层 (40~60 cm),天然林转变为杉木林后,土壤qCO2却降低了。qCO2的影响因素十分复杂,可能与季节有关还与MBC、MBN、BR有关,而本实验只有取秋季进行一次的观测,很难准确的表明不同土层,天然林转变为人工林后,土壤qCO2的升降,这些有待于进一步研究。
4 结论
本研究结果显示:同一林分中,土壤表层 (0~10 cm)的DOC含量、DN含量、MBC、MBN、BR均比土壤底层 (40~60 cm)高,而土壤表层的qCO2却比底层的低。这与土壤本身的理化性质和凋落物数量有很大关联。同一土层中,常绿阔叶天然林转变为人工杉木林土壤DOC含量、DN含量、MBC、MBN、BR均降低。造成这种差异的原因是不同林分的土壤生物化学性质的结果。因而DOC、DN、MBC、MBN、BR可以较好地反映土壤的肥力状况。而常绿阔叶天然林转变为人工杉木林qCO2反而升高了。说明与人工杉木林相比,常绿阔叶天然林土壤微生物有更高的碳利用效率,更优的土壤特性,可持续利用潜力更足。所以我们应尽量减少对常绿阔叶天然林的砍伐,应加强对常绿阔叶天然林的保护。不要为了经济效益,而盲目种植经济效益高的人工杉木林。
[1]Eswaran H,Van den Berg E,Reich P.Organic carbon in soils of the world[J].Soil Science Society of America Journal,1993,57:192-194.
[2]Jobbágy E G,Jackson R B.The vertical distribution of soil organic carbon and its relation to climate and vegetation[J].Ecological Applications,2000,10:423-436.
[3]Su Yong-zhong,Zhao Ha-lin.Advances in researches on soil organic carbon storages,affecting factors and its environmental effects[J].Journal of Desert Research,2002,22(3):220-228.[苏永中,赵哈林.土壤有机碳储量、影响因素及其环境效益的研究进展 [J].中国沙漠,2002,22(3):220-228.]
[4]Joergensen R G,Anderson T H,Wolters V.Carbon and nitrogen relationships in the microbial biomass in soils in beech(Fagus sylvatica L.)forests[J].Biology and Fertility of Soils,1995,19:141-147.
[5]Wardle D A,Ghani A.A critique of the microbial metabolic quotient(qCO2)as a bio-indicator of disturbance and ecosystem development[J].Soil Biology&Biochemistry,1997,27:1601-1610.
[6]Knoepp J D,Coleman D C,Crossley D A,et al.Biological indices of soil quality:An ecosystem case study of their use[J].Forest Ecology and Management,2000,138:357-368.
[7]Van Dijk A I J M,Keenan R J.Planted forests and water in perspective[J].Forest Ecology and Management,2007,251:1-9.
[8]Yang Yu-sheng.Study on Sustainable Management of Chinese Fir[M].Beijing:China Foresty Publishing House,1998.[杨玉盛.杉木林可持续经营的研究 [M].北京:中国林业出版社,1998.]
[9]Lin Wei-sheng,Yang Zhi-jie,Guo Jian-fen,et al.Change of soil dissolved organic carbon after converting naturalCatanopsis carlesisforest intoCunninghamia lanceolataplantation in subtropical China[J].Journal of Subtropical Resources and Environment,2013,8(1):41-47.[林伟盛,杨智杰,郭剑芬,等.米槠天然林转变成杉木人工林后土壤可溶性有机碳的变化 [J].亚热带资源与环境学报,2013,8(1):41-47.]
[10]Wang Qing-kui,Wang Si-long,Yu Xiao-jun.Response of labile soil organic matter to changes in forest vegetation in subtropical regions[J].Applied Soil Ecology,2011,47:210-216.
[11]Hu Ya-lin,Wang Si-long,Yan Shao-kui,et al.Effects of replacing natural secondary broad-leaved forest withCunninghamia lanceolataplantation on soil biological activities[J].Chinese Journal of Applied Ecology,2005,16(8):1411-1416.[胡亚林,汪思龙,颜绍馗,等.杉木人工林取代天然次生阔叶林对土壤生物活性的影响 [J].应用生态学报,2005,16(8):1411-1416.]
[12]Xin Qin,Liu Yuan-yue,Liu Yun-bin.Elementary characteristics of soil respiration in Chinese subtropical forests[J].Journal of Chengdu University(Natural Science Edition),2010,29(1):32-35.[辛勤,刘源月,刘云斌.中国亚热带森林土壤呼吸的基本特点 [J].成都大学学报 (自然科学版),2010,29(1):32-35.]
[13]Guo Jian-fen,Chen Guang-shui,Qian Wei,et al.Litter production and nutrient return in two natural forests and aCunninghamia lanceolataplantation in Wanmulin nature reserve[J].Acta Ecologica Sinica,2006,26(12):4091-4098.[郭剑芬,陈光水,钱伟,等.万木林自然保护区2种天然林及杉木人工凋落物及养分归还[J].生态学报,2006,26(12):4091-4098.]
[14]Vance E D,Brookes P C,Jenkinson D S.An extraction method for measuring soil microbial biomass C[J].Soil Biology and Biochemistry,1987,19:703-707.
[15]Jenkinson D S.Determination of microbial biomass carbon and nitrogen in soil[C] //Advances in Nitrogen Cycling in Agricultural Ecosystems,1988:368-386.
[16]Yao Huai-ying,Huang Chang-yong.Soil Microbial Ecology and Experiment Technology[M].Beijing:Science Press,2006.[姚槐应,黄昌勇.土壤微生物生态学及其实验技术 [M].北京:科学出版社,2006.]
[17]Salifou T,Lamourdia T,Jeanne R M,et al.Carbon and nitrogen enhancement in Cambisois and Vertiso by Acacia spp in eastern Burkina Fasa Relation to soil respiration and microbial biomass[J].Applied Soil Ecology,2006,35:660-669.
[18]Qualls R G,HainesB L,SwankW T,et al.Soluble organic and inorganic nutrient fluxes in clearcut and mature deciduous forests[J].Soil Science Society of America Journal,2000,64:1068-1077.
[19]Linn D M,DoranJ W.Aerobic and anaerobic microbial populations in no-till and plowed soils[J].Soil Science Society of America Journal,1984,48:1267-1272.
[20]Ding Jiu-min,Xu Han-mei,Liu Sheng,et al.Effects of snow storm on soil available nitrogen in evergreen broad leaf forest in Wuyi Mountain[J].Journal of Nanjing Forestry University(Natural Science Edition),2010,34(3):136-140.[丁九敏,徐涵湄,刘胜,等.雪灾对武夷山常绿阔叶林土壤有效氮的影响 [J].南京林业大学学报 (自然科学版),2010,34(3):136-140.]
[21]Guo Jian-fen,Yang Yu-sheng,Chen Guang-shui,et al.Organic components of the forest floor and coarse woody debris in natural and monoculture plantation forests ofCastanopsis Kawakamii[J].Journal of Subtropical Resources and Environment,2008,3(3):40-45.[郭剑芬,杨玉盛,陈光水,等.格式栲天然林与人工林枯枝落叶层和粗木质残体有机化学组成研究 [J].亚热带资源与环境学报,2008,3(3):40-45.]
[22]Liao Li-ping,Chen Chu-ying,Zhang Jia-wu,et al.Turnover of fine roots in pure and mixedcunninghamia lanceolataandmichelia macclureiforests[J].Chinese Journal of Applied Ecology,1995,6(1):7-10.[廖利平,陈楚莹,张家武,等.杉木、火力楠纯林及混交林细根周转的研究 [J].应用生态学报,1995,6(1):7-10.]
[23]Wu Wei-dong,Zhang Tao-lin,Sun Bo,et al.Degradation and control of soil organic matter and nutrient pool under artificial Chinese fir forest[J].Acta Pedologica Sinica,2000,37(1):41-47.[吴蔚东,张桃林,孙波,等.人工杉木林地有机物和养分库的退化与调控 [J].土壤学报,2000,37(1):41-47.]
[24]Wang Qing-kui,Fan Bing,Xu Guang-biao.Soil active organic matter in broadleaved forest and Chinese fir plantation in subtropical region of China[J].Chinese Journal of Applied Ecology,2009,20(7):1536-1542.[王清奎,范冰,徐广标.亚热带地区阔叶林与杉木林土壤活性有机碳比较 [J].应用生态学报,2009,20(7):1536-1542.]
[25]Li Gui-cai,Han Xing-guo,Huang Jian-hui,et al.A review of affecting factors of soil nitrogen mineralization in forest eco-systems[J].Acta Ecologica Sinica,2001,21(7):1187-1195.[李贵才,韩兴国,黄建辉,等.森林生态系统土壤氮矿化影响因素研究进展 [J].生态学报,2001,21(7):1187-1195.]
[26]Wang Qing-kui,Wang Si-long,Gao Hong,et al.Dynamics of soil active organic matter in Chinese fir plantations[J].Chinese Journal of Applied Ecology,2005,16(7):1270-1274.[王清奎,汪思龙,高洪,等.杉木人工林土壤活性有机质变化特征 [J].应用生态学报,2005,16(7):1270-1274.]
[27]Wu Jian-guo,Ai Li.Soil microbial activity and biomass C and N content in three typical ecosystems in Qilian mountains,China[J].Journal of Plant Ecology,2008,32(2):465-476.[吴建国,艾丽.祁连山3种典型生态系统土壤微生物活性和生物量碳氮含量 [J].植物生态学报,2008,32(2):465-476.]
[28]Zhou Yan,Xu Xian-gen,Wang Feng,et al.Soil microbial biomass respiration and metabolic quotient a long an altitudinal gradient in Wuyi mountain of southeastern China[J].Chinese Journal of Ecology,2009,28(2):265-269.[周焱,徐宪根,王丰,等.武夷山不同海拔梯度土壤微生物生物量、微生物呼吸及其商值[J].生态学杂志,2009,28(2):265-269.]
[29]Liu Shuang,Wang Chuan-kuan.Spatio-temporal patterns of soil microbial biomass carbon and nitrogen in five temperate forest ecosystems[J].Acta Ecologica Sinica,2010,30(12):3135-3143.[刘爽,王传宽.五种温带森林土壤微生物生物量碳氮的时空格局 [J].生态学报,2010,30(12):3135-3143.]
[30]Li Ling,Zhang Yu,Wang Li-bao,et al.Vertical changes of the soil microbial biomass and the correlation analysis in different forests[J].Journal of Central South University of Forestry and Technology,2007,27(2):52-60.[李灵,张玉,王利宝,等.不同林地土壤微生物垂直分布及相关性分布[J].中南林业科技大学学报,2007,27(2):52-60.]
[31]Torner J,Lambert M J,Johnson D W.Experience with patterns of change in soil carbon resulting from forest plantation establishment in eastern Australia[J].Forest Ecology and Management,2005,220:259-269.
[32]Huang Cheng-cai.Vertical distribution of soil microbial biomass of thePinus massonianaforest andCamellia sinensis[J].Journal of ShaoXing University,2002,3(1):62-65.[黄承才.马尾松和茶园土壤微生物生物量垂直分布研究 [J].绍兴文理学院学报,2002,3(1):62-65.]
[33]Zhu Zhi-jian,Jiang Pei-kun,Xu Qiu-fang.Study on the active organic carbon in soil under different types of vegetation[J].Forest Research,2006,19(4):523-526.[朱志建,姜培坤,徐秋芳.不同森林植被下土壤微生物量碳和易氧化态碳的比较 [J].林业科学研究,2006,19(4):523-526.]
[34]Wang Guo-bing,Ruan Hong-hua,Tang Yan-fei,et al.Seasonal fluctuation of soil microbial biomass carbon insecondary oakforest andPinus taedaplantation in north subtropical area of China[J].Chinese Journal of Applied Ecology,2008,19(1):37-42.[王国兵,阮宏华,唐燕飞,等.北亚热带次生栎林与火炬松人工林土壤微生物生物量碳的季节动态[J].应用生态学报,2008,19(1):37-42.]
[35]Liebig M A,Doran J M,Gardner J C.Evaluation of a field test kit for measuring selected soil quality indicators[J].Agronomy Journal,1996,88(4):683-686.
[36]Yang Yu-sheng,Chen Guang-shui,Wang Xiao-guo,et al.Response of soil CO2efflux to forest conversion in subtropical zone of China[J].Acta Ecologica Sinica,2005,25(7):1684-1690.[杨玉盛,陈光水,王小国,等.中国亚热带森林转换对土壤呼吸动态及通量的影响[J].生态学报,2005,25(7):1684-1690.]
[37]Yi Zhi-gang,Yi Wei-min,Zhou guo-yi,et al.Soil carbon effluxes of three major vegetation types in Dinghushan biosphere reserve[J].Acta Ecologica Sinica,2003,23(8):1673-1678.[易志刚,蚁伟民,周国逸,等.鼎湖山三种主要植被类型土壤碳释放研究[J].生态学报,2003,23(8):1673-1678.]
[38]Rodeghiero M,Cescatti A.Main determinants of forest soil respiration along an elevation/temperature gradient in the Italian Alps[J].Global Change Biology,2005,11:1024-1041.
[39]Davidson E A,Verchot L V,Cattanio J H,et al.Effects of soil water content on soil respiration in forests and cattle pastures of eastern Amazonia[J].Biogeochemistry,2000,48:53-69.
[40]Liu Shao-hui,Fang Jing-yun,Qing Tian-xin.Soil respiration of mountainous temperate forests in Beijing,China [J].Acta Phytoechologica Sinica,1988,22(2):119-126.[刘绍辉,方精云,清田信.北京山地温带森林的土壤呼吸[J].植物生态学报,1988,22(2):119-126.]
[41] Brix H.Use of constructed wetland in water pollution of duckweed based waste water treatment systems[J].Water Science and Technology,1994,35(5):239-246.
[42]Jalali M,Ranjbar F.Effects of sodic water on soil sodicity and nutrient leaching in poultry manure amended soils[J].Groderma,2009,153(1/2):194-204.
