温度和湿度对武夷山不同海拔土壤微生物氮的影响
2015-08-22范跃新陈仕东郭剑芬杨智杰钟小剑钟羡芳徐玲琳
范跃新,谢 麟,陈仕东,郭剑芬,杨智杰,钟小剑,钟羡芳,徐玲琳
(1.湿润亚热带山地生态国家重点实验室培育基地,福州350007;2.福建师范大学地理科学学院,福州350007)
土壤微生物量氮 (Microbial biomass nitrogen,MBN)是指土壤中所有活微生物体内所含有的氮,约占土壤有机氮总量的1%~5%,其数量虽少,但周转速率快,是土壤中最活跃的有机氮组分。MBN既是植物生长的重要氮源,也是土壤氮素生物地球化学循环的关键环节[1-2],厘清MBN含量变化机制及其影响因素,对揭示植物生产力变化和氮素在水-土-气之间的交换过程均有重要作用。
已有研究从耕作措施[3]、土壤理化性质[4-5]、森林转换[6]、凋落物分解[7]和季节动态[8-9]等不同角度报道了土壤MBN的变化及其影响因素。其中温度和湿度对MBN含量的影响出现不同的研究结果,如野外观测发现农田土壤MBN含量与温度、湿度变化无关[10-11],而Kaiser[12]等发现温度是MBN季节变化的主要原因,何振立[13]得出干旱和渍水均会引起MBN变化,刘秉儒[14]发现贺兰山不同海拔MBN含量与温度成反比,与含水量呈正比,说明温度和含水量影响土壤MBN含量。土壤温度和水分对MBN含量变化究竟是否存在影响?有何影响?探明这个问题对亚热带地区森林土壤氮循环对全球气候变化如何响应具有重要意义。
武夷山拥有全球同纬度现存面积最大、保存最完整的中亚热带森林生态系统,地带性植被类型为常绿阔叶林群落,是较为理想的天然试验场所。本研究以武夷山不同海拔土壤为研究对象,测定不同温度和湿度培养条件下土壤MBN含量,旨在揭示温度和湿度对土壤MBN的影响,为深入揭示亚热带地区土壤氮循环过程及影响因素提供依据。
1 研究区自然状况与研究方法
1.1 研究区自然概况
福建省武夷山国家级自然保护区位于福建省西北部 (27°33'~27°54'N,117°27'~117°51'E),年均气温12~18℃,年均相对湿度82%~85%,年均雾日100 d以上,年均降水量2 000 mm左右。拥有世界同纬度带现存面积最大、保存最完整的中亚热带常绿阔叶林。境内以黄岗山为主峰,海拔2 158 m,植被垂直带谱分布完整,沿海拔依次为常绿阔叶林 (Evergreen broadleaf forest)、针叶林(Coniferous forest)、中山矮林 (Dwarf forest)以及中山草甸 (Alpine meadow)等不同的植物群落。
1.2 研究方法
1.2.1 样地设置与野外取样
根据不同海拔梯度选择黄坑、庙湾、桐木关、黄岗山顶4个采样地段,分别代表红壤、黄红壤、黄壤和山地草甸土4种土壤类型。各采样地段基本情况如下:
黄坑,海拔310 m,年降雨量约1 850 mm,土壤类型为红壤。植被类型为针叶林,组成结构简单,以杉木人工林为主,灌木层和草本层稀疏。庙湾,海拔920 m,年降雨量约2 000 mm,土壤类型为黄红壤。植被类型为针阔混交林,乔木层以山茶、杉木、毛竹为主,地被层和灌木层较为发达。桐木关,海拔1 250 m,年降雨量约2 150 mm,土壤类型为黄壤。植被类型为中山矮林,乔木层以落叶树种为主,树干矮小,优势种为白檀 (Symplocos paniculata)、铁杉 (Tsuga heterophylla),参杂少量紫茎 (Stewartiasinensis)等。黄岗山顶,海拔2 000 m,年降雨量约3 000 mm,土壤类型为山地草甸土,植被类型为中山草甸,群落结构单一,草本层占优势,主要以禾本科青茅 (Calamagrostis brachytricha)为主,灌木零星分布其间,有云锦杜鹃 (Rhododendron fortunei)、猫儿刺 (Mahonia forunei)等。
于2008年5月在每个样点挖3个土壤剖面,采集表层土壤 (0~20 cm),去除植物根系和石砾,混匀后迅速带回实验室低温储存待测。不同土壤类型表层土壤理化性质见表1。

表1 采样点基本情况Table1 Soil properties of the study sites
1.2.2 样品室内处理
土壤样品分两部分处理。一部分风干过筛,测定土壤有机碳、全氮含量,另一部分用于培养实验,作如下处理:将所有样品过10目湿筛后称样,每份约125 g,将所有土样分为3组,每组36个 (4个海拔土壤×3个不同土壤湿度×3个重复),并做好标记以示区分。分别将3组装有土样的小广口瓶放入温度为15℃、25℃和35℃的3个生化培养箱中培养5周。培养期间,每天采用称重法补充水分,以确保样品在试验设定的3个土壤含水量 (25%、50%和75%)条件下培养。分别在培养7天、14天、21天、28天和35天时取样,测定土壤MBN含量。
1.2.3 指标分析
土壤有机碳含量测定采用浓硫酸-重铬酸钾高温外加热氧化-硫酸亚铁滴定法,微生物量氮含量测定采用氯仿熏蒸浸提法,浸提液为0.5 mol·L-1的K2SO4,然后用凯氏定氮法测定,利用公式:MBN=EN/KEN计算MBN含量。式中:EN为熏蒸与未熏蒸土样所提取的全氮之间的差值;KEN为熏蒸杀死的微生物中的氮被K2SO4提取的比例,取值0.45。
1.2.4 数据处理
采用Origin8.5软件制图,采用SPSS 17.0做数据处理和统计分析,采用单因素方差分析 (ANOVA)和LSD多重比较法进行差异显著性检验,采用Perason相关分析检验土壤MBN含量变化与不同海拔土壤养分和物理性质的相关性。
2 结果与分析
2.1 不同海拔土壤MBN含量
不同海拔土壤MBN含量存在显著差异 (P<0.01),培养前的红壤、黄红壤、黄壤和山地草甸土 MBN 含量分别为 27.51 mg·kg-1、55.53 mg·kg-1、76.01 mg·kg-1和 165.17 mg·kg-1,表现出随海拔升高而逐渐增大的变化规律 (图1)。室内培养35天后,不同温度和水分条件下不同海拔土壤MBN含量均逐渐增高,但增幅不同 (图2),山地草甸土增幅最高为6.23~13.51 mg·kg-1,黄壤次之为 3.04 ~ 7.64 mg·kg-1,之后是黄红壤为 2.09 ~5.11 mg·kg-1,红壤增幅最低为0.63~2.51 mg·kg-1(图2),表明海拔越高,土壤MBN增幅越高。
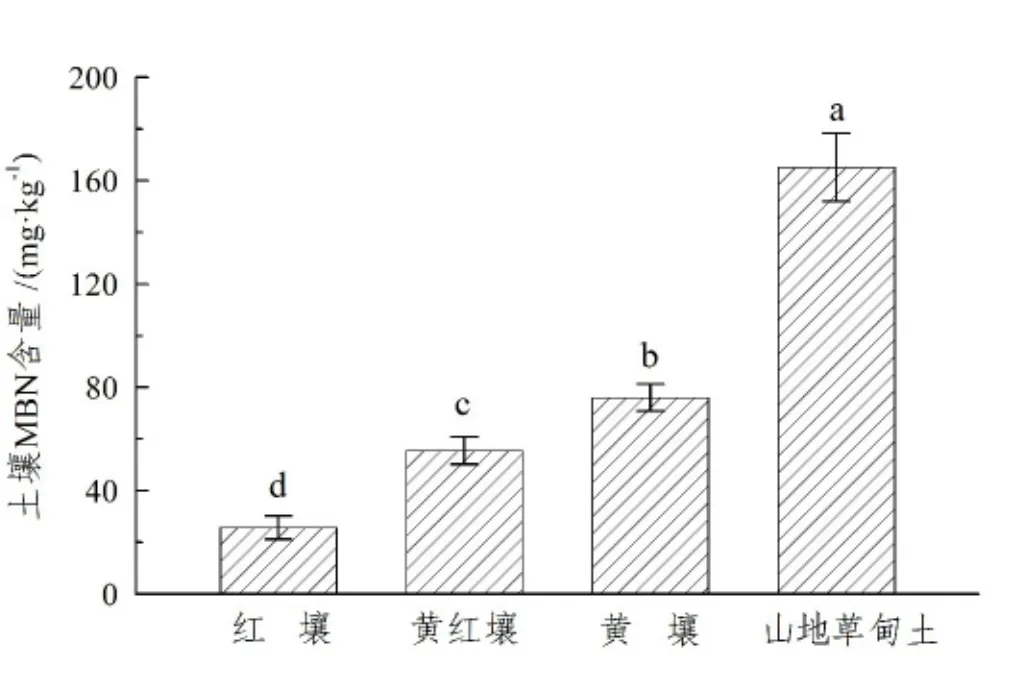
图1 不同海拔土壤MBN含量Figure1 MBN at different elevations
2.2 温度对土壤MBN含量的影响
温度影响土壤MBN含量变化。如图2所示,培养5周后,不同海拔土壤MBN增幅范围在15℃、25℃和35 ℃温度条件下分别为0.63 ~13.51 mg·kg-1、1.39 ~13.36 mg·kg-1、0.88 ~13.25 mg·kg-1,除山地草甸土之外,其他类型土壤MBN含量增幅随温度升高先增加后降低 (P<0.05)。比较3个温度条件下不同海拔土壤MBN含量发现,红壤MBN增量为25℃ >35℃ >15℃,黄红壤在25℃最高、15℃和35℃条件下差异不显著 (P>0.05),黄壤MBN增量为25℃ >15℃ >35℃,山地草甸土的MBN增量在15℃时最高,但未达到显著水平 (P>0.05)。鉴于不同温度条件下土壤MBN含量的波动,间接反映了土壤微生物群落的活性和数量对温度变化的响应策略,如果土壤MBN含量增大,表明温度适宜,提高了土壤微生物活性,反之,则表明温度不适宜,导致土壤微生物活性降低。本研究中,低海拔土壤MBN增量在25℃时最高,随着海拔升高,低温条件下 (15℃)土壤MBN增量逐渐增大,表明,土壤微生物活性的最适温度区间随海拔升高逐渐降低,而温度对土壤MBN含量的影响因不同海拔土壤类型而异 (图2)。

图2 不同温度、湿度条件下培养期内各海拔土壤MBN含量增量Figure2 Changes of MBN at different elevations under different temperature and humidity condition
2.3 湿度对土壤MBN含量的影响
土壤含水量对不同海拔土壤MBN含量均有显著影响,培养周期内,不同湿度条件下土壤MBN含量均逐渐增大 (图2),增幅分别为0.91 ~8.31 mg·kg-1(含水量25%)、1.73 ~13.51 mg·kg-1(含水量50%)和0.63~6.57 mg·kg-1(含水量75%)。差异显著性检验表明 (表2),各个温度培养条件下不同类型土壤MBN增量随含水量变化的规律均为50% >25% >75%(P<0.01)。土壤含水量过高或偏低均可能抑制土壤微生物的活性,含水量适宜时,微生物活性最强,土壤MBN增量最大,表2的结果说明,含水量对本研究区内土壤MBN含量均有显著影响,且不同海拔条件下MBN增量随含水量变化的规律一致。

表2 不同含水量培养条件下各海拔土壤MBN增量的差异显著性 /(mg·kg-1)Table2 The significance of difference of MBN at different elevations
3 讨论
3.1 不同海拔土壤MBN含量及其影响因素
垂直地带性分异规律决定了海拔影响土壤类型及其分布,使得不同海拔土壤的风化程度、有机质含量和养分供应能力存在差异,同时还会调节土壤温度、土壤含水量、地表温度和降雨量以及地表植被分布等环境因子,影响微域小气候类型,进而影响土壤MBN含量的变化。本研究区内,山地草甸土的土壤有机碳、TN和TP等养分含量最高 (表1),这主要是因为由草本植物组成的中山草甸,根系发达且分布较浅,植物生命周期短暂,周转速率快,死亡的植被和根系富集于土壤表层,提供了充足的养分源,为土壤微生物的生存和繁殖提供了有利条件。其他类型土壤的地表植被草本分布密度较低,且乔木层、灌木层植被的根系分布较深,表层土壤的养分源少于山地草甸土,且因海拔较低,土温相对较高促进地表有机质的快速分解而降低养分含量,加之,低海拔地区易受人为干扰,使得表层土的养分含量随海拔增大而逐渐升高。
研究结果中,土壤MBN含量随海拔升高逐渐增大,与土壤养分含量的变化趋势 (山地草甸土>黄壤>黄红壤>红壤)一致 (表1),根据Pearson相关分析结果 (表3),土壤MBN含量与土壤有机碳、土壤TN、TP含量变化呈显著相关 (P<0.05),而与土壤TK、C/N比、土壤容重和pH相关性不显著(P>0.05),与王国兵等[9]在该地区的研究结果一致,说明土壤养分含量 (有机碳、TN、TP等)是MBN空间变异的主要影响因素,而土壤TK、C/N比、土壤容重和pH等非本研究区内MBN随海拔升高而增大的限制性因子。
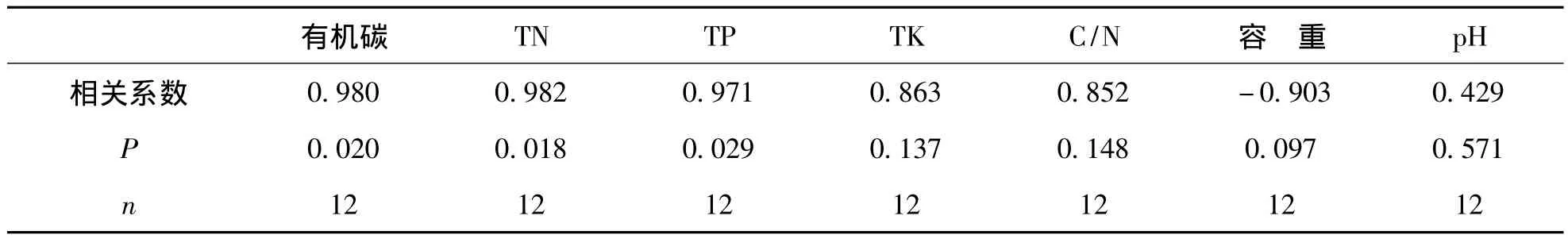
表3 土壤MBN含量变化影响因子Table3 The factors and relationships between them and MBN
3.2 温度对土壤MBN含量的影响
研究结果中,温度对土壤MBN含量的影响,与多数研究结果一致[8,15]。不同类型和数量的微生物对土壤氮素的吸收和利用率存在差异,土壤温度的变化通过影响土壤微生物类型和数量,从而间接影响土壤MBN含量。研究发现,培养期内不同海拔土壤在3个温度条件下土壤MBN含量均逐渐增加,但MBN含量增量却随温度升高先增加后降低,这可能主要与微生物体内酶活性变化有关,通常认为,最适温度区间的酶活性最强,低温或高温条件下均可能受到抑制,据此,在实验设定的3个温度条件(15℃、25℃、35℃)下,土壤温度由低到高逐渐增加时,微生物酶活性可能存在一个先增强后降低的过程,当微生物酶活性增强时,土壤微生物活性增强,数量增大,固氮能力增强,土壤MBN含量增加;当温度继续升高时,酶活性降低,微生物活性受到抑制,固氮能力减弱,土壤MBN含量的增量减少。此外,也可能受土壤N源限制的影响,随温度升高土壤微生物数量逐渐增加,土壤N源供应相对不足而限制土壤微生物数量的扩张,也可能使得MBN含量增量先增加后降低。
培养期内,红壤、黄红壤、黄壤的MBN含量在25℃最高,而山地草甸土在15℃下含量最高,这可能因为土壤温度随海拔升高逐渐降低,海拔最高的山地草甸土的温度相对最低,在长期的自然选择过程中,山地草甸土形成了相对稳定且与低温土壤环境相适应的微生物种群,因而在15℃时,土壤MBN含量最高,而其他类型土壤中的微生物种群更适应温度相对较高的土壤环境,因而土壤MBN最高值出现在25℃。
3.3 水分对土壤MBN含量的影响
已有研究发现水分对土壤MBN含量存在影响[9,16-18],但研究结果存在差异。如Singh[18]等发现在高度风化及淋溶的热带干旱地区,林地及草原土壤的MBN含量在干旱炎热的夏季最高,而雨季较低,并认为导致这种现象的原因是:干旱缺水限制了作物的正常生长,减少了土壤微生物的养分竞争,土壤养分被微生物固持,雨季水分充足,植物生长旺盛,土壤养分被植物吸收,加剧了养分竞争,使得土壤MBN含量降低,这与王国兵等[9]报道的武夷山不同海拔土壤MBN含量季节动态相一致。与之不同,Burke[17]等发现美国中部大平原草地土壤MBN含量并非季节性变化,而是随降水量和土壤粘粒含量增加而增加。本研究发现,培养期内不同海拔土壤MBN含量增量随土壤含水量增加先增大后降低,与已有报道结果存在差异,这可能是因为已有研究是在野外条件下的观测结果,可能受到如降水、植被等多因素交互影响,本研究为室内培养,是排除了干扰的单因素控制实验;此外,观测土壤类型不同、土壤有机质、全氮等养分状况有别以及土壤中微生物种群存在差异等也可能导致MBN含量对土壤水分变化出现不同的响应结果[19-20]。本研究中不同温度条件下,土壤MBN含量均在50%含水量时最高,可能与不同含水量对微生物活性的促进或抑制作用有关。含水量较低时,因水分不足降低微生物活性,MBN含量较低;含水量过高时,土壤气孔导度降低,抑制微生物活性从而亦降低MBN含量。
[1]Acosta-Martínez V,Lascano R,Calderón F,et al.Dryland cropping systems influence the microbial biomass and enzyme activities in a semiarid sandy soil[J].Biology and Fertility of Soils,2011,47(6):655-667.
[2]Friedel J,Munch J,Fischer W.Soil microbial properties and the assessment of available soil organic matter in a haplic luvisol after several years of different cultivation and crop rotation[J].Soil Biology and Biochemistry,1996,28(4):479-488.
[3]Zhao You-yi,Cai Li-qun,Wang Jing,et al.Effects of different conservation tillage on amount and distribution of soil ammonifying bacteria,nitrobacteria and nitrogen-fixing bacteria[J].Acta Prataculturae Sinica,2009,18(4):125-130.[赵有翼,蔡立群,王静,等.不同保护性耕作措施对三种土壤微生物氮素类群数量及其分布的影响 [J].草业学报,2009,18(4):125-130.]
[4]He You-jun,Wang Qing-kui,Wang Si-long,et al.Characteristics of soil microbial biomass carbon and nitrogen and their relationships with soil nutrients in Cunninghamia lanceolata plantations[J].Chinese Journal of Applied Ecology,2006,17(12):2292-2296.[何友军,王清奎,汪思龙,等.杉木人工林土壤微生物生物量碳氮特征及其与土壤养分的关系[J].应用生态学报,2006,17(12):2292-2296.]
[5]Li Ning,Li Hua-xing,Liu Yuan-jin,et al.Relationships between soil microbial ecological characteristics and physical-chemical properties of vegetable garden soil[J].Chinese Journal of Applied Ecology,2006,17(2):285-290.[黎宁,李华兴,刘远金,等.菜园土壤微生物生态特征与土壤理化性质的关系[J].应用生态学报,2006,17(2):285-290.]
[6]Yu Yi-wu,Xu Qiu-fang.Changes in soil microbial biomass by conversion natural masson pine into economic forests[J].Journal of Soil and Water Conservation,2003,17(5):103-105.[俞益武,徐秋芳.天然林改为经济林后土壤微生物量的变化 [J].水土保持学报,2003,17(5):103-105.]
[7]Wang Qing-Kui,Wang Si-long,Yu Xiao-jun,et al.Effects ofCunninghamia lanceolata-broadleaved tree species mixed leaf litters on active soil organic matter[J].Chinese Journal of Applied Ecology,2007,18(6):1203-1207.[王清奎,汪思龙,于小军,等.杉木与阔叶树叶凋落物混合分解对土壤活性有机质的影响 [J].应用生态学报,2007,18(6):1203-1207.]
[8]Devi N B,Yadava P.Seasonal dynamics in soil microbial biomass C,N and P in a mixed-oak forest ecosystem of Manipur,North-east India[J].Applied Soil Ecology,2006,31(3):220-227.
[9]Wang Guo-bing,Wang Feng,Jin Yu-hua,et al.Spatiotemporal variation of soil microbial biomass N under different vegetations along an altitude gradient in Wuyi Mountains of Southeast China[J].Chinese Journal of Ecology,2011,30(4):784-789.[王国兵,王丰,金裕华,等.武夷山不同海拔植被土壤微生物量N时空变异[J].生态学杂志,2011,30(4):784-789.]
[10]Bottner P.Response of microbial biomass to alternate moist and dry conditions in a soil incubated with14C-and15N-labelled plant material[J].Soil Biology and Biochemistry,1985,17(3):329-337.
[11]Patra D,Brookes P,Coleman K,et al.Seasonal changes of soil microbial biomass in an arable and a grassland soil which have been under uniform management for many years[J].Soil Biology and Biochemistry,1990,22(6):739-742.
[12]Kaiser E A,Martens R,Heinemeyer O.Temporal changes in soil microbial biomass carbon in an arable soil.Consequences for soil sampling[J].Plant and Soil,1995,170(2):287-295.
[13]He Zhen-li.Soil microbial biomass and its significance in nutrient cycling and environmental quality assessment[J].Soils,1997,29(2):61-69.[何振立.土壤微生物量及其在养分循环和环境质量评价中的意义 [J].土壤,1997,29(2):61-69.]
[14]Liu Bing-ru.Changes in soil microbial biomass carbon and nitrogen under typical plant communies along an altitudinal gradient in east side of Helan Mountain[J].Ecology and Environmental Sciences,2010,19(4):883-888.[刘秉儒.贺兰山东坡典型植物群落土壤微生物量碳,氮沿海拔梯度的变化特征[J].生态环境学报,2010,19(4):883-888.]
[15]Barbhuiya A,Arunachalam A,Pandey H,et al.Dynamics of soil microbial biomass C,N and P in disturbed and undisturbed stands of a tropical wet-evergreen forest[J].European Journal of Soil Biology,2004,40(3):113-121.
[16]Aponte C,Marañón T,García L V.Microbial C,N and P in soils of Mediterranean oak forests:influence of season,canopy cover and soil depth[J].Biogeochemistry,2010,101(1-3):77-92.
[17]Burke I C,Yonker C,Parton W,et al.Texture,climate,and cultivation effects on soil organic matter content in US grassland soils[J].Soil Science Society of America Journal,1989,53(3):800-805.
[18]Singh J,Raghubanshi A,Singh R,et al.Microbial biomass acts as a source of plant nutrients in dry tropical forest and savanna[J].Nature,1989,338(6215):499-500.
[19]Wang X L,Jia Y,Li X G,et al.Effects of land use on soil total and light fraction organic,and microbial biomass C and N in a semi-arid ecosystem of northwest China[J].Geoderma,2009,153(1):285-290.
[20]Zhou J B,Chen X L,Zhang Y L,et al.Nitrogen released from different plant residues of the Loess Plateau and their additions on contents of microbial biomass carbon,nitrogen in soil[J].Acta Ecologica Sinica,2010,30(3):123-128.
