麻类脱胶高效菌株DCE01的Pel325基因克隆与表达
2015-08-21李琦成莉凤曾洁李国高刘正初
李琦,成莉凤,曾洁,李国高,刘正初,*
(1.湖南农业大学植物保护学院,长沙410128;2.中国农业科学院麻类研究所,长沙410205;3.湖南利尔康生物股份有限公司,湖南岳阳414100;)
草本纤维在进行综合利用前,都必须经过“脱胶”工序以去除“胶质”(主要是果胶、半纤维素和木质素等非纤维素物质)。麻类纺织品是草本纤维工业化应用的代表之一,因其具有抗菌、吸汗、防紫外线等特点深受消费者欢迎。美中不足的是,麻类制品若采用化学脱胶法脱胶,排放的污水不仅会对环境造成很大污染,同时对麻纤维本身也会造成不同程度的损伤。这在素有“中国草”之称的苎麻领域表现尤为突出。生物脱胶方法因可以节约大量的化工原料和能源、减轻脱胶废水、提高纤维品质等优点越来越受到人们的重视[1]。
生物脱胶主要利用脱胶菌分泌的胞外酶系——果胶酶、半纤维素酶等混合酶液降解麻类韧皮纤维中的胶质。生物脱胶主要有加菌法和加酶法两种[2]。加菌法主要依靠高效脱胶菌在生长繁殖过程中分泌果胶酶等胞外酶实现脱胶。果胶等杂质可作为微生物生长繁殖的碳源,而分泌的酶又可以分解果胶,是一个“胶养菌——菌产酶——酶脱胶”的循环过程[3];加酶法则直接向脱胶液中添加果胶酶等商品酶制剂,使酶直接作用于韧皮纤维以实现脱胶。二种方法各有利弊,但都涉及到了麻类脱胶关键基因——果胶酶基因。
实验室筛选到了一株拥有14个果胶酶基因的麻类脱胶高效菌株DCE01。为了深入研究麻类脱胶机理,提高麻类脱胶效率,本文克隆了该菌株的果胶酶基因Pel325,在大肠杆菌E.coli BL21(DE3)中用表达载体pET-28a进行了表达,并对其酶学性质进行了研究。
1 材料与方法
1.1 材料与仪器
菌株DCE01由本实验室分离与保藏;E.coli BL21购自Novagen公司;载体pET-28a购自TransGen公司;聚半乳糖醛酸钠、橘子果胶 (20% -34%esterified)、橘子果胶 (55% -70%esterified)、橘子果胶 (≥85%esterified)购自Sigma公司;UNIQ-10柱式细菌基因组DNA抽提试剂盒、琼脂糖凝胶DNA回收试剂盒、多功能DNA纯化回收试剂盒购自上海生工;其他常规生化试剂均为分析纯,购自国药集团。超声波破碎仪购自美国Branson公司;PCR仪购自BioRad公司;DYY-12型电泳仪购自北京六一仪器厂。
1.2 实验方法
1.2.1 菌种培养
DCE01菌种的活化[4]方法:从保藏斜面挑取菌种一环接种到5 mL改良肉汤培养基,静置于35℃环境活化培养5-8 h;然后,稀释涂布固体改良肉汤培养基,35℃静置培养18-20 h,分离单菌落;挑选生长旺盛的单菌落接种于5 mL LB培养基,35℃,180 r/min培养15-18 h后待用。
1.2.2 基因组DNA的提取
参照UNIQ-10柱式细菌基因组DNA抽提试剂盒说明书进行。
1.2.3 Pel325基因的克隆
采用软件Primer premier 5设计引物。上游引物带BamH I酶切位点,下游引物带Hand III酶切位点。引物如下:
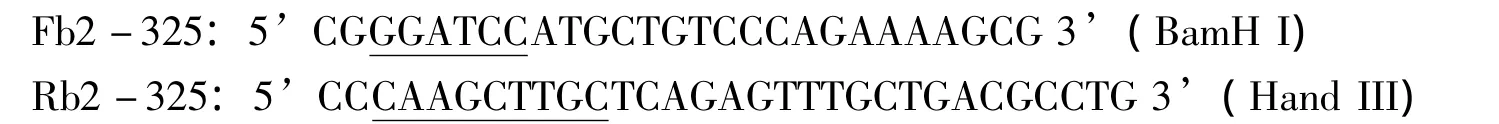
以基因组DNA为模板,设置扩增参数为:95℃预变性4.0 min,94℃变性30 s、55℃退火30 s、72℃延伸1.0 min,共30个循环,72℃保温10 min。
1.2.4 重组质粒的酶切
将经过验证的克隆载体重组质粒进行大体积酶切。酶切反应体系:10×PCR Buffer5.0 μL;重组质粒DNA 10.0 μL;酶 (BamH I、Hand III)各5.0 μL;用无菌去离子水补足到50 μL,37℃酶切30 min,用0.7%琼脂糖凝胶电泳检测酶切产物。
1.2.5 Pel325基因的转化
加连接产物于100 μL E.coli BL21(DE3)刚刚解冻的感受态细胞中,轻弹混匀,冰浴30 min。42℃热击90s,立刻至于冰上,冰浴10 min。加入800 μL平衡至室温的LB培养基,120 r/min,37℃孵育2.0 h。取200 μL菌液涂布含有100 μg/mL的Amp的LB平板,37°C培养过夜。
1.2.6 Pel325基因的诱导表达及粗酶液的制备
挑取阳性基因工程菌接种一环到5.0 mL含有100μg/mL Amp的LB培养液,振荡培养15-18 h后,接种 (接种量2%)到100 mL的LB培养液,37℃、220 r/min振荡培养。当OD600到达0.6后,添加IPTG至终浓度1.0 mmol/L进行诱导,诱导条件为30℃,200 r/min。在第8h、21 h分别取样并检测。
1.2.7 蛋白质SDS-PAGE电泳
5%浓缩胶,12%的分离胶,浓缩胶和分离胶分别采用10 mA、25 mA稳流电泳。
1.2.8 Pel325基因果胶酶活力测定[5]
底物采用pH 9.0的甘氨酸-氢氧化钠缓冲液配置。取2.0 mL底物预热至50℃,然后添加1.0 mL适当稀释的酶液,50℃准确反应5 min,立即加入2.0 mL DNS,沸水浴中显色5.0 min后,冰水浴迅速冷却,加蒸馏水定容至15 mL。以煮沸灭活的相同酶液做阴性对照,测定样品的OD520。
上述条件下,底物每分钟释放出相当于1.0 μmol半乳糖醛酸的还原糖所需的酶量为1个酶活力单位,以“U/mL”表示。
1.2.9 果胶酶酶学性质分析
在pH 9.0条件下,分别测定胞内酶与胞外酶的温度特征曲线,以确定其最适温度;在温度50℃条件下,分别测定胞内酶pH7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0时的酶活。
2 结果与分析
2.1 Pel325基因克隆
用0.7%的琼脂糖凝胶电泳检测麻类脱胶Pel325基因的克隆情况,电泳条带清晰显示,大小约为1000bp左右,这与测序结果相符,测序结果显示该基因含有963个碱基,编码320个氨基酸。
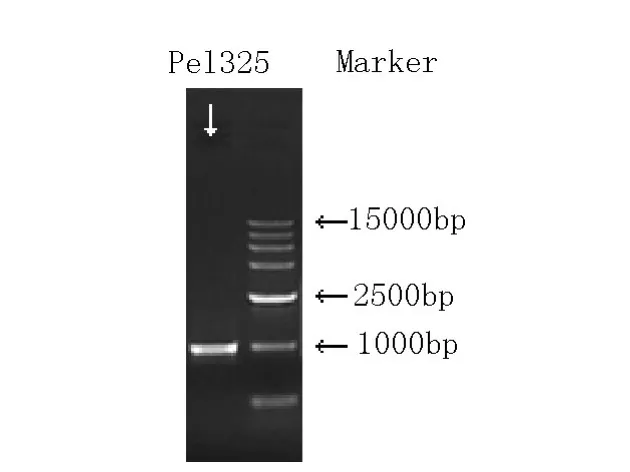
图1 Pel325基因PCR扩增Fig.1 PCR amplification of gene Pel325
2.2 质粒转化与酶切
质粒酶切及质粒PCR的0.7%琼脂糖凝胶电泳图显示,在1000bp左右,均有较为明显的条带,说明目标基因已经成功转化。
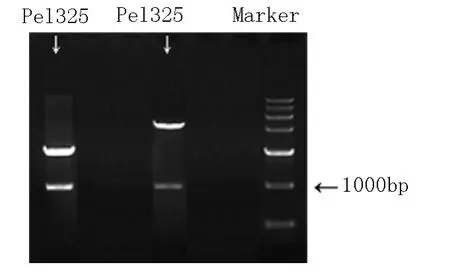
图2 质粒PCR鉴定与扩增检测Fig.2 Detection of recombinants by PCR
2.3 蛋白质SDS-PAGE电泳
未经诱导的重组菌株在39kDa附近没有条带,经IPTG诱导8h后,出现了较为明显的条带,说明蛋白表达成功。
图3 生物脱胶酶SDS-Page电泳Fig.3 SDS-PAGE of recombinant enzyme of biologic degumming
2.4 果胶酶的酶学性质
随着温度的升高,酶活也开始升高,但是,当温度超过55℃时,酶活急剧下降,65℃时酶的活性不到55℃的四分之一。在pH8.0时,酶活达到最大值,之后开始缓慢下降,至pH11时,几乎没有酶活,说明该酶在碱性条件下可以使用,但是,最佳使用条件应是弱碱性环境。当分别采用聚半乳糖醛酸钠 (底物1)、橘子果胶 (20% -34%酯化度,底物2)、橘子果胶 (55% -70%酯化度,底物3)、橘子果胶 (酯化度≥85%,底物4)为底物检测酶活时,发现果胶酶酶活随着酯化度的增加而升高。
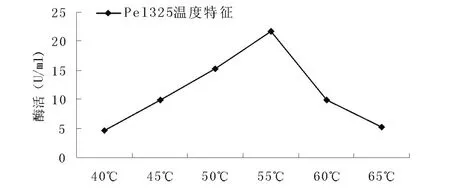
图4 温度对重组酶活力的影响Fig.4 Effect of temperature on the activity of recombinant enzyme
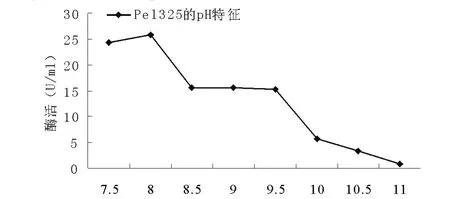
图5 pH对重组酶的影响Fig.5 Effect of pH on the activity of recombinant enzyme
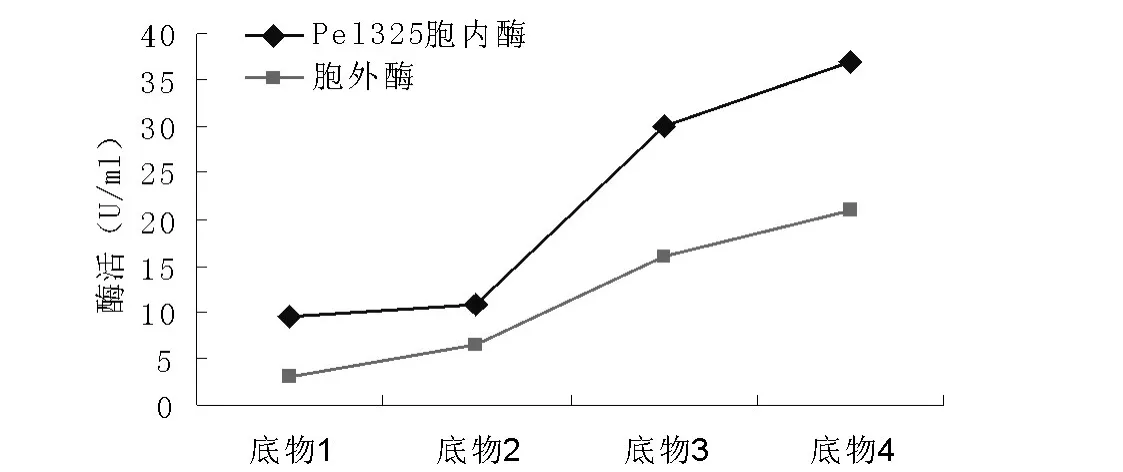
图6 不同底物对酶活力的影响Fig.6 Effect of substrates on the activity of recombinant enzyme
3 讨论
果胶酶Pel325在碱性条件下有较高的活力,但是,当pH超过10时,酶活呈下降趋势。该酶在pH7.5-8.5的酶活较pH9.5时高,这与同菌株分泌表达的另一种基因PelG403有显著的不同,后者在pH8.5时的酶活不及pH9.5时的五分之一[6]。可能正是因为能够分泌多种不同特性的麻类脱胶生物酶,进而能够快速适应复杂的环境与不同的果胶底物,所以才导致了菌株DCE01拥有高效脱胶的能力。氨基酸序列分析发现,Pel325含有2个典型的结构域 (Superfamily2.60.40.10和2.160.20.10),而PelG403仅含有1个 (Superfamily2.160.20.10),这可能也是导致两者最佳催化条件有所不同的重要原因之一。
通过序列比对分析发现,Pel325基因与来自Dickeyadadantii3937的pelI基因[7]较为相似,但是仍然存在差异。在核酸序列上,Pel325与pelI有53个碱基存在差异,而在氨基酸序列上,有9处存在差异。
重组菌株经IPTG诱导后,既有胞内酶活性,也有胞外酶活性,总的来说,胞内酶活性较胞外酶活性大。随着底物 (橘子果胶)酯化程度的增加,酶的活性越来越大。这说明,该酶可以催化不同酯化程度的果胶,尤其适合催化高酯化度的果胶。
随着国家对环保力度的加强,草本纤维资源的清洁开发与综合利用已引起了人们的高度重视[8]。生物脱胶取代传统的化学脱胶是大势所趋。麻类脱胶高效菌株DCE01的基因Pel325在碱性 (pH9.5)条件下有很好的催化效果,在弱碱性 (pH7.5)条件下的酶活更高,有利于进一步减少脱胶工艺碱的消耗,进一步降低工业污染。通过高密度发酵、基因定点突变等手段,有望进一步提升脱胶酶的耐温性、耐酸碱性及发酵活性,以适应工业化应用的需要。
[1]刘正初,张运雄,冯湘沅,等.清洁型草本纤维生物提取工艺的污染机理研究[J].中国农业科学,2008,41(2):546-551.
[2]蒋建雄.麻类作物微生物工程研究进展 [J].作物研究,1999,13(1):45-47.
[3]李宗道.麻类生物工程进展[M].北京:中国农业出版社,1999:331-338.
[4]成莉凤.DCE-01菌株果胶酶基因克隆与表达及其多样性研究[D].北京:中国农业科学院博士学位论文,2013.
[5]成莉凤,李琦,刘正初,段盛文,等.DCE-01菌株果胶酯酶基因克隆与表达 [J].食品工业科技,2013(15):162-165.
[6]成莉凤,刘正初,段盛文,等.一种果胶裂解酶基因 (pel)表达体系构建及其表达产物的酶学性质[J].农业生物技术学报,2013(05):546-553.
[7]GlasnerJD,YangCH,ReverchonS, etal.Genomesequenceoftheplant - pathogenicbacteriumDickeyadadantii3937 [J].JournalofBacteriology.2011,193(8):2076–2077.
[8]刘正初.用科学发展观看我国草本纤维产业前景[J].中国麻业科学,2007,29(增刊):68-71.
