贵州本地山羊STAT5A基因第10外显子SNP研究
2015-08-20谢海强孙岩岩盘道兴钱成康建兵胡
谢海强 孙岩岩 盘道兴 钱成 康建兵 胡玲玲 龚俞 焦仁刚 刘若余

摘要:利用黔北麻羊、贵州黑山羊和贵州白山羊构建DNA池,设计1对引物扩增其STAT5A基因第10外显子及部分内含子序列。PCR产物纯化后进行双向测序。DNAStar和BLAST分析确定多态性位点。利用生物信息学软件分析SNPs位点对STAT5A基因RNA二级结构、STAT5A蛋白二级及三级结构的影响。结果表明:在扩增的STAT5A基因中筛选到3个SNPs:C-32A、G+71A和G+158A,其中G+71A为错义突变,导致编码的丙氨酸(Ala)变为苏氨酸(Thr);C-32A和G+158A均在内含子区,不参与氨基酸编码。SNPs位点对STAT5A基因RNA二级结构和STAT5A蛋白结构均有一定影响。
关键词:STAT5A基因;SNPs;外显子;贵州本地山羊
中图分类号: S827.2 文献标志码: A 文章编号:1002-1302(2015)07-0030-03
收稿日期:2014-07-24
基金项目:贵州省重大科技专项计划(编号:黔科合重大专项字[2011]6009号);黔西南州种草养羊产业发展省州科技合作专项(编号:黔西南科合字[2011]5-3号);贵州大学研究生创新基金(编号:研农2014012)。
作者简介:谢海强(1989— ),男,江苏常州人,硕士研究生,研究方向为分子遗传与动物育种。E-mail:xiehaiqiang1115@163.com。
通信作者:刘若余,博士,教授,主要从事分子遗传与动物育种研究。E-mail:liury04@163.com。
STAT5是信号转导和转录激活子蛋白(signal transduction and activator of transcription,STAT)家族中的重要成员之一,它包括STAT5A和STAT5B这2个亚型,其STAT同源性家族成员共有7个,分别为STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B及STAT6[1]。 在众多家族成员中,STAT5肩负着众多功能,它不仅参与细胞增殖、分化与凋亡的过程,调控细胞周期,还对生物体生长和免疫应答起重要调控作用。STAT5能够实现如此多功能,主要是通过其信号传导机制来完成,主要有JAK2-STAT5[2]、JAK3-STAT5[3]、STAT5-Foxp3[4]等信号通路 。
STAT5A和STAT5B在结构与功能相近,序列具有很高的同源性,它们都拥有高度保守的N端结构域,促进蛋白间相互作用的蜷曲螺旋结构域,能与DNA直接结合的DNA结合结构域,还都具有最具保守性的SH2结构域[5]。但2者在C端的转录激活结构域略有不同,具体表现为STAT5A和STAT5B在C端分别拥有20个和8个独特氨基酸序列[6]。STAT5的2个亚型蛋白不仅在结构上同源性极高,而且在功能上有许多相同点。STAT5A和STAT5B同时扮演着信号分子和转录因子的角色,它们能被生长激素(growth hormone,GH)、干扰素(interferon,IFN)、催乳素(prolactin)、表皮生长因子(epidermal growth factor,EGF)及白细胞介素(interleukin,IL)等多种因子激活,进而调控相应基因的表达。
STAT5A最早作为调控乳蛋白的一个乳腺因子(mammary gland factor,MGF)而被发现,在随后的研究中,发现STAT5A不仅对调控乳腺正常发育具有重要作用,还在肝细胞活性水平、免疫系统以及肿瘤调控机制[7-9]等方面都有十分重要作用。近年来,还发现STAT5A与生物生长性能有着密切联系。如Yu等在小鼠上证明了STAT5A和STAT5B通过激活 Cdkn2b 和Cdkn1a表达来负调控细胞增殖[10];方琼等在研究家猪STAT5时同样发现其介导生长激素进而影响生长性状[11];此外,在研究崂山奶羊时,刘园峰等发现STAT5A第9内含子上存在2个连锁突变位点,这2个突变位点显著影响着崂山奶羊的体质量、体长和胸围等生长性状[12]。
贵州本地山羊具有繁殖力强、屠宰率高、耐粗饲、易管理等特点,且其肉质鲜美、营养丰富,深受消费者喜爱[13]。但贵州本地山羊存在生长速度慢、个体生产性能参差不齐等问题,导致养羊效益不佳,因此提高其生长性能是解决上述问题的关键。与传统繁殖饲养方面提高山羊生长性能相比,从分子水平研究效果更明显、周期更短、回报率更高。但能用于育种的有用基因或标记仍然十分紧缺,而STAT5A则是十分理想的提高家畜生长性能的候选基因。
本试验利用黔北麻羊、贵州黑山羊和贵州白山羊进行DNA池构建[14],进行STAT5A基因多态性位点(single nucleotide polymorphism,SNP)筛选。测序结果由DNAStar软件进行序列拼接、校正,BLAST分析其SNP,并估算等位基因频率,生物信息学软件研究多态性位点对STAT5A基因RNA二级结构及蛋白质二级、三级结构影响。
1 材料与方法
1.1 试验动物
试验材料为贵州本地的黔北麻羊、贵州白山羊和贵州黑山羊。其中贵州省遵义市习水县富兴牧业种羊场黔北麻羊103只,贵州省毕节市纳雍县鹏腾生态农牧综合开发有限公司贵州黑山羊103只,贵州省铜仁市沿河县贵州白山羊种羊场贵州白山羊146只。
1.2 试验试剂
生工生物工程(上海)股份有限公司的Ezup柱式基因组DNA抽提试剂盒(血液),琼脂糖凝胶,1×TBE缓冲液。
1.3 DNA提取与DNA池构建
抽取黔北麻羊血样103个,贵州黑山羊血样103个,贵州白山羊血样146个。用生工生物工程(上海)股份有限公司Ezup柱式基因组DNA抽提试剂盒(血液)提取DNA,1%琼脂糖凝胶电泳检测DNA提取效果,紫外分光光度计测定DNA样品浓度。贵州黑山羊及贵州白山羊DNA样品分别调整相同浓度至100 ng/μL,各取3 μL混合构建DNA池。
1.4 引物设计和DNA扩增
从NCBI数据库中得到绵羊STAT5A基因DNA序列(GenBank登录号:NC_019468.1),利用NCBI在线软件Primer-BLAST设计1对特异性引物。其上游引物序列(5′→3′)为TTTGCTCGGATGCTCTCAGG,下游引物序列(5′→3′)为AGCAAATAAGCACCAGCAGA,目标基因片段(包含STAT5A基因第10外显子编码区序列及部分3′UTR序列)长度 630 bp,最适退火温度58.3 ℃。PCR反应体系为20 μL:2×Taq PCR Master Mix试剂10 μL,基因组DNA 2 μL,上、下游引物(浓度为10 pmol/μL)各1.5 μL,ddH2O 5 μL。采用 TC-512 PCR仪进行DNA扩增,PCR扩增条件:94 ℃预变性 5 min;95 ℃变性30 s;58.3 ℃退火30 s;72 ℃延伸30 s,35个循环后 72 ℃ 延伸10 min。1%琼脂糖凝胶电泳检测PCR产物,凝胶成像仪观察电泳结果。
1.5 序列分析
PCR产物委托北京诺萨基因组研究中心有限公司纯化后进行双向测序,3次独立测序。采用DNAstar软件对测序结果进行校正,BLAST分析确定SNPs。
1.6 测序图峰高测量及等位基因频率估算
利用软件Chromas.exe查看测序结果,并利用MWSnap测量各SNP位点等位基因的相应峰高。SNP常表示二等位多态性,可通过以下公式估算等位基因频率[15]。
fi=hi/(hⅠ+hⅡ),i=Ⅰ,Ⅱ。
式中:fi表示SNP位点某等位基因频率,hⅠ和hⅡ分别表示测序图上该SNP等位基因Ⅰ、Ⅱ峰高度。
1.7 STAT5A的RNA二级结构预测及蛋白结构分析
将STAT5A基因突变前后不同DNA序列进行RNA二级结构变化分析,并将STAT5A基因突变前后不同蛋白氨基酸序列进行蛋白质二级结构和三级结构变化分析。phyre2构建蛋白质三维结构,将STAT5A与蛋白结构数据库中蛋白质三维结构进行匹配,得到模拟的STAT5A蛋白三维结构。RNA二级结构在线分析软件:http://www.genebee.msu.su/services/rna2_reduced.html。蛋白质二级结构在线分析软件:http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_server.html。蛋白质三级结构在线分析软件:http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index。
2 结果与分析
2.1 DNA池的PCR产物测序
设计1对特异性引物扩增出贵州本地3种山羊STAT5A基因目的序列共630 bp,见图1。扩增产物经胶回收纯化后进行双向测序,测序结果与绵羊STAT5A基因DNA序列(GenBank登录号:NC_019468.1)DNA序列基本吻合,可以确定为山羊STAT5A基因序列。BLAST分析共发现3个SNPs,以STAT5A基因第10外显子第1位碱基计数为1,SNPs位点分别为C-32A、G+71A和G+158A,均为新发现位点,详见图2。这些SNPs可能在不同山羊中普遍存在,需要扩大山羊个体数进一步验证。突变位点是否造成其生长性能差异也需后续试验进一步研究。
2.2 SNPs等位基因频率估算
利用MWSnap软件分别测量3种山羊各SNPs等位基因峰高,并估算SNPs等位基因频率,结果见表1。由表1可看出,不同品种山羊同一突变位点突变频率近似,不同突变位点突变频率相差较大。
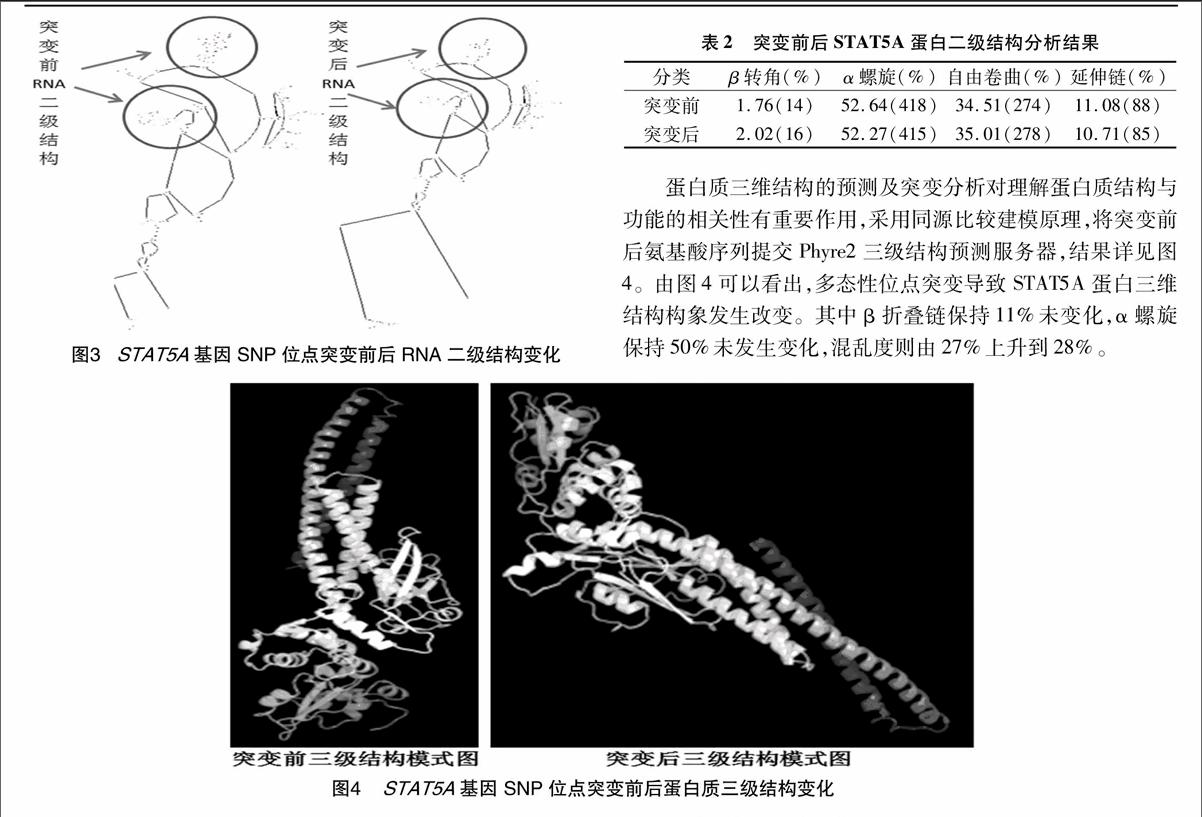
2.3 STAT5A的RNA二级结构分析
突变前后STAT5A基因RNA二级结构预测结果表明,SNP位点突变导致RNA二级结构显著改变,详见图3。该突变导致RNA二级结构最小自由能发生改变,由-914.4 kJ/mol变为-937.7 kJ/mol,影响RNA二级结构稳定性,可能影响后续蛋白质翻译过程。
2.4 突变前后STAT5A蛋白二级、三级结构分析
利用在线SOPMA服务器预测黔北麻羊、贵州黑山羊和贵州白山羊STAT5A基因突变前后蛋白质二级结构变化。结果显示,突变前后,β转角由1.76%增至2.02%,α螺旋由52.64%减少到52.27%,自由卷曲由34.51%上升到3501%,延伸链由11.08%下降为10.71%(表2)。
蛋白质三维结构的预测及突变分析对理解蛋白质结构与功能的相关性有重要作用,采用同源比较建模原理,将突变前后氨基酸序列提交Phyre2三级结构预测服务器,结果详见图4。由图4可以看出,多态性位点突变导致STAT5A蛋白三维结构构象发生改变。其中β折叠链保持11%未变化,α螺旋保持50%未发生变化,混乱度则由27%上升到28%。
3 讨论
STAT5A作为STAT家族中重要成员,具有多种生物学功能。STAT5A能够显著影响生物体乳腺发育功能、肝功能、妊娠反应、免疫系统及肿瘤发生机制[16],STAT5A与STAT5B共同影响了细胞增殖、生长、分化、凋亡,以及细胞周期的调控[17]。提高肉质性能与生长性能一直是畜牧业品种选育的最终目标,在家猪、小鼠、奶牛和崂山奶羊上的研究都表明,STAT5A拥有影响动物生长性能的能力[18-19]。因此,对STAT5A的深入研究有望改善贵州本地山羊个体生长性能较差的现状,同时对加快品种选育有着十分重要的现实意义。
本试验首次在贵州本地山羊STAT5A基因中鉴定得到SNP位点。其中G+71A突变,将丙氨酸(Ala)错义编码为苏氨酸(Thr);C-32A和G+158A均在内含子区,不参与氨基酸编码。比较3个多态性位点等位基因频率,发现不同山羊品种同一突变位点突变频率近似,不同突变位点突变频率相差较大,这一发现是否在其他山羊中也有不同,需要进一步扩大山羊的品种及数量进行研究。突变前后STAT5A基因RNA二级结构发生改变,并影响到蛋白质二级、三级结构。为深入探究STAT5A基因对山羊生长性能的调控作用,有必要扩大山羊数量,并分析上述多态性位点与山羊各项生长指标关联性,从而为山羊的选育工作以及整个STAT家族在山羊中的调控研究奠定基础。
参考文献:
[1]张诗赟,徐亚明,宋一超,等. Stat5: 多功能的转录因子[J]. 生命的化学,2012,32(2): 180-184.
[2]Nevalainen M T,Gu L,Liao Z,et al. Pharmacological inhibition of JAK2-STAT5 signaling by JAK2 inhibitor AZD1480 potently suppresses growth of both primary and castrate-resistant prostate cancer[J]. Clinical Cancer Research,2013,19(20): 5658-5674.
[3]Elisabetta C,Margherita G,Vito M,et al. JAK3/STAT5/6 pathway alterations are associated with immune deviation in CD8+ T cells in renal cell carcinoma patients [J]. Journal of Biomedicine and Biotechnology,2010,2010:935764
[4]李海燕,裴 建,刘志丹,等. 针灸对荷瘤小鼠脾淋巴细胞增殖及Stat5-Foxp3通路影响[J]. 上海针灸杂志,2010(3): 62-66.
[5]Song L,Schindler C. JAK-STAT signaling [M]//Bradshaw P A,Dennis E D. Regulation of organelle and cell compartment signaling:cell signaling collection. New York:Academic Press,2011:99-106.
[6]Krmer O H,Moriggl R. Acetylation and sumoylation control STAT5 activation antagonistically[J]. JAK-STAT,2012,1(3):203-207.
[7]Vafaizadeh V,Klemmt P,Brendel C,et al. Mammary epithelial reconstitution with gene-modified stem cells assigns roles to STAT5 in luminal alveolar cell fate decisions,differentiation,involution,and mammary tumor formation[J]. Stem Cells,2010,28(5): 928-938.
[8]Liang Q C,Xiong H,Zhao Z W,et al. Inhibition of transcription factor STAT5b suppresses proliferation,induces G1 cell cycle arrest and reduces tumor cell invasion in human glioblastoma multiforme cells[J]. Cancer Letters,2009,273(1): 164-171.
[9]Xiong H,Su W Y,Liang Q C,et al. Inhibition of STAT5 induces G1 cell cycle arrest and reduces tumor cell invasion in human colorectal cancer cells [J]. Laboratory Investigation,2009,89(6): 717-725.
[10]Yu J H,Zhu B M,Wickre M,et al. The transcription factors STAT5A and STAT5B negatively regulate cell proliferation through the activation of Cdkn2b and Cdkn1a expression[J]. Hepatology,2010,52(5):1808-1818.
[11]方 琼,李 娟,吕学斌,等. 家猪信号转导及转录激活因子基因3、5a及5b的克隆、剪切变体鉴定及组织表达图谱分析 [J]. 四川大学学报,自然科学版,2012,49(4):879-886.
[12]刘园峰,王桂芝,李秋梅,等. 崂山奶山羊LEP和STAT5a基因对泌乳和生长性状的影响[J]. 中国农业科学,2013,46(18):3946-3954.
[13]宋章会. 贵州山羊生产现状调查与发展对策[J]. 贵州畜牧兽医,2007(5):15-16.
[14]Sham P,Bader J S,Craig I,et al. DNA pooling: a tool for large-scale association studies [J]. Nature Reviews Genetics,2002,3(11): 862-871.
[15]Suliman H B,Carraway M S,Piantadosi C A. Postlipopolysaccharide oxidative damage of mitochondrial DNA [J]. American Journal of Respiratory and Critical Care Medicine,2003,167(4):570-579.
[16]陈焕珍,王 晓,李凤英,等. JAK2/STAT5 通路在胰岛对妊娠适应中的作用[J]. 上海交通大学学报,2012,32(5):555-559.
[17]Shain K H,Yarde D N,Meads M B,et al. β1 Integrin adhesion enhances IL-6-mediated STAT3 signaling in myeloma cells:implications for microenvironment influence on tumor survival and proliferation[J]. Cancer Research,2009,69(3): 1009-1015.
[18]褚 敏,阎 萍,裴 杰,等. STATs 家族基因多态性在奶牛育种中的研究进展[J]. 黑龙江畜牧兽医,2011(2): 25-26.
[19]Huang Y L,Zhao F,Luo C C,et al. SOCS3-Mediated blockade reveals major contribution of JAK2/STAT5 signaling pathway to lactation and proliferation of dairy cow mammary epithelial cells in vitro[J]. Molecules,2013,18(10): 12987-13002.
