胃肠间质瘤c-kit、血小板源性生长因子受体A基因外显子突变谱与临床病理学特征分析
2021-08-07符德元
石 磊, 陈 平, 王 昊, 赵 伟, 符德元
(江苏省苏北人民医院/扬州大学临床医学院, 1. 胃肠外科, 2. 甲乳外科, 江苏 扬州, 225001)
胃肠间质瘤(GIST)是胃肠道最常见的间叶源性肿瘤,显示Cajal间质细胞分化,大多数患者具有c-kit或血小板源性生长因子受体A(PDGFRA)功能获得性突变[1]。《中国胃肠间质瘤诊断治疗共识(2017年版)》[2]推荐疑难病例、拟行靶向治疗(包括术前治疗、辅助治疗和晚期GIST靶向治疗)、野生型、继发耐药GIST患者行常规基因检测。基因检测对评估GIST患者预后以及分子靶向治疗反应性均有指导意义。本研究分析GIST中c-kit、PDGFRA基因的突变类型及特点,探讨其与GIST临床病理学特征的关系,旨在为GIST患者的全程化管理提供参考。
1 资料与方法
1.1 一般资料
收集江苏省苏北人民医院2013年1月—2020年12月收治的288例经临床诊断、病理检查确诊为GIST且具有完整临床病理学资料、基因突变信息的患者信息。临床病理学资料包括性别、年龄、肿瘤原发部位、肿瘤最大径、核分裂象计数、改良美国国立卫生研究院(NIH)危险分级和CD117、CD34和DOG-1表达情况等。基因突变信息包括c-kit基因外显子9、外显子11、外显子13、外显子17和PDGFRA基因外显子12、外显子18的突变情况。
1.2 Sanger基因测序
选择合适的肿瘤组织石蜡包埋切片5张,勾选肿瘤细胞比例在60%以上的肿瘤组织区域并行刮取、富集肿瘤细胞,苏木精-伊红(HE)染色结果见图1。提取DNA,测定DNA浓度和纯度,进行聚合酶链式反应扩增。采用双向Sanger测序检测c-kit基因外显子9、外显子11、外显子13、外显子17及PDGFRA基因外显子12、外显子18突变,测序引物见表1。对于DNA碎片严重的标本,可针对性地设计短片段引物测序。最后应用Chromas软件进行测序结果解读。
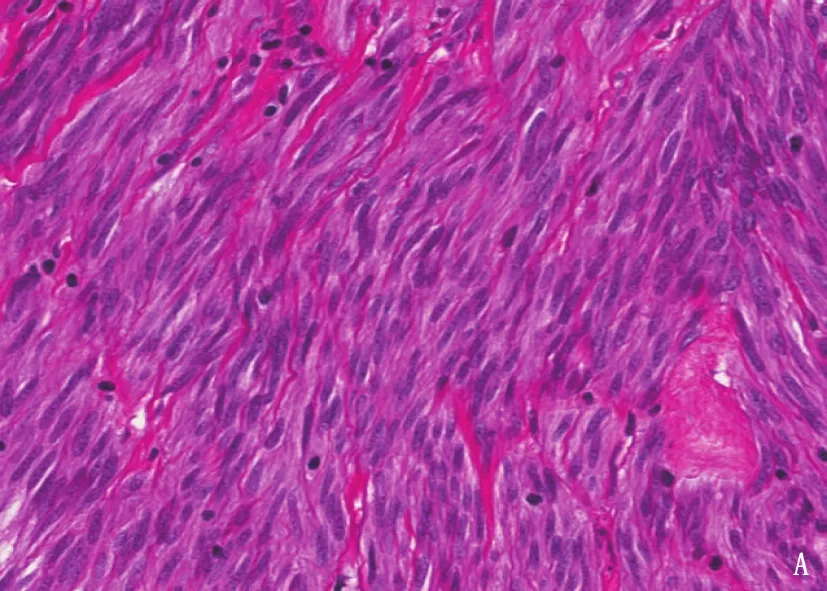
A: 梭形细胞型GIST;

B: 上皮细胞型GIST。

表1 c-kit和PDGFRA外显子的PCR引物
1.3 统计学分析

2 结 果
2.1 临床病理学特征
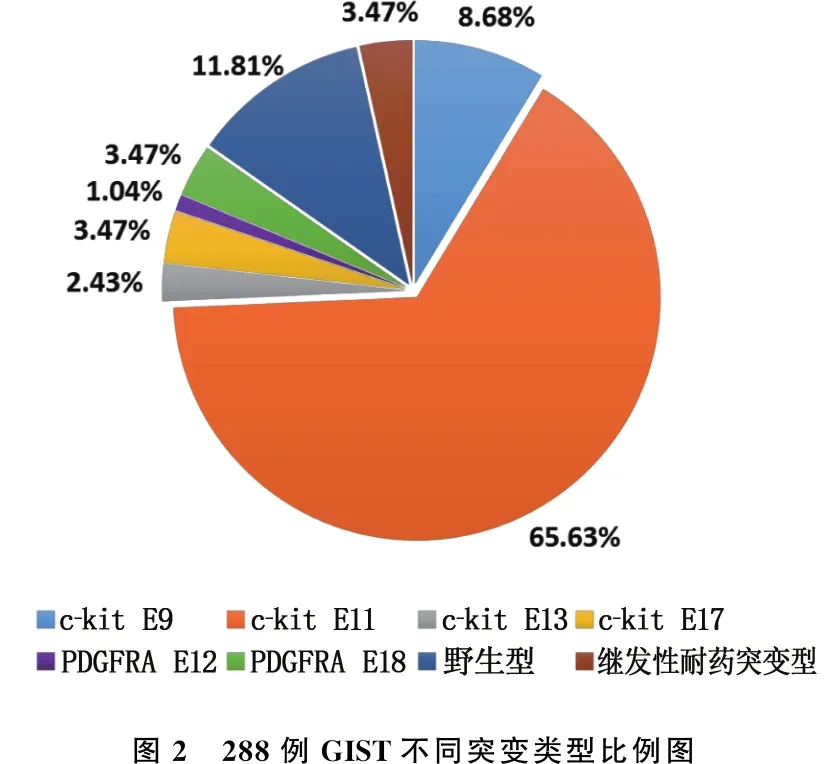
288例GIST患者中,原发性突变型GIST(MUT-GIST)244例(84.72%), 继发性耐药MUT-GIST 10例(3.47%), 野生型GIST(WT-GIST)34例(11.81%)。244例原发性MUT-GIST中, c-kit基因突变231例(外显子9、11、13、17突变分别为25、189、7、10例), PDGFRA基因突变13例(外显子12、18突变分别为3、10例)。见图2。剔除继发性耐药MUT-GIST和WT-GIST, 对244例原发性MUT-GIST进一步分析。
244例原发性MUT-GIST患者中,男144例,女100例,年龄30~85岁,平均(59.14±9.66)岁,肿瘤最大径1~26 cm, 平均(7.73±4.06) cm。肿瘤最常见的部位是胃,其次是小肠、直肠、十二指肠和结肠,其余19例患者的肿瘤位于胃肠外部位或不能明确原发灶(包括腹膜后、肠系膜和网膜)。见表2。

表2 244例原发性MUT-GIST患者临床病理学特征
2.2 基因突变分析结果
2.2.1 原发性MUT-GIST基因突变分析结果: 244例原发性MUT-GIST外显子突变比例、突变类型见图3、图4。244例原发性MUT-GIST外显子突变类型比较,差异有统计学意义(χ2=262.629,P<0.05), 见表3。

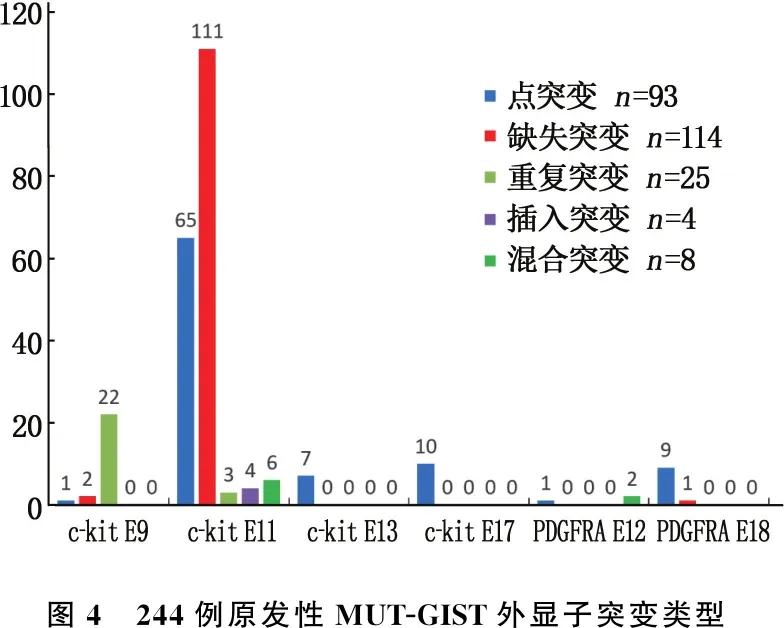

表3 244例原发性MUT-GIST外显子突变类型比较
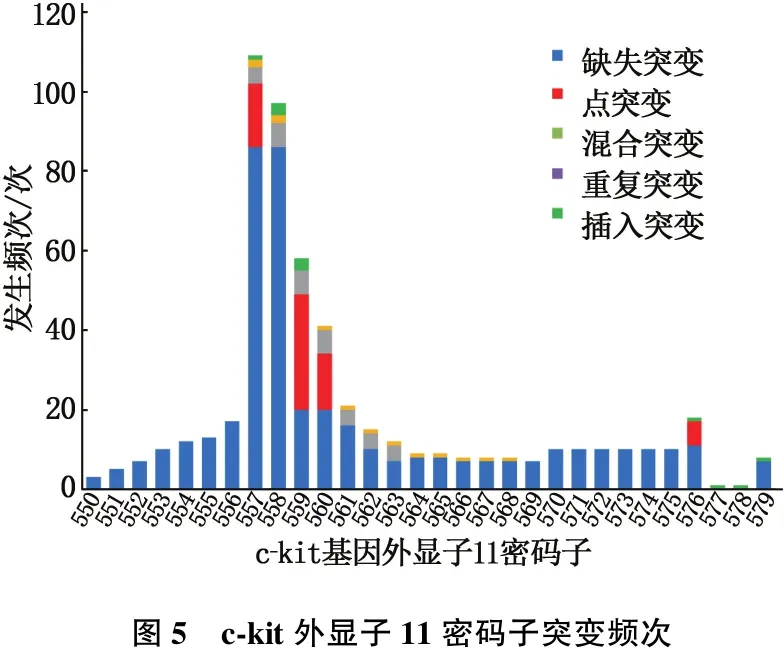
25例c-kit基因外显子9 MUT-GIST中, A502-Y503重复突变22例(88.00%)、F506L点突变1例(4.00%)、C452-S453缺失突变2例(8.00%)。189例c-kit外显子11 MUT-GIST突变类型复杂多样,包括缺失突变111例(58.73%)、点突变65例(34.39%)、重复突变3例(1.59%)、插入突变4例(2.12%)和混合突变6例(3.17%)。缺失突变和点突变是c-kit外显子11最常见的突变类型,大多数c-kit外显子11突变表现为del W557-K558缺失突变(60例,占31.75%)。外显子11突变涉及550~579位密码子,累积突变频次557次,热点区域集中在557~560位密码子,占54.76%(305/557),见表4、图5。7例c-kit外显子13 MUT-GIST均为K642E点突变。10例c-kit外显子17 MUT-GIST均为点突变,其中D816E点突变1例(10.00%)、D816V点突变1例(10.00%)、N822K点突变8例(80.00%)。3例PDGFRA外显子12 MUT-GIST中,V561D点突变1例(33.33%)、S566R,567-571缺失混合突变1例(33.33%)、S566Q,567-571缺失混合突变1例(33.33%)。10例PDGFRA外显子18 MUT-GIST中,Del I843-D846缺失突变1例(10.00%)、V824V点突变2例(20.00%), Y849C点突变2例(20.00%)、D842V点突变5例(50.00%)。
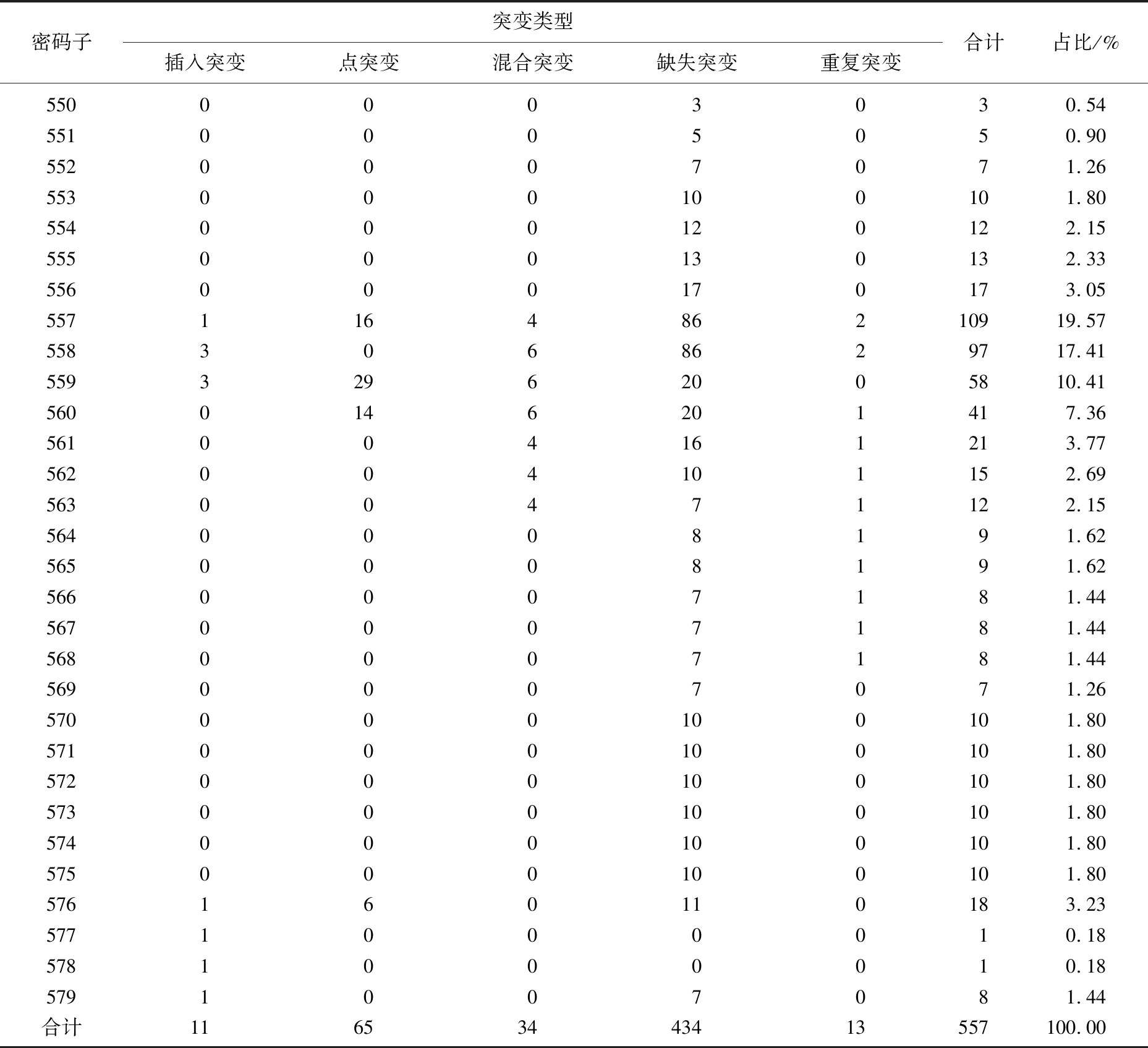
表4 c-kit外显子11密码子突变频次
2.2.2 继发性耐药MUT-GIST基因突变分析结果: 10例继发性耐药MUT-GIST均为术后复发、转移病例,患者均接受甲伊马替尼分子靶向治疗。9例原发性突变为c-kit外显子11突变(90.00%),1例原发性突变为c-kit外显子9突变(10.00%); 继发性c-kit外显子13突变2例(20.00%), 继发性c-kit外显子17突变2例(20.00%), 继发性c-kit外显子18突变6例(60.00%)。10例患者的临床病理及基因突变信息见表5。

表5 10例继发性耐药MUT-GIST患者的临床病理及基因突变信息
2.3 基因突变与临床病理特征的关系
2.3.1 基因突变位点与临床病理特征的关系: 原发性MUT-GIST基因突变位点与肿瘤原发部位、肿瘤最大径、核分裂像计数有关(P<0.05), 与其他临床病理特征无关(P>0.05)。c-kit外显子11突变更易发生在胃来源的GIST,其次为小肠; c-kit外显子9突变最常见于小肠来源的GIST; c-kit外显子13、17突变常见于胃来源的GIST; PDGFRA突变常见于胃来源的GIST。c-kit外显子11、9、13、17突变易发生在肿瘤最大径>5~10 cm的GIST。c-kit外显子11突变更易发生在核分裂象0~5个/50 HPFs的GIST,其次为核分裂象>5~10个/50 HPFs的GIST; c-kit外显子9突变最常见于核分裂象>5~10个/50 HPFs的GIST; c-kit外显子13多见于核分裂象>5~10个/50 HPFs的GIST, c-kit外显子17突变常见于核分裂象0~5个/50 HPFs的GIST。PDGFRA突变常见于核分裂象0~5个/50 HPFs的GIST。见表6。
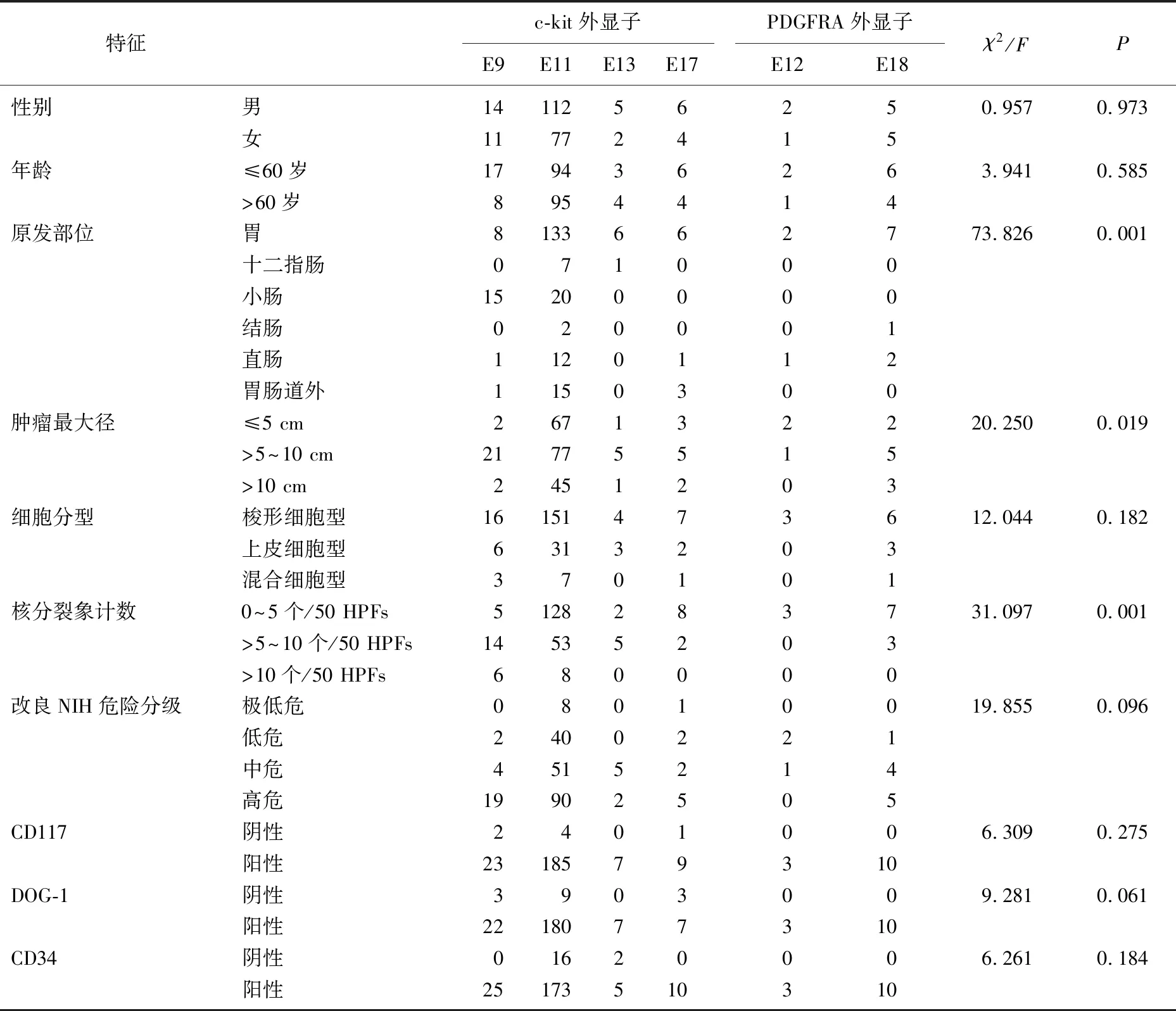
表6 244例原发性MUT-GIST患者基因突变位点与临床病理特征的关系
2.3.2 基因突变类型与临床病理特征的关系: 原发性MUT-GIST基因突变类型与患者年龄、肿瘤原发部位、肿瘤最大径、核分裂像计数、改良NIH危险分级有关(P<0.05),与其他临床病理特征无关(P>0.05)。≤60岁患者突变类型由多到少依次为点突变、缺失突变、重复突变、混合突变和插入突变, >60岁患者则依次为缺失突变、点突变、重复突变、混合突变和插入突变。点突变和缺失突变最常发生在胃来源的GIST, 而小肠来源的GIST中以缺失突变和重复突变更常见。肿瘤最大径≤5 cm的GIST最常见的突变类型为点突变,肿瘤最大径>5 cm的GIST最常见的突变类型为缺失突变。核分裂象0~5个/50 HPFs的GIST最常见的突变类型为点突变,核分裂象>5个/50 HPFs的GIST最常见的突变类型为缺失突变。NIH危险分级为极低危、低危组中最常见的突变类型为点突变,中危、高危组最常见的突变类型为缺失突变。见表7。

表7 244例原发性MUT-GIST患者基因突变类型与临床病理特征的关系
2.4 GIST危险分级的Logistic回归分析
考虑到改良NIH危险分级是由肿瘤原发部位、肿瘤大小、核分裂象计数和肿瘤是否破裂这4个因素计算得来,因此剔除肿瘤原发部位、肿瘤大小、核分裂象计数后将性别、年龄、突变类型、外显子这4个因素作为协变量,以改良NIH危险分级极低危与低危组、中危与高危组为因变量进行二元Logistic回归分析。结果发现,年龄>60岁、缺失突变、c-kit 外显子11突变患者的改良NIH危险分级风险分别增高2.060、3.264、3.819倍。见表8。
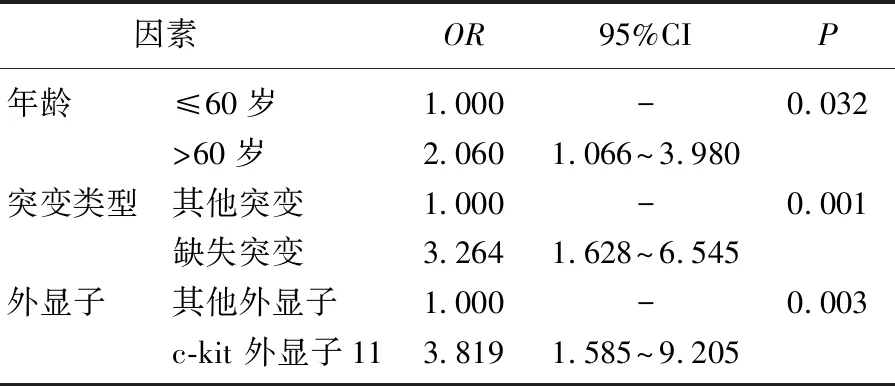
表8 GIST危险分级的Logistic回归分析
3 讨 论
GIST是胃肠道最常见的间叶源性肿瘤,显示Cajal间质细胞分化, c-kit或PDGFRA功能获得性突变被认为是GIST发生的驱动因子[1]。相关研究[3-5]报道, GIST患者c-kit突变发生率为75%~95%, 最主要发生于外显子11,其次为外显子9、13、17, 偶可见外显子14、18突变; PDGFRA突变发生率为3%~10%, 多见于外显子12、18, 外显子14突变少见。本研究中,原发性c-kit突变占80.21%, 原发性PDGFRA突变占4.51%, 野生型占11.81%, 继发性耐药突变型占3.47%。
考虑到PCR反应假阴性结果导致“假野生型”的可能,本研究剔除野生型GIST, 仅对突变型GIST进行分析。本研究发现, c-kit基因突变以外显子11最为常见,其次为外显子9,少见外显子13、17, PDGFRA突变则相对少见,其中外显子18较外显子12突变常见,同时c-kit突变与PDGFRA突变呈现出互斥性,与相关研究[6]结论一致。c-kit基因外显子9突变以A502-Y503重复突变为主(88.00%), 且肿瘤原发部位多位于小肠,与SZUCS Z等[7]研究结果一致。c-kit基因外显子11突变类型、位点最为复杂多样,突变类型以缺失突变和点突变为主,突变热点区域集中在557~560位密码子,其中以W557-K558缺失突变最为常见,与相关报道[8]一致。c-kit基因外显子13、17均为点突变, PDGFRA以外显子18的D842V突变为主,与报道[8]一致。
c-kit和PDGFRA基因突变状态是目前GIST靶向治疗最有力的疗效预测因子[9]。c-kit基因外显子11突变患者对伊马替尼最敏感, c-kit基因外显子9及野生型GIST对伊马替尼反应性不佳,而PDGFRA外显子18的D842V突变则对伊马替尼原发耐药。准确的基因检测是制定个体化治疗策略的重要依据,也是分子靶向治疗发挥疗效的重要前提[10-11], 基因检测应当贯穿于GIST综合治疗的全过程中。值得重视的是,在对基因检测结果进行解读时需要谨慎对待“野生型GIST”, 临床医生需认识到一代测序的局限性和假阴性的存在,对于有条件的野生型GIST可考虑二代测序[12]。
c-kit和PDGFRA基因突变状态对判断GIST患者的自然预后具有指导意义。ANDERSSON J等[13]研究指出, c-kit基因外显子11缺失突变患者的预后较差。本研究发现,外显子11突变患者改良NIH危险分级为中危、高危者占74.60%, 而外显子11突变以缺失突变最多(58.73%),提示外显子11缺失突变与GIST患者不良预后有关。ANDERSSON J等[13]同样认为,c-kit基因外显子9突变具有更高的侵袭性生物学行为。本研究结果显示, c-kit基因外显子9突变患者改良NIH危险分级为中危、高危者占92.00%, 提示外显子9突变与GIST患者不良预后有关。由于PDGFRA基因突变率低、样本量少,目前关于其突变状态与GIST患者预后关系的报道较少。孙祥飞等[14]研究59例PDGFRA突变型GIST发现,肿瘤均来源于胃,其中D842V突变占61.0%, 肿瘤≤5 cm者占55.9%, 核分裂象计数≤5个/50 HPFs者占83.0%, 改良NIH危险度分级以极低危和低危为主,提示PDGFRA突变型GIST恶性程度相对较低,复发风险较低。本研究Logistic回归分析结果显示,年龄大于60岁、缺失突变、c-kit外显子11突变的GIST患者,其改良NIH危险分级风险分别增高2.06、3.264、3.819倍。但该结果还需进一步开展多中心、大样本量研究进行支持。
目前,大多数学者[15-20]认为,伊马替尼继发性耐药的最主要机制是c-kit、PDGFRA基因的二次突变,对伊马替尼耐药病灶的c-kit基因分析显示,最常见的突变类型是点突变,以外显子13、14 和17居多,分别占38.3%、13.4%、54.5%。本研究中,继发性耐药突变均为点突变,外显子18、13、17分别占60.00%、20.00%、20.00%, 发生耐药突变的时间间隔平均为25.5个月。
综上所述, GIST患者发生c-kit、PDGFRA基因突变的概率高,突变位点、类型复杂多变。本研究对原发性MUT-GIST、继发性耐药MUT-GIST的突变类型、突变位点以及相关临床病理学特征进行详尽描述与分析,提示基因突变类型对评估GIST患者预后及靶向治疗反应性均有指导意义,可为GIST全程化管理提供分子病理学参考。未来,基于基因驱动的GIST全程化管理模式势必越来越多地受到重视,可进一步改善GIST患者的预后。
