响应曲面法优化分析甘薯不同肉色薯块多酚的提取条件
2015-08-20胡春霞顾东东傅玉凡赵樱杨春贤曾令江
胡春霞 顾东东 傅玉凡 赵樱 杨春贤 曾令江


摘要:在优化紫心、黄心、橘黄心和橘红心4类肉色11个甘薯品种薯块多酚提取条件的基础上,运用响应曲面法进行乙醇体积分数、浸提时间和固液比3因素3水平Box-Behnken优化设计试验,以比较品种间最佳提取条件的差异。结果表明,11个甘薯品种薯块多酚的最佳提取条件存在异同,需根据研究目的对多酚提取条件采取不同的策略与方法;对批量甘薯品种薯块中的多酚含量高低进行评价时,可选取乙醇体积分数60%、浸提时间9 h、固液比 10 mg/mL 作为多酚通用提取条件。
关键词:甘薯;薯块;多酚;提取条件;响应曲面法
中图分类号:TS201.1 文献标志码: A 文章编号:1002-1302(2015)07-0276-05
植物多酚类物质具有抗炎、抗病毒、抗氧化、抗突变、DNA损伤修复等功能[1-2],能阻止心血管疾病、神经退行性疾病、糖尿病、骨质疏松症、癌症等许多慢性疾病的发生[3-5]。甘薯不仅是发展中国家的重要粮食、饲料和工业原料作物,而且其茎叶和薯块中含有绿原酸、花色苷、黄酮等多酚类物质[6],是多酚类物质新的较好来源[7],这为甘薯产业开发提供了新思路。
响应曲面法(RSM)是一种对多种因素进行试验设计能得到最佳条件的研究方法[8],在甘薯多酚研究中已得到一定的应用,如Song等利用响应曲面法得到微波302 W、浸提时间123 s、乙醇体积分数53%甘薯叶片总酚微波辅助的提取方法[9];陆国权等运用响应曲面法研究甘薯薯块多酚提取条件认为,乙醇体积分数60%、物料比1 g ∶60 mL、80 ℃水浴下浸提88 min最佳[10];Fan等利用响应曲面法得到提取温度 80 ℃、提取时间60 min、固液比1 g ∶32 mL为紫心甘薯薯块花青素的最佳提取条件[11];韦学丰等对甘薯叶黄酮提取方法进行响应曲面法优化,得到微波功率302 W、微波时间4 min、乙醇体积分数50%、固液比1 g ∶43 mL為最佳提取条件[12]。
甘薯多酚固有含量因品种、种植地点、栽培措施等不同而有差异,而对其含量测定时,也会受提取溶剂种类和浓度、浸提时间、提取温度、固液比等因素影响[13-14]。前人在甘薯多酚提取时,多数是针对某一类肉色甘薯品种[15]或一类多酚[11],针对不同肉色甘薯薯块多酚通用提取条件的研究较少。本试验选取紫心、黄心、橘黄心和橘红心4类肉色的11个甘薯品种,采取25 ℃、振荡辅助提取条件下进行乙醇体积分数、浸提时间和固液比3个单因素提取条件,利用响应曲面法对不同肉色甘薯薯块多酚提取条件进行优化与比较,为甘薯资源的多酚含量评价与筛选奠定一定的基础。
1 材料与方法
1.1 材料与试剂
11个不同肉色甘薯品种薯块(表2)采自西南大学重庆市甘薯工程技术研究中心合川试验基地。无水乙醇(分析纯),重庆川东化工有限公司产品;无水碳酸钠(分析纯),成都市科龙化工试剂厂产品;福林酚(Folin-Ciocalteu)反应试剂、绿原酸(chlorogenic acid)标准品,Sigma公司产品。
1.2 仪器与设备
FW135型中草药粉碎机,天津市斯特仪器有限公司生产;CM-2300D美能达色差计,日本美能达公司生产;BSA124S型电子分析天平,赛多利斯科学仪器北京有限公司生产;MIKRO 22R型离心机,Hettich Zentrifugen公司生产;HZ-8211K台式空气恒温振荡器,金坛市盛蓝仪器制造有限公司生产;SY-2000旋转蒸发器,上海亚荣生化仪器厂生产;T6新世纪型紫外可见分光光度计,北京普析通用仪器有限责任公司生产。
1.3 方法
1.3.1 样品粉末的制备 薯块收获期,选用大小均匀一致的薯块,清水洗净,室温下晾干;四分法取样,切成1 cm×1 cm×1 cm 左右的薯粒,混匀,40 ℃条件下烘干至恒质量;将烘干薯粒粉碎,120目过筛,装瓶,密封,-20 ℃低温保存,备用。
1.3.2 甘薯薯块粉末色度的测定 CM-2300D美能达色差计测定11个甘薯薯块样品粉末的L*、a*和b* 3个指标,计算C*值和h°值[16-17]。
1.3.3 样液提取与制备 准确称取0.300 0 g样品粉末于带塞锥形瓶中,加入一定体积不同体积分数的乙醇提取剂,25 ℃、100 r/min避光振荡浸提一定时间;浸提液 5 000 r/min 离心20 min;取上清液,提取剂定容至50 mL;50 ℃ 旋转蒸发乙醇至完全,超纯水定容至50 mL。每个品种重复3次。
1.3.4 提取条件优化 以乙醇体积分数60%、浸提时间 9 h、固液比10 mg/mL为基础,改变任一条件进行单因素试验,研究乙醇体积分数、浸提时间、固液比单因素对测定多酚含量的影响。乙醇体积分数设40%、50%、60%、70%、80% 5个水平;浸提时间设3、6、9、12、15、18 h 6个水平;固液比设4、7、10、13、16、19 mg/mL 6个水平。在单因素试验基础上,确定乙醇体积分数、浸提时间、固液比适宜的设计范围,利用Design-Expert 8.0.6.1软件,进行3水平3因素 Box-Behnken 试验设计(表2),并按照相应条件测定多酚含量,明确优化的提取条件。
1.3.5 多酚含量测定
1.3.5.1 绿原酸标准曲线的制作 准确称取3.04 mg绿原酸标准品,超纯水溶解,定容至25 mL,配制成质量浓度为012 mg/mL标准溶液;将标准液分别稀释成0.006、0.012、0024、0.049、0.073、0.097、0.120 mg/mL的溶液;分别取稀释液1 mL,加入4 mL稀释10倍的福林酚反应试剂,摇匀,静置3 min;加入3 mL质量分数的20% Na2CO3,混匀,室温、避光放置1 h,分光光度计750 nm处测定吸光度。以绿原酸质量浓度(x)为横坐标,吸光值(y)为纵坐标作图,得到线性方程y=7.280 7x+0.012 5(r2=0.998 8)。
1.3.5.2 多酚含量的测定 取1 mL各提取样液,参照绿原酸标准曲线绘制过程,以空白为对照,750 nm处测定相应的吸光度,计算得到多酚含量,公式为:多酚含量(mg/100g)=50×(吸光度-0.012 5)×100/(0.300 0×7.280 7)。
1.4 数据分析
采用Design-Expert 8.0.6.1软件,进行RSM试验设计,并对所得结果进行方差分析和相关系数的计算等;采用SPSS 16.0软件进行显著性分析和相关性分析。
2 结果与分析
2.1 甘薯薯块粉末样品的色度值
由表2可见,4个紫心品种的L*、a*、b*、C*和h°值差异达到极显著性水平;除渝紫薯7号与徐薯22的b*值外,4个紫心品种的L*、b*和h°值均极显著低于其他肉色薯块相应的度量值,a*值极显著高于其他肉色薯块;L*、a*、b*、C*和h°值在其他肉色品种间表现有一定的交叉性。
2.2 甘薯多酚提取单因素试验
2.2.1 乙醇体积分数对多酚含量的影响 由图1可知,提取的多酚含量随乙醇体积分数的增加呈先上升、再减小或稳定趋势,乙醇体积分数对黄心、橘黄心和橘红心类品种薯块多酚的提取影响较大;渝紫薯7号、2010246、徐薯22在乙醇体积分数50%条件下提取的多酚含量相对最高,烟紫薯761在乙醇体积分数70%条件下提取的多酚含量相对最高,其他各品种均在乙醇体积分数60%下提取的多酚含量最高。
2.2.2 浸提时间对多酚含量的影响 由图2可知,浸提9 h各品种得到的多酚含量达到最高;紫心和黄心甘薯在6~12 h内多酚含量差异不大,在此时间浸提多酚比较稳定;浸提时间对橘黄心和橘红心品种薯块多酚含量的影响较大。
2.2.3 固液比对多酚含量的影响 由图3可以看出,烟紫薯761在固液比7 mg/mL条件下得到的多酚含量相对最高,其他3个紫心品种在10 mg/mL条件下得到的多酚含量相对最高;黄心品种在固液比7~10 mg/mL范围内得到的多酚含量相对最高,且较为稳定;橘黄心品种渝薯17、南薯88在固液比4~10 mg/mL范围内得到的多酚含量最高,且较为稳定,而橘红心品种薯块在固液比10 mg/mL下得到的多酚含量相对最高。
2.3 响应曲面法优化提取条件
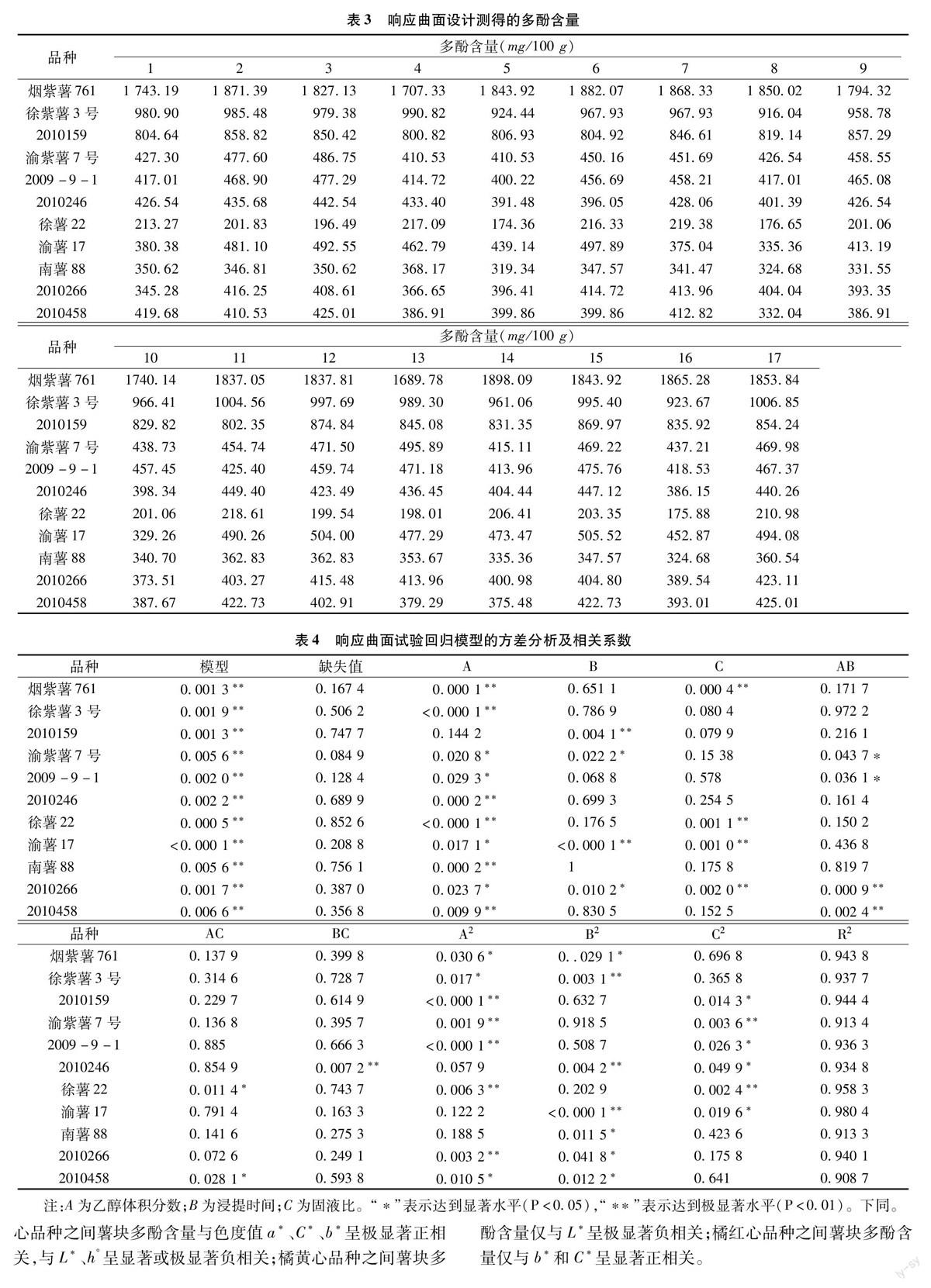
2.3.1 响应曲面试验结果的方差分析及相关系数 对测得的多酚含量(表3)进行方差分析,结果(表4)表明,所有品种2次回归方程整体模型达到极显著水平(P<0.01),能正确反映各品种多酚含量与各因素之间的关系; 各品种模型缺失值均大于0.05,说明所得实际方程与实际拟合中非正常误差所占比例小;用于模型分析的相关系数R2均大于0.9,说明该模型的相关度好,采用响应曲面法设计所得的回归模型有效,适用于甘薯薯块多酚含量的理论预测;除品种2010159外,提取剂乙醇体积分数对各品种多酚含量的提取均有显著或极显著性影响;浸提时间和固液比对多酚含量的提取因品种不同而异;在不同品种上,3个单因素的交互影响表现各有不同。
2.3.2 提取最优条件 由表5可知,各品种最佳提取条件各不相同,除烟紫薯761外,乙醇体积分数多集中于50%~60%;除2010458外,浸提时间集中于9~12 h;固液比在7~10 mg/mL之间。
2.4 响应曲面最优条件下预测值、实测值及60%、9 h、10 mg/mL 提取条件下多酚含量比较
由表6可知,响应曲面法所得各品种多酚的预测值,除烟紫薯761和徐薯22外,与实测值无显著性差异,变异系数在0.53%~4.56%之间,相对较小;除烟紫薯761、徐薯22和南薯88外,其他8个甘薯品种最优条件下实测值与乙醇体积分数60%、提取时间9 h、固液比10 mg/mL条件下测定的多酚含量无显著性差异;乙醇体积分数60%、提取时间9 h、固液比10 mg/mL提取条件下,有72.73%的测试品种获得较好的多酚含量,可用于薯块高多酚含量甘薯种质资源的筛选。
2.5 多酚含量与色度值的相关性
由表7可知,所有甘薯品種之间薯块多酚含量与色度值a*呈极显著正相关,与L*、b*和h°呈极显著负相关,而与C*无显著相关性;紫心品种之间薯块多酚含量与色度值a*、C*呈极显著正相关,与L*、b*和h°呈显著或极显著负相关;黄
3 结论与讨论
乙醇体积分数、浸提时间和固液比3个因素对11个不同心色品种薯块多酚含量的提取影响程度不一样,影响强弱为橘黄心薯块和橘红心薯块)黄心薯块>紫心薯块。乙醇为提取溶剂更有利于多酚含量的提取,且乙醇具有低毒、易得等优点,除2010246、渝紫薯7号、徐薯22和烟紫薯761,本试验其他7个甘薯品种以乙醇作为溶剂提取多酚的最佳浓度为60%,与Wang等结果[18]基本相同;最佳浸提时间为9 h,与利用超声波辅助[6]相比,提取时间相对较长;各薯块品种最佳固液比集中于10 mg/mL,与师超等结论[19]相同。
响应曲面试验设计所得11个薯块品种的最优多酚提取条件各有差异,其可能原因是一些种类的多酚在某些肉色甘薯中主要成分不同,如黄色、橙色和紫色甘薯中分别以黄酮、β-胡萝卜素和花色苷[20]为主,从而导致多酚提取条件出现细微差异。另外,如果甘薯品种薯块多酚含量较高,那么响应曲面设计所得最优提取条件中乙醇体积分数会相应更高、浸提时间会相对更长、固液比也会相对减小。因此,对薯块某一品种精确鉴定多酚含量时,需要使用多酚的最佳提取条件;而对批量资源多酚含量的相对高低进行比较时,则可采取乙醇体积分数60%、浸提时间9 h和固液比10 mg/mL的通用提取条件进行测定。
多酚物质能使植物器官呈现不同颜色。本试验初步表明,不同肉色品种薯块的多酚含量影响L*、a*、b*、C*、h°5个色度值指标,而同类肉色品种薯块的多酚含量对薯块的L*、a*、b*、C*、h°的影响也各不相同,这对通过利用便携式色差计快速判定资源多酚含量的相对高低提供了一种新的思路。
参考文献:
[1]Manach C,Scalbert A,Morand C,et al. Polyphenols:food sources and bioavailability[J]. The American Journal of Clinical Nutrition,2004,79(5):727-747.
[2]Nichols J A,Katiyar S K. Skin photoprotection by natural polyphenols:anti-inflammatory,antioxidant and DNA repair mechanisms[J]. Archives of Dermatological Research,2010,302(2):71-83.
[3]Moreno S,Scheyer T,Romano C S,et al. Antioxidant and antimicrobial activities of rosemary extracts linked to their polyphenol composition[J]. Free Radical Research,2006,40(2):223-231.
[4]Scalbert A,Manach C,Morand C,et al. Dietary polyphenols and the prevention of diseases[J]. Critical Reviews in Food Science and Nutrition,2005,45(4):287-306.
[5]左麗丽,王振宇,樊梓鸾,等. 植物多酚类物质及其功能研究进展[J]. 中国林副特产,2012,5(5):39-42.
[6]Fang Z X,Bhandari B. Encapsulation of polyphenolse-a review[J]. Trends in Food Science and Technology,2010,21(10):510-523.
[7]Jung J K,Lee S U,Kozukue N,et al. Distribution of phenolic compounds and antioxidative activities in parts of sweet potato (Ipomoea batata L.) plants and in home processed Roots[J]. Journal of Food Composition and Analysis,2011,24(1):29-37.
[8]Yang B,Zhao M M,Shi J,et al. Effect of ultrasonic treatment on the recovery and DPPH radical scavenging activity of polysaccharides from longan fruit pericarp[J]. Food Chemistry,2008,106(2):685-690.
[9]Song J F,Li D J,Liu C Q,et al. Optimized microwave-assisted extraction of total phenolics(TP) from Ipomoea batatas leaves and its antioxidant activity[J]. Innovative Food Science and Emerging Technologies,2011,12(3):282-287.
[10]陆国权,赵文静. 甘薯多酚最佳提取工艺及多酚含量的基因型差异研究[J]. 中国粮油学报,2009,24(3):49-52.
[11]Fan G J,Han Y,Gu Z X,et al. Optimizing conditions for anthocyanins extraction from purple sweet potato using response surface methodology (RSM)[J]. LWT-Food Science and Technology,2008,41(1):155-160.
[12]韦学丰,罗 静. 甘薯叶黄酮微波提取工艺的响应面法优化[J]. 湖北农业科学,2013,52(6):1391-1394,1400.
[13]Gan C Y,Latiff A A. Optimisation of the solvent extraction of bioactive compounds from Parkia speciosa pod using response surface methodology[J]. Food Chemistry,2011,124(3):1277-1283.
[14]Thoo Y Y,Ho S K,Liang J Y,et al. Effects of binary solvent extraction system,extraction time and extraction temperature on phenolic antioxidants and antioxidant capacity from mengkudu (Morinda citrifolia)[J]. Food Chemistry,2010,120(1):290-295.
[15]Li J W,Zhang L F,Liu Y F. Optimization of extraction of natural pigment from purple sweet potato by response surface methodology and its stability[J]. Journal of Chemistry,2013:1-5.
[16]Ribeiro T,Fernandes C,Nunes F M,et al. Influence of the structural features of commercial mannoproteins in white wine protein stabilization and chemical and sensory properties[J]. Food Chemistry,2014,159:47-54.
[17]Fava J,Hodara K,Nieto A,et al. Structure (micro,ultra,nano),color and mechanical properties of Vitis labrusca L.(grape berry) fruits treated by Hydrogen peroxide,UV-C irradiation and ultrasound[J]. Food Research International,2011,44(9):2938-2948.
[18]Wang J,Sun B G,Cao Y P,et al. Optimisation of ultrasound-assisted extraction of phenolic compounds from wheat bran[J]. Food Chemistry,2008,106(2):804-810.
[19]师 超,卞 科. 黄心甘薯多酚类物质的提取工艺研究[J]. 河南工业大学学报:自然科学版,2011,32(2):19-22.
[20]Oki M,Masuda S,Furuta S,et al. Involvement of anthocyanins and other phenolic compounds in radical-scavenging activity of purple-fleshed sweet potato cultivars[J]. Journal of Food Science,2002,67(5):1752-1756.
