工程化酿酒酵母合成植物三萜类化合物
2015-08-20朱明王彩霞李春
朱明,王彩霞,李春,
(1 天津大学化工学院,系统生物工程教育部重点实验室,天津 300072;2 北京理工大学生命学院,北京 100081 )
引 言
三萜类化合物是一类由多个异戊二烯单位构成的含有30 个碳原子的烃类含氧衍生物。结构上多为四环三萜或五环三萜。其中代表性的有甘草次酸(Glycyrrhetinic acid)、人参皂苷(Ginsenosides)、白桦脂酸(betulinic acid)、乌苏酸(ursolic acid)等。根据结构的不同,人参皂苷又分为齐墩果酸型(oleanolic acid)、人参二醇型(protopanaxadiol)、人参三醇型(protopanaxatriol),具体结构式如图1所示。药理学证明三萜类化合物具有多样化的药理活性,被广泛应用于医药、保健领域。人参皂苷具有较好的抗肿瘤、抗炎症等功效,是名贵中药材人参与西洋参的主要成分[1];甘草酸在保肝[2]、抗病毒[3]、抗过敏[4]、抗癌症[5]等方面具有非常重要的作用,同时也可作为甜味剂或者食用添加剂[6]。甘草次酸(Glycyrrhetinic acid,GA)作为甘草酸生物合成的前体物质,具有相似的医药价值,并且极性较弱,容易透过细胞膜,药物动力学证明甘草酸的功能主要通过甘草次酸的形式实现,它是甘草酸发挥生物活性的基础[7];研究证明大豆皂苷同样具有抗肿瘤[8]、降低胆固醇[9]等保健作用。
目前三萜类化合物的合成主要是通过植物提取,以甘草次酸为例,将植物甘草中提取的甘草酸,加工为铵盐后再经水解得到甘草次酸。历经粉碎、过滤、蒸发、浓缩、搅拌、水洗、重结晶、脱色等多个步骤,提取效率低,并且周期长、成本高、对环境破坏较大,仅靠甘草、大豆、人参、柴胡等药用植物的天然生产,远远不能满足化工、药物等多个领域对三萜类化合物的需求,如何快速高效可持续地生产是人们遇到的难题。随着合成生物学的发展,利用微生物来生产萜类等具有重大医药价值的化合物得到了越来越多的关注。在代谢途径层面上,利用合成生物学技术可以对现有的生物合成路径在微生物细胞工厂中进行重建,或者针对不同宿主,对整个代谢途径进行重新设计与构建,将基因线路等小零件组装到微生物细胞工厂中,从而生产特定的目标产物。许多的燃料化学品正是基于此而实现细胞工厂化的生产,如醇类、脂肪酸酯、烃类物质[10]。Liao 等改造大肠杆菌生产异丁醇[11]与正丁醇[12];Zhang 等[13]利用大肠杆菌组成型生产异丁醇;Keasling 等[14]利用大肠杆菌构建了脂肪酸酯的合成路径,生物柴油的产率达到了理论值的9.4%。目前在酿酒酵母内已经实现三萜类化合物骨架(如2,3-氧化鲨烯、β-香树脂醇)的合成,那么如何高效地对三萜骨架进行特异性氧化是人们遇到的又一难题。
本文将对酿酒酵母中三萜类化合物的合成途径及在此途径中起关键作用的CYP450 氧化酶进行介绍。
1 三萜类化合物合成途径的解析
自然界中存在两种萜类合成途径(图1):甲羟戊酸途径(MVA)与1-脱氧木酮糖-5-磷酸途径(MEP),两个途径均能合成异戊烯基焦磷酸(IPP)与二甲基烯丙基焦磷酸(DMAPP),以此为基础,进一步反应生成香叶基焦磷酸(GPP),法呢基焦磷酸(FPP)。其中GPP 为单萜的合成骨架,FPP 为倍半萜的合成骨架。由 FPP 与 IPP 反应生成的GGPP(香叶基香叶基焦磷酸)为二萜的合成骨架。
MEP 途径为大肠杆菌唯一的萜类合成途径,但是该途径没有GGPP 合成能力,而且很少能表达有活性的植物来源的CYP450 氧化酶,因此大肠杆菌不适于三萜类物质的生产。相比之下,酵母具有普遍存在于真核生物细胞的MVA 途径,且自身具有类异戊二烯与固醇的合成途径,并且在结构上还具有完整的膜系统,非常适合表达有活性的植物来源的CYP450 氧化酶。所以目前三萜化合物的人工合成主要是在酵母细胞内完成的。
MVA 途径所产生的化合物是许多药物中间体与化工原料的重要来源,应用十分广泛。目前许多研究就是针对酵母内MVA 途径进行改造从而生产目的产物。具有重要医药价值的抗疟疾药物——倍半萜类青蒿素的生物合成就是最成功的例子。Keasling 等选择酿酒酵母作为宿主,过量表达HMG辅酶A 还原酶,替换鲨烯合成酶启动子降低其表达量,使法呢基焦磷酸的产量得到积累,同时引入来源青蒿的紫穗槐-4,11-二烯合成酶、细胞色素CYP450 单氧化酶和NADPH-细胞色素CYP450 氧化还原酶,使酿酒酵母可以直接合成青蒿酸[20]。在此基础上,在酿酒酵母中引入2 种脱氢酶:乙醇脱氢酶与乙醛脱氢酶,可以将青蒿酸生物合成中由单一的细胞色素氧化酶 CYP71AV1 催化的由amorphadiene 到青蒿酸的3 步反应,转变为由多个酶(CYP71AV1、CPR1、CYB5、ADH1、ALDH1)催化的3 步反应,大大提高反应效率,从而在酵母中重建了青蒿酸的生物合成途径,最终经过发酵优化,青蒿酸产量达到25 g·L-1[21]。抗癌药物二萜类的紫杉醇在生物合成方面的研究也取得了很大的进展:Stephanopoulos 等[22]将紫杉二烯的合成途径引入大肠杆菌中,并对整个代谢途径进行优化,获得高产紫杉二烯的大肠杆菌细胞,产量达到了1 g·L-1。
但是关于三萜类化合物完整的生物合成路径尚不清晰。以甘草次酸为例,直到2008年,日本的Muranaka 等[17]通过ESTs (表达序列标签)结合转录分析,发现了细胞色素单氧化酶基因CYP88D6,通过体外与酵母体内的酶活检测,最终确定了此基因编码的酶可以顺序催化β-香树脂醇11 位上的C 首先羟基化,然后进一步氧化为11-oxo-β-amyrin[17]。在此基础上,2011年该课题组又发现了一个酶CYP72A154,该酶具有氧化11-oxo-β-amyrin 的能力, 通过三步顺序氧化, 两个中间产物(30-hydroxy-11-oxo-β-amyrin、glycyrrhetaldehyde),实现了由11-oxo-β-amyrin 到甘草次酸的转化[16]。通过这两种细胞色素氧化酶的催化功能,实现了由β-
香树脂醇到甘草次酸的转化,目前已报道酵母内甘草次酸产量约为15 μg·L-1。其可能的催化过程如图2 所示。但是两个氧化酶催化效率比较低,因此还需继续寻找催化效率更高的酶或对已有的氧化酶进行人工改造提高催化效率,从而最终提高终产物的产量。
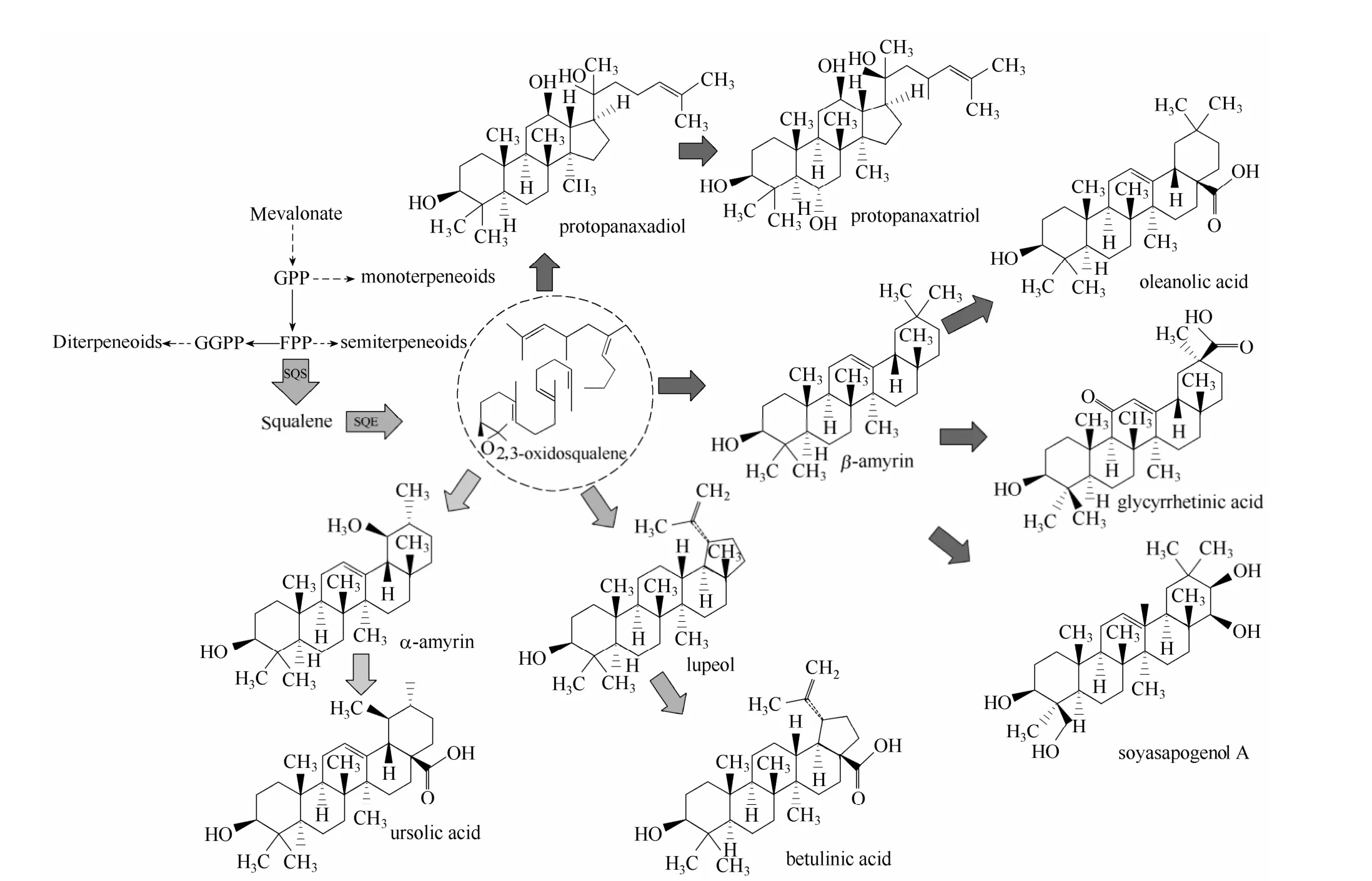
图1 三萜类化合物的生物合成路径[15-19]Fig.1 Biosynthesis pathway for triterpeneoids[15-19]
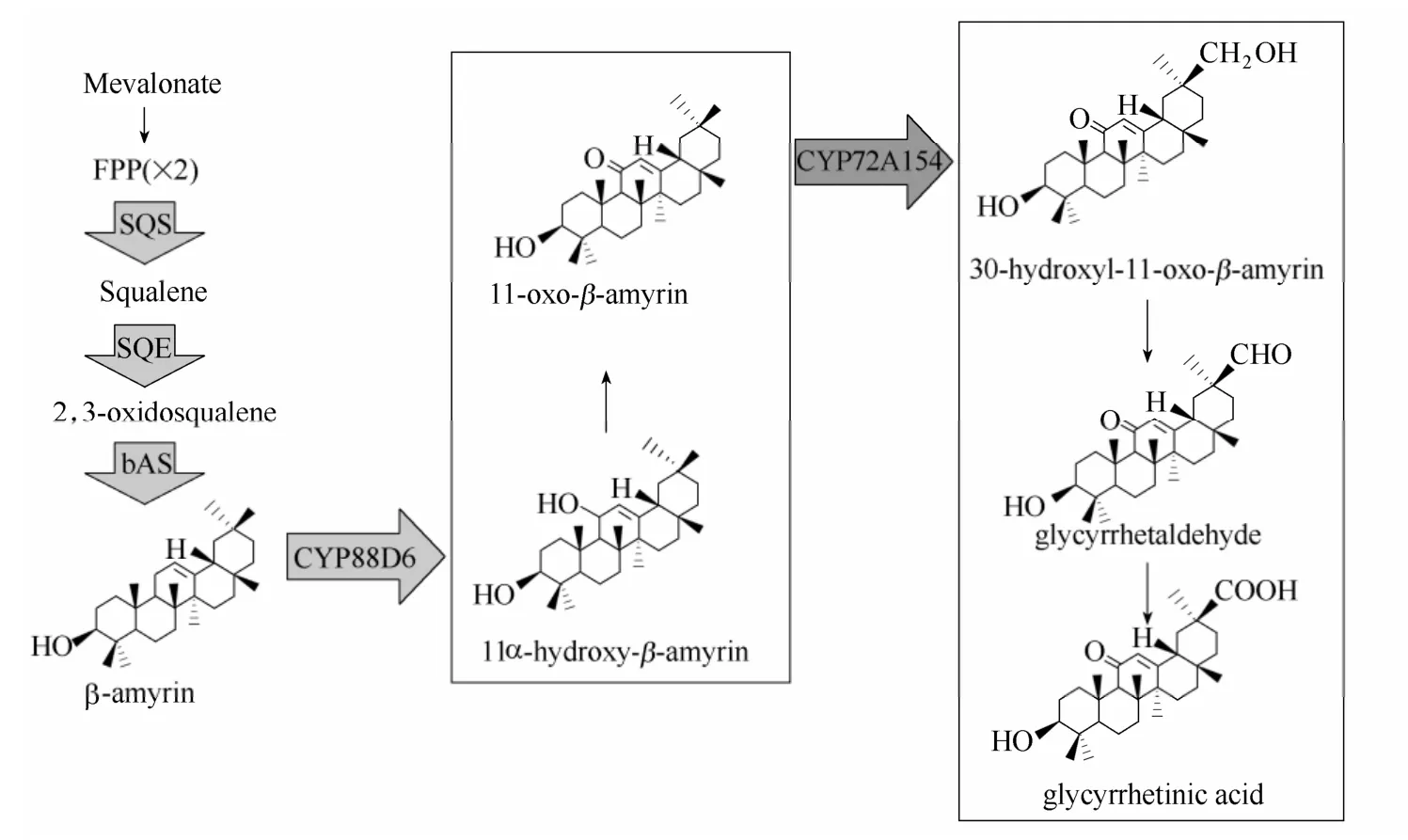
图2 甘草次酸的生物合成路径[16-17]Fig.2 Biosynthesis pathway for glycyrrhetinic acid[16-17]
在三萜类化合物整个合成途径的前体物中,β-香树脂醇的研究最引人注目。鲨烯合酶催化两个FPP 发生缩合反应生成鲨烯,其在环化酶的催化下生成2,3-氧化鲨烯,β-香树脂醇合成酶则催化2,3-氧化鲨烯形成齐墩果烷型五环三萜的骨架β-香树脂醇。但是由于酵母本身缺少以上3 种酶,无法合成β-香树脂醇。迄今为止,已经从拟南芥、豌豆、紫苑等多种植物中克隆到β-香树脂醇合成酶基因。Zhang 等[15]的研究表明在酿酒酵母中提高限速酶的表达量,增加前提物供应,可以增加目的产物的产量,β-香树脂醇产量达到了107 mg·L-1。Li 等利用合成生物学手段,通过染色体重组整合技术,对β-香树脂醇合成路径进行了精细的调控,构建出了组成型稳定生产β-香树脂醇的酵母工程菌,发酵优化后产量达到156.7 mg·L-1(data not published),为以β-香树脂醇为前体物的其他萜类物质的生物合成奠定了基础。
2 三萜类合成途径在酿酒酵母中的组装
酿酒酵母是单细胞,能进行高密度发酵,遗传背景清楚,具有良好的生物安全性,并且针对其遗传改造的方法成熟多样,因此酿酒酵母被认为是合成天然产物的理想宿主。细胞内三萜化合物合成途径中各关键酶基因正确高效地导入到酿酒酵母中是至关重要的一步。利用酿酒酵母本身具有的同源重组功能可以实现高GC 含量、多片段、大片段(454 kb)在细胞中的精确组装[23]。Zhang 等[15]利用DNA assembler 方法成功地将三萜合成途径中的几个关键酶基因片段同时导入到酿酒酵母中,增加了前体物供应,实现了人参二醇型(protopanaxadiol)、人参三醇型(protopanaxatriol)人参皂苷的合成。在多途径组装方面,Wingler 等[24]利用迭代拼接法将多基因线路直接组装到酵母染色体中,运用此方法构建的模拟文库可以包含104生物合成途径。在途径优化方面模块化的平衡理论有着非常重要的作用。Stephanopoulos 等[22]将紫杉醇合成路径分为上游前体物供应模块与下游合成模块,分别对它们进行构建与优化,从而大幅度提高了紫杉二烯的产量。大规模基因组编辑技术(如CRISPR-Cas9 系统)的飞快发展也为酵母体内的多个靶基因的同时编辑提供了可能。如Keasling 等[25]利用此技术对甲羟戊酸途径中的5 个基因位点同时进行敲除,使甲羟戊酸产量提高了41 倍。
3 三萜类合成途径中细胞色素氧化酶的挖掘与应用
CYP450 氧化酶是一类超基因家族编码的含有血红素的氧化酶类,广泛分布于植物、动物、真菌、细菌,具有多样化的催化功能,参与萜类、生物碱类、甾醇类及其他一些物质的合成与代谢反应,主要催化的反应有羟基化、环氧化、脱羟基化等。自从第一个植物CYP450 氧化酶CYP71A1 在酵母体内成功表达之后[26],越来越多的植物来源的CYP450 氧化酶在酵母体内进行了功能验证。如大豆的苯基脲类羟化酶/N-去甲基酶CYP71A10[27]、3,9-二氢紫檀-α-羟化酶CYP93A1[28]、黄酮合酶CYP93B6[29];拟南芥中的反式肉桂酸-4-羟化酶CYP73A5[30]、阿魏酸-5-羟化酶CYP84A1[31]、对香豆酰-3-羟化酶CYP98A3[32],还有红豆杉中的紫杉烷-10β-羟化酶CYP725A1[33]等。
以β-香树脂醇为前体物合成甘草次酸等三萜类化合物的过程中,细胞色素氧化酶起着决定性的作用。β-香树脂醇不仅经CYP450 氧化酶催化可以生成甘草次酸,也可在其他CYP450 氧化酶的作用下,生成三萜皂苷类物质。在兰赛兰特杜茎山内,β-香树脂醇经CYP716A15 与CYP87D16 的共同催化,生成十六-羟基齐墩果酸[34]。在苜蓿内,β-香树脂醇可被CYP93E2 与CYP72A61v2 催化生成大豆皂醇B(soyasapogenol B),或者被 CYP716A12 与CYP72A68v2 催化形成丝石竹酸(gypsogenic acid)[19,35]。在柴胡内,CYP716Y1 与CYP716A12共同催化 β-香树脂醇生成刺囊酸(echinocystic acid)[36]。
那么如何对起关键作用的CYP450 酶进行挖掘呢?截至2013年12月,植物中已经注释过的细胞色素氧化酶已经超到7512 个[37],未来越来越多的酶将被发现与注释。目前对CYP450 氧化酶的挖掘主要利用转录组分析的手段。2014年Chen 等[38]对秤星树的转录组进行分析,按照三萜皂苷的结构推断出可能的合成路径,并且结合进化分析,从数据库中寻找可能起催化作用的CYP450 氧化酶。Ghosh等[39]通过茉莉酸甲酯诱导植物罗勒中次级代谢产物的合成,最终发现了388 个响应茉莉酸甲酯的转录本,进一步结合代谢分析,发现了编码α/β-香树脂醇合成酶的基因。Chen 等[40]利用甘草的EST 数据,结合转录组分析,发现参与甘草酸合成途径中的16 个酶的编码基因。Dixon 等[41]对基因表达簇的综合分析,挖掘催化苜蓿中萜类物质合成的酶。2013年Ramilowski 等[42]对甘草的转录组(不同产量、组织、季节等)分析发现43882 个unigene,并对可能参与其中的CYP450 氧化酶、转运蛋白、糖基转移酶等进行了注释。这些实验结果为下一步深入解析甘草次酸合成途径奠定了坚实的基础。
但是植物体内三萜及其他萜类的合成路径的解析,不能简单地通过转录组分析得到。2011年Goossens 等[43]对苜蓿的毛状根通过反相高效液相色谱-负离子电喷雾离子化与傅里叶变换离子回旋共振质谱[reversedphase liquid chromatography coupled to negative-ion electrospray ionization Fourier transform ion cyclotron resonance mass spectrometry (LC ESI FT-ICR MS)]联用的方式,成功检测到未知化合物并对其进行分子式的预测分析,在检测到的79 种皂苷中,61 种是新发现的。这一技术的开发与研究结果将有助于三萜皂苷合成过程中功能基因组学的研究。
在酵母体内CYP450 氧化酶催化的反应中必须有CYP450 氧化酶还原酶(CPR)的参与。CPR 是一种膜锚定蛋白,主要定位于内质网,它拥有3 个辅因子结合域(FMN、FAD、NADPH),其中的一个linker 位于FMN 与FAD/NADPH 之间。CPR 在功能上主要是将NADPH 传递来的电子传递到CYP450 氧化酶的血红素上[37,44]。酵母内源的CPR表达量低,并不能有效地传递电子,造成电子传递效率的不匹配,影响了CYP450 氧化酶最大活力的表达。植物来源的CPR 的表达是酵母体内CYP450 氧化酶高效表达的关键。在CPR 的筛选研究中,CPR 大多来自植物本身,如AtCPR1[15]、LjCPR1[17]等。
目前提高CYP450 氧化酶的活力主要是通过对酶分子进行人工改造或适应性进化。2014年Nielsen等[45]对酿酒酵母进行了耐热的适应性进化研究,发现改变甾醇的类型可以明显提高酵母的耐热性,从而为研究酵母的耐热性奠定了基础;在植物中,CYP450 氧化酶的表达量明显高于CPR,因为过量表达CPR 对细胞也会产生毒害作用:电子传递不匹配,产生化学活性氧自由基。在一些微生物体内可以通过建立CYP450-CPR 融合蛋白表达的方式来减少对CPR 细胞的毒害,如融合了红豆杉CPR 的CYP725A4 氧化酶在大肠杆菌宿主表达后显示了其催化活性[22]。
4 酿酒酵母合成三萜类物质的转运与过程强化
三萜物质在细胞内合成后很少能分泌到胞外,有些物质的累积对细胞会产生毒害作用,同时对整个合成路径产生反馈抑制,影响代谢流方向,打破了整个代谢通路的平衡。如果能将代谢产物排出细胞,不仅减少对细胞的伤害,有利于细胞的正常生长,而且能提高目的产物的产量。目前已报道运输三萜物质的转运蛋白非常少,植物内仅发现PDR 蛋白参与萜类物质代谢运输。在烟草中,NpPDR1 蛋白可以转运二萜香紫苏醇[46]。
Goossens 等发现添加β-环糊精(β-CD)类物质可以将异源非挥发性疏水三萜类物质运输到细胞外。β-CD 是多个吡喃葡萄糖单元以α-1,4 键结合生成的环状物质,具有桶装的外形与内腔,在整个环状结构中,外侧具有多个羟基,呈亲水性;内部由氢原子与氧原子构成,具有疏水性,整个空腔可以包裹萜类化合物。由于其中的葡萄糖单体具有5 个手性中心,所以它常作为手性固定相分离光学异构体,在气相色谱中应用比较广泛。研究结果表明,添加甲基β-环糊精可促进β-香树脂醇转运到细胞外,明显减少产物的反馈抑制,提高产率。环糊精结构不同,效果差异巨大:甲基β-环糊精(MβCD)效果最好,β-环糊精次之,并且作用效果呈剂量效应,α-环糊精与γ-环糊精则不具有此功能[36]。
5 结 论
本文综述了酿酒酵母合成三萜类化合物合成路径及在整个途径起关键作用的CYP450 氧化酶的研究进展。三萜化合物的生物合成是基于酵母内的MVA 途径,以2,3-氧化鲨烯为底物,经鲨烯合成酶、环化酶催化作用,生成皂苷类人参二醇型与人参三醇型物质,或经β-香树脂醇合成酶作用形成三萜骨架β-香树脂醇。此时经不同的CYP450 氧化酶(如CYP88D6、CYP72A154)与其相应的还原酶催化作用下,历经多种中间产物,最终生成甘草次酸和皂苷类物质。在此过程中,作为宿主的酿酒酵母不断地被改造与优化、相关代谢数据库的不断涌现、产物合成途径的不断挖掘、遗传改造手段和分析方法的不断创新,必将能实现人工智能、高效的微生物细胞工厂的构建,增加产量,降低成本,最终完成高附加值次生代谢产物绿色可持续的工业化生产。
[1]Yan X, Fan Y, Wei W, Wang P, Liu Q, Wei Y, Zhang L, Zhao G, Yue J, Zhou Z.Production of bioactive ginsenoside compound K in metabolically engineered yeast [J].Cell Research, 2014, 24(6): 770-773.
[2]Kiso Y, Kato O, Hikino H.Assay methods for antihepatotoxic activity using peroxide-induced cytotoxicity in primary cultured hepatocytes1 [J].Planta Medica, 1985, 51(1): 50-52.
[3]Pompei R, Flore O, Marccialis M A, Pani A, Loddo B.Glycyrrhizic acid inhibits virus growth and inactivates virus particles [J].Nature, 1979, 281(5733): 689-690.
[4]Park H Y, Park S H, Yoon H K, Han M J, Kim D H.Anti-allergic activity of 18beta-glycyrrhetinic acid-3-O-beta-D-glucuronide [J].Archives of Pharmacal Research, 2004, 27(1): 57-60.
[5]Okamoto H, Yoshida D, Saito Y, Mizusaki S.Inhibition of 12-O-tetradecanoylphorbol-13-acetate-induced ornithine decarboxylase activity in mouse epidermis by sweetening agents and related compounds [J].Cancer Letters, 1983, 21(1): 29-35.
[6]Kitagawa I.Licorice root – a natural sweetener and an important ingredient in Chinese medicine [J].Pure and Applied Chemistry, 2002, 74(7): 1189-1198.
[7]Nose M, Ito M, Kamimura K, Shimizu M, Ogihara Y.A comparison of the antihepatotoxic activity between glycyrrhizin and glycyrrhetinic acid [J].Planta Medica, 1994, 60(2): 136-139.
[8]Zhang W, Popovich D G.Effect of soyasapogenol A and soyasapogenol B concentrated extracts on Hep-G2 cell proliferation and apoptosis [J].Journal of Agricultural and Food Chemistry, 2008, 56(8): 2603-2608.
[9]Smith J D, Salyer J, Esawarnanadam S, Lee S O.Hypocholesterolemic effects of soyasaponins and soyasapogenol B [J].The FASEB Journal, 2011, 25: 980.6.
[10]Connor M R, Atsumi S.Synthetic biology guides biofuel production [J].Journal of Biomedicine and Biotechnology, 2010, 2010: 541698.
[11]Baez A, Cho K M, Liao J C.High-flux isobutanol production using engineered Escherichia coli: a bioreactor study with in situ product removal [J].Applied Microbiology and Biotechnology, 2011, 90(5): 1681-1690.
[12]Shen C R, Lan E I, Dekishima Y, Baez A, Cho K M, Liao J C.Driving forces enable high-titer anaerobic 1-butanol synthesis in Escherichia coli [J].Applied Environmental Microbiology, 2011, 77(9): 2905-2915.
[13]Shi A, Zhu X, Lu J, Zhang X, Ma Y.Activating transhydrogenase and NAD kinase in combination for improving isobutanol production [J].Metabolic Engineering, 2013, 16: 1-10.
[14]Steen E J, Kang Y S, Bokinsky G, Hu Z H, Schirmer A, Mcclure A, Del Cardayre S B, Keasling J D.Microbial production of fatty-acid-derived fuels and chemicals from plant biomass [J].Nature, 2010, 463(7280): 559-U182.
[15]Dai Z B, Wang B B, Liu Y, Shi M Y, Wang D, Zhang X N, Liu T, Huang L Q, Zhang X L.Producing aglycons of ginsenosides in bakers’ yeast [J].Science Reports, 2014, 4: 3698.
[16]Seki H, Sawai S, Ohyama K, Mizutani M, Ohnishi T, Sudo H, Fukushima E O, Akashi T, Aoki T, Saito K, Muranaka T.Triterpene functional genomics in licorice for identification of CYP72A154 involved in the biosynthesis of glycyrrhizin [J].Plant Cell, 2011, 23(11): 4112-4123.
[17]Seki H, Ohyama K, Sawai S, Mizutani M, Ohnishi T, Sudo H, Akashi T, Aoki T, Saito K, Muranaka T.Licorice beta-amyrin 11-oxidase, a cytochrome P450 with a key role in the biosynthesis of the triterpene sweetener glycyrrhizin [J].Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(37): 14204-14209.
[18]Yu F, Thamm A M, Reed D, Villa-Ruano N, Quesada A L, Gloria E L, Covello P, De Luca V.Functional characterization of amyrin synthase involved in ursolic acid biosynthesis in Catharanthus roseus leaf epidermis [J].Phytochemistry, 2013, 91: 122-127.
[19]Fukushima E O, Seki H, Ohyama K, Ono E, Umemoto N, Mizutani M, Saito K, Muranaka T.CYP716A subfamily members are multifunctional oxidases in triterpenoid biosynthesis [J].Plant & Cell Physiology, 2011, 52(12): 2050-2061.
[20]Ro D K, Paradise E M, Ouellet M, Fisher K J, Newman K L, Ndungu J M, Ho K A, Eachus R A, Ham T S, Kirby J, Chang M C Y, Withers S T, Shiba Y, Sarpong R, Keasling J D.Production of the antimalarial drug precursor artemisinic acid in engineered yeast [J].Nature, 2006, 440(7086): 940-943.
[21]Paddon C J, Westfall P J, Pitera D J, Benjamin K, Fisher K, Mcphee D, Leavell M D, Tai A, Main A, Eng D, Polichuk D R, Teoh H, Reed D W, Treynor T, Lenihan J, Fleck M, Bajad S, Dang G, Dengrove D, Diola D, Dorin G, Ellens K W, Fickes S, Galazzo J, Gaucher S P, Geistlinger T, Henry R, Hepp M, Horning T, Iqbal T, Jiang H, Kizer L, Lieu B, Melis D, Moss N, Regentin R, Secrest S, Tsuruta H, Vazquez R, Westblade L F, Xu L, Yu M, Zhang Y, Zhao L, Lievense J, Covello P S, Keasling J D, Reiling K K, Renninger N S, Newman J D.High-level semi-synthetic production of the potent antimalarial artemisinin [J].Nature, 2013, 496(7446): 528-532.
[22]Ajikumar P K, Xiao W H, Tyo K E J, Wang Y, Simeon F, Leonard E, Mucha O, Phon T H, Pfeifer B, Stephanopoulos G.Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli [J].Science, 2010, 330(6000): 70-74.
[23]Noskov V N, Karas B J, Young L, Chuang R Y, Gibson D G, Lin Y C, Stam J, Yonemoto I T, Suzuki Y, Andrews-Pfannkoch C, Glass J I, Smith H O, Hutchison C A, Venter J C, Weyman P D.Assembly of large, high G plus C bacterial DNA fragments in yeast [J].ACS Synthetic Biology, 2012, 1(7): 267-273.
[24]Wingler L M, Cornish V W.Reiterative recombination for the in vivo assembly of libraries of multigene pathways [J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(37): 15135-15140.
[25]Jakounas T, Sonde I, Herrgard M, Harrison S J, Kristensen M, Pedersen L E, Jensen M K, Keasling J D.Multiplex metabolic pathway engineering using CRISPR/Cas9 in Saccharomyces cerevisiae [J].Metabolic Engineering, 2015, 28: 213-222.
[26]Bozak K R, O’keefe D P, Christoffersen R E.Expression of a ripening-related avocado (Persea americana) cytochrome P450 inyeast [J].Plant Physiology, 1992, 100(4): 1976-1981.
[27]Siminszky B, Corbin F T, Ward E R, Fleischmann T J, Dewey R E.Expression of a soybean cytochrome P450 monooxygenase cDNA in yeast and tobacco enhances the metabolism of phenylurea herbicides [J].Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(4): 1750-1755.
[28]Schopfer C R, Kochs G, Lottspeich F, Ebel J.Molecular characterization and functional expression of dihydroxypterocarpan 6a-hydroxylase, an enzyme specific for pterocarpanoid phytoalexin biosynthesis in soybean (Glycine max L.) [J].FEBS Letters, 1998, 432(3): 182-186.
[29]Kitada C, Gong Z, Tanaka Y, Yamazaki M, Saito K.Differential expression of two cytochrome P450s involved in the biosynthesis of flavones and anthocyanins in chemo-varietal forms of Perilla frutescens [J].Plant & Cell Physiology, 2001, 42(12): 1338-1344.
[30]Mizutani M, Ohta D, Sato R.Isolation of a cDNA and a genomic clone encoding cinnamate 4-hydroxylase from Arabidopsis and its expression manner in planta [J].Plant Physiology, 1997, 113(3): 755-763.
[31]Humphreys J M, Hemm M R, Chapple C.New routes for lignin biosynthesis defined by biochemical characterization of recombinant ferulate 5-hydroxylase, a multifunctional cytochrome P450-dependent monooxygenase [J].Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(18): 10045-10050.
[32]Nair R B, Xia Q, Kartha C J, Kurylo E, Hirji R N, Datla R, Selvaraj G.Arabidopsis CYP98A3 mediating aromatic 3-hydroxylation.Developmental regulation of the gene, and expression in yeast [J].Plant Physiology, 2002, 130(1): 210-220.
[33]Schoendorf A, Rithner C D, Williams R M, Croteau R B.Molecular cloning of a cytochrome P450 taxane 10 beta-hydroxylase cDNA from Taxus and functional expression in yeast [J].Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(4): 1501-1506.
[34]Moses T, Pollier J, Faizal A, Apers S, Pieters L, Thevelein J M, Geelen D, Goossens A.Unraveling the triterpenoid saponin biosynthesis of the African shrub Maesa lanceolata [J].Molecular Plant, 2015, 8(1): 122-135.
[35]Fukushima E O, Seki H, Sawai S, Suzuki M, Ohyama K, Saito K, Muranaka T.Combinatorial biosynthesis of legume natural and rare triterpenoids in engineered yeast [J].Plant & Cell Physiology, 2013, 54(5): 740-749.
[36]Moses T, Pollier J, Almagro L, Buyst D, Van Montagu M, Pedreno M A, Martins J C, Thevelein J M, Goossens A.Combinatorial biosynthesis of sapogenins and saponins in Saccharomyces cerevisiae using a C-16alpha hydroxylase from Bupleurum falcatum [J].Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(4): 1634-1639.
[37]Renault H, Bassard J E, Hamberger B, Werck-Reichhart D.Cytochrome P450-mediated metabolic engineering: current progress and future challenges [J].Current Opinion in Plant Biology, 2014, 19: 27-34.
[38]Zheng X, Xu H, Ma X, Zhan R, Chen W.Triterpenoid saponin biosynthetic pathway profiling and candidate gene mining of the Ilex asprella root using RNA-Seq [J].International Journal of Molecular Sciences, 2014, 15(4): 5970-5987.
[39]Misra R C, Maiti P, Chanotiya C S, Shanker K, Ghosh S.Methyl jasmonate-elicited transcriptional responses and pentacyclic triterpene biosynthesis in sweet basil [J].Plant Physiology, 2014, 164(2): 1028-1044.
[40]Li Y, Luo H M, Sun C, Song J Y, Sun Y Z, Wu Q, Wang N, Yao H, Steinmetz A, Chen S L.EST analysis reveals putative genes involved in glycyrrhizin biosynthesis [J].BMC Genomics, 2010, 11: 268.
[41]Naoumkina M A, Modolo L V, Huhman D V, Urbanczyk-Wochniak E, Tang Y, Sumner L W, Dixon R A.Genomic and coexpression analyses predict multiple genes involved in triterpene saponin biosynthesis in Medicago truncatula [J].Plant Cell, 2010, 22(3): 850-866.
[42]Ramilowski J A, Sawai S, Seki H, Mochida K, Yoshida T, Sakurai T, Muranaka T, Saito K, Daub C O.Glycyrrhiza uralensis transcriptome landscape and study of phytochemicals [J].Plant & Cell Physiology, 2013, 54(5): 697-710.
[43]Pollier J, Morreel K, Geelen D, Goossens A.Metabolite profiling of triterpene saponins in Medicago truncatula hairy roots by liquid chromatography Fourier transform ion cyclotron resonance mass spectrometry [J].Journal of Natural Products, 2011, 74(6): 1462-1476.
[44]Jensen K, Moller B L.Plant NADPH-cytochrome P450 oxidoreductases [J].Phytochemistry, 2010, 71(2/3): 132-141.
[45]Caspeta L, Chen Y, Ghiaci P, Feizi A, Buskov S, Hallstrom B M, Petranovic D, Nielsen J.Biofuels: altered sterol composition renders yeast thermotolerant [J].Science, 2014, 346(6205): 75-78.
[46]Stukkens Y, Bultreys A, Grec S, Trombik T, Vanham D, Boutry M.NpPDR1, a pleiotropic drug resistance-type ATP-binding cassette transporter from Nicotiana plumbaginifolia, plays a major role in plant pathogen defense [J].Plant Physiology, 2005, 139(1): 341-352.
