荧光光谱及分子模拟研究β-榄香烯与牛血清白蛋白的相互作用
2015-08-18刘艳菊李晓飞鲁利娜
刘艳菊,李晓飞,凡 杭,鲁利娜
荧光光谱及分子模拟研究β-榄香烯与牛血清白蛋白的相互作用
刘艳菊,李晓飞,凡杭,鲁利娜
(河南中医学院药学院,河南郑州450046)
在模拟生理pH条件(pH=7.40)下,用荧光光谱和分子模拟法研究β-榄香烯与牛血清白蛋白(BSA)的相互作用。在308K和318K温度下,激发波长(λex)为280nm,测定BSA在340nm的内源性荧光强度随着β-榄香烯浓度增加的变化,用分子对接方法研究β-榄香烯与牛血清白蛋白(BSA)的相互作用。β-榄香烯与牛血清白蛋白的反应机制为静态猝灭,作用力类型为疏水作用。分子模拟结果表明:β-榄香烯与牛血清白蛋白亚结构域A结合,二者之间有疏水作用和静电作用,且以疏水作用为主,这与荧光光谱结果一致。β-榄香烯与BSA具有较强的相互作用,以血清白蛋白为载体,β-榄香烯作为药物可通过血液循环到达病变部位,发挥药效。
β-榄香烯;牛血清白蛋白;荧光光谱;分子模拟
doi:10.11857/j.issn.1674-5124.2015.09.012
0 引言
β-榄香烯是从中药莪术中提取的一种抗肿瘤有效成分[1],是只含C,H两种元素的倍半萜烯[2]。其乳剂作为国家二类非细胞毒性抗肿瘤新药已广泛用于临床[3],其细胞毒性及不良反应均小于一般的化疗药物,对肝、肾功能无损害,无骨髓抑制,具有抑制肿瘤细胞和提高免疫功能的双重疗效。研究还发现β-榄香烯对已耐药的肿瘤细胞仍敏感,不易产生耐药性,是一种广谱、高效、副作用少的抗肿瘤药物。因其具有增强免疫、抗耐药、放化疗协同等特点,与其他抗肿瘤药物相比具有独特的优势[4]。
血清白蛋白是血浆中最丰富的可溶性蛋白,它产生于动物的肝脏并且保持动物血液的渗透压平衡,对许多内源性和外源性的药物都具有很高的亲和力,研究中药活性成分与白蛋白的相互作用,对阐述中药活性成分的药代动力学机制有着重要作用[5]。血清白蛋白是药物发挥药效的重要载体和靶点[6],药物进入血浆后,首先与血清白蛋白结合,然后再被运送到身体各部位发挥药效。因此,药物与血清白蛋白结合程度直接影响药物在生物体内的分布、贮存、转运、药效、药物代谢以及毒副作用等方面的性质[7]。研究药物小分子与血浆白蛋白之间相互作用不仅有助于从分子水平阐明药物的作用机理,而且对抗肿瘤药物的体外筛选具有重要意义,同时也为药物设计提供了理论指导[8]。
本文利用荧光光谱法研究了β-榄香烯在生理条件下与牛血清白蛋白的相互作用,探讨相互作用机理,以及对蛋白构象的影响,求出了结合常数和结合位点数;并利用分子模拟研究了β-榄香烯与牛血清白蛋白的作用力类型,结果表明二者之间有疏水作用和静电作用,且以疏水作用为主,这与荧光光谱结果一致,为探明β-榄香烯在体内的作用机制提供了理论依据。
1 实验部分
1.1仪器与试剂
F-4500型荧光分光光度计(日本岛津);PHS-3C型酸度计(上海伟业仪器有限公司);BSA224S-CW型电子天平(赛多利斯科学仪表有限公司,中国);DF-101S型集热式恒温加热磁力搅拌器。
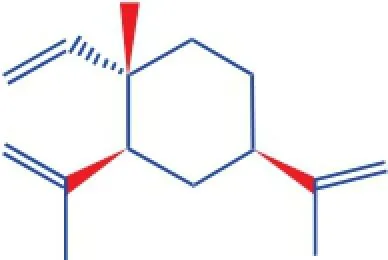
图1 β-榄香烯的结构

图2 308K和318K时BSA荧光强度随β-榄香烯浓度的变化图
1.0×10-5mol/L牛血清白蛋白溶液(BSA,北京奥克星生物技术有限公司,相对分子量65000);1.0× 10-4mol/Lβ-榄香烯溶液(标准品,99.2%,中国药品生物制品鉴定所,图1为β-榄香烯分子结构);含0.1mol/L NaCl的Tris-HCl缓冲溶液,pH=7.40(Tris,BR,≥99.0%,国药集团化学试剂有限公司);其他试剂均为分析纯,实验用水均为二次去离子水。
1.2实验方法
用25mL移液管准确移取13.5mL Tris-HCl缓冲溶液于100mL烧杯中,用微量进样器向其中加入BSA标准溶液1.5mL,混合均匀,然后用微量进样器向其中依次加β-榄香烯(0~1.0×10-4mol/L),混合均匀,置于实验温度下(308,318K)),恒温5min,在激发波长为280nm,激发和发射狭缝均为5.0nm的条件下,测定BSA的荧光光谱及固定Δλ值的同步荧光光谱随着β-榄香烯量增加的变化。
2 结果与讨论
2.1β-榄香烯对BSA的荧光猝灭作用
BSA分子内因含有色氨酸、酪氨酸等氨基酸残基而发射较强的内源性荧光,图2给出了在保持BSA浓度不变,308K和318K温度下,激发波长(λex)为280nm条件下,BSA内源性荧光强度随着β-榄香烯浓度增加的变化情况。此时荧光发射主要来自BSA色氨酸残基,最大发射波长(λem)为340nm,且随着β-榄香烯物质量浓度的增加,来自BSA色氨酸残基的荧光强度逐渐减弱(见图2小图),表明BSA色氨酸残基的荧光能有效地被β-榄香烯猝灭;但最大发射峰的位置及发射光谱的形状基本不变[9],说明β-榄香烯与BSA之间形成了荧光较弱或者无荧光的复合物而造成BSA内源性荧光被猝灭。
2.2β-榄香烯对BSA荧光猝灭机理
荧光猝灭根据其发生原因可分为静态猝灭和动态猝灭。静态猝灭是猝灭剂分子与荧光物质分子在基态时生成不发射荧光或荧光较小的复合物,从而导致荧光降低;动态猝灭是猝灭剂分子与荧光物质的激发态分子之间相互碰撞而导致的荧光猝灭。动态猝灭遵循Stern-volmer方程[10]:

式中:Kq——双分子猝灭过程速率常数;
Ksv——Stern-volmer方程的猝灭常数;
τ0——没有猝灭剂存在下生物大分子平均寿命,生物大分子荧光寿命约为10-8s[11];
F0、F——未加入和加入猝灭剂时BSA的荧光强度;
[Q]——猝灭剂β-榄香烯的物质量浓度。
本文研究了308K和318K下的BSA与β-榄香烯相互作用的荧光光谱,利用不同温度下的实验结果,以F0/F对β-榄香烯的物质量浓度作图,结果如图3所示。

图3 308K和318K时β-榄香烯对BSA的Stern-volmer方程
由图3及式(1)得出不同温度下β-榄香烯与BSA相互作用的猝灭常数及猝灭速率常数,如表1所示。

表1 β-榄香烯与BSA不同温度下相互作用的常数
由表1及图3可知,对Stern-volmer猝灭方程线性拟合,得到308K和318K时对应的Stern-volmer猝灭常数分别为1.28×105L/mol和1.24×105L/mol;再由Ksv=Kqτ0,可求得猝灭过程的速率常数Kq分别为1.28×1013L/(mol·s),1.24×1013L/(mol·s)。两个温度下猝灭过程的速率常数的数量级都在1013,而各类猝灭剂对生物大分子的最大动态猝灭速率常数约为2.0×1010L/(mol·s),β-榄香烯对BSA的荧光猝灭速率远远大于最大扩散碰撞猝灭速率。由此判断β-榄香烯对BSA的相互作用是因形成复合物而引起BSA内源性荧光猝灭,属于静态猝灭[12]。
2.3β-榄香烯与BSA作用的结合常数Kb及结合位点数n
在静态猝灭中,结合常数和结合位点数可以通过双对数公式求出,当小分子与大分子结合时,其表观结合常数Kb与结合位点数n可由式(2)[13]求出。

做lg[(F0-F)/F]对lg[Q]的图(见图4),根据截距和斜率求得β-榄香烯与BSA作用的结合常数Kb和结合位点数n,所得结果列于表2。

表2 β-榄香烯与BSA相互作用的结合常数及结合位点数
从表中数据可知,β-榄香烯与BSA的结合常数Kb较大,并能形成一个结合位点,并且随着温度的升高,结合常数亦有明显增加,说明β-榄香烯与白蛋白的结合能力受温度影响较大。结果表明β-榄香烯与BSA具有较强的相互作用,以血清白蛋白为载体,β-榄香烯作为药物可通过血液循环到达病变部位,从而发挥药效,达到治病的目的。
2.4β-榄香烯与BSA相互作用的热力学性质及作用力类型
中药活性成分与血清白蛋白的分子间作用力包括氢键、范德华力、疏水作用力、静电引力等。不同药物与白蛋白的结合力类型也不同,药物与白蛋白之间的作用力类型的确定可根据二者作用前后焓变Δ r H m和熵变Δ r S m来判断,当温度变化不大时,反应的焓变Δ r H m可认为是常数。

由热力学式(3)~式(5)及实验结果可求得β-榄香烯与BSA作用的热力学参数,结果如表3所示。

表3 不同温度下β-榄香烯对BSA的热力学常数
一定条件下,药物与白蛋白的结合反应是否能自发进行与体系的吉布斯自由能有关,吉布斯自由能为负值时,反应能够自发进行。这种自发过程可分为熵驱动和焓驱动。熵焓的大小与作用力类型之间的关系如下:ΔS>0可能是疏水和静电作用力;ΔS<0可能为氢键和范德华力;当Δ H >0 且Δ S >0时,为疏水作用力;当Δ H <0 且Δ S <0时,为氢键或范德华力;当Δ H ≈0 ,Δ S >0时,作用力为静电引力;Δ H <0时,主要为静电作用力[8]。由表3的数据可知,β-榄香烯与B S A作用的热力学常数为Δ r H m >0 、Δ r S m >0,根据药物与B S A作用的热力学规律,β-榄香烯和B S A之间存在较强的疏水作用力。由于Δ r G m <0,表明β-榄香烯与B S A的相互作用过程是自发的[14]。

图4 308K和318K时β-榄香烯对BSA的双对数图
2.5β-榄香烯对BSA构象的影响
BSA分子中因含有色氨酸、酪氨酸及苯丙氨酸等残基而发射较强的内源性荧光,其中色氨酸和酪氨酸的荧光强度比较大,且二者的激发光谱相似,发射光谱严重重叠,利用同步荧光光谱选择合适的Δλ可以达到简化光谱、窄化谱带和减少光谱重叠的目的。通常情况下,Δλ=60nm的同步荧光光谱只显示色氨酸的特征光谱,Δλ=15nm的同步光谱只显示酪氨酸的特征光谱。根据同步荧光光谱发射波长的变化可以推测β-榄香烯的加入对BSA色氨酸和酪氨酸微环境产生的影响,进而可以判断蛋白质构象的变化。
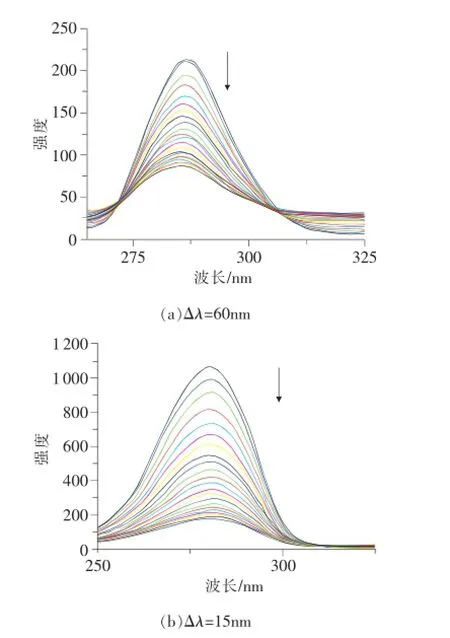
图5 308K时β-榄香烯与BSA的同步荧光光谱
图5为308K时,β-榄香烯与BSA相互作用的同步荧光光谱。蛋白质中酪氨酸和色氨酸残基的最大发射波长与其所处环境的极性有关,因此,根据最大发射波长的改变可以判断蛋白质构象的变化。随着β-榄香烯浓度的增加,酪氨酸和色氨酸残基的同步荧光光谱强度明显降低。酪氨酸残基的最大发射波长稍有蓝移,而色氨酸残基的最大发射波长基本不变,表明酪氨酸残基所处环境的疏水性增加,β-榄香烯的加入引起了BSA构象的变化,其原因可能是β-榄香烯嵌插BSA分子内部引起的[15]。
2.6β-榄香烯与BSA的分子模拟研究
BSA是由582个氨基酸残基组成的单肽链蛋白质。每个结构域均含有A、B两个亚结构域[16]。在亚结构域A中存在一个很大的疏水腔,绝大部分药物小分子都与该亚结构域结合。分子对接结果表明,β-榄香烯位于Leu218、Phe22、Leu233、Ile263、Ala260、Leu259、Ile289等氨基酸围成的疏水空腔中,说明β-榄香烯与BSA间存在明显的疏水作用,从而使BSA内在荧光强度降低。BSA与β-榄香烯分子间除存在疏水作用力外,还可能存在静电作用力,β-榄香烯的C=C双键所处的位置附近有Ser286、His241等极性氨基酸。所以β-榄香烯与BSA的相互作用可能主要有疏水作用、静电作用,且以疏水作用为主。血清白蛋白的结构很复杂,它和药物之间往往存在几种作用力类型,分子模拟的研究结果显示有静电作用的存在,是对热力学实验结果的一个有效补充,二者并不矛盾。
对接实验同时给出了在298 K时二者相互作用的结合自由能ΔrG m为26.04 kJ/mol,根据表3可以计算出298 K时自由能ΔrG m的实验值为25.86 kJ/mol,计算值和实验值非常接近,表明分子对接结果较为可靠。
3 结束语
本文采用荧光光谱和分子模拟研究了β-榄香烯对BSA的相互作用,通过实验结果求出猝灭速率常数、结合常数、结合位点数、热力学参数等,揭示了β-榄香烯对BSA的猝灭机理、结合方式以及β-榄香烯对BSA构象的影响,实验和分子模拟得出β-榄香烯与BSA的作用力类型。
β-榄香烯对BSA的内源性荧光进行猝灭,其猝灭机理为静态猝灭,β-榄香烯与BSA之间的相互作用为自发过程,且结合作用较强。β-榄香烯与蛋白质结合于亚结构域A中,疏水作用为主要作用力,但同时存在静电作用。β-榄香烯与BSA的结合改变了BSA的分子构象。
在分子水平上了解药物在体内的运输和分布情况,并在阐明β-榄香烯与BSA的作用机制方面具有重要的指导意义,为β-榄香烯作为抗肿瘤药物作用机理的研究提供了理论基础。
[1]郭建忠,沈建康,周洪语.榄香烯抗肿瘤作用基础研究进展[J].中国肿瘤临床,2003(30):752-754.
[2]任云峰,成康民,刘贵锋,等.β-榄香烯三羰基铼配合物的合成、放射化学合成及抗癌活性研究[J].化学学报,2008(66):459-464.
[3]Chen W X,,Lu Y,Wu JM,et al.Beta-elemene inhibits melanoma growth and metastasis via suppressing vascular endothelial growth factor-mediated angiogenesis,Cancer Chemotherapy and Pharmacology[J].2011(67):799-808.
[4]姚崇舜.天然药物温莪术[M].北京:人民卫生出版社,2008:72-90.
[5]李娜,魏永巨.药物分子与血清白蛋白结合反应的荧光法研究进展[J].河北师范大学学报,2003(27):196-179.
[6]张建刚,卫艳丽,张丽,等.氨基黑10B与牛血清白蛋白作用的光谱法研究[J].分子科学学报,2011(27):170-174.
[7]王芳,裴明砚,唐乾,等.荧光光谱法研究药物与血清白蛋白相互作用概述[J].大连大学学报,2009(3):39-43.
[8]李悦,谷雨,何佳,等.光谱法与分子模拟技术研究杨梅素与牛血清白蛋白的相互作用[J].化学学报,2012(70):143-150.
[9]何文英,陈光英,杜娟,等.光谱法与分子模拟研究胡椒碱对牛血清白蛋白的键合作用[J].化学学报,2008(66):2365-2370.
[10]Yang H,Wang Y W,Tang L F,et al.Binding of puerarin to human serum albumin:A spectroscopic analysis and molecular docking[J].Biochim Biophys Acta,2005(1721):164-173.
[11]Bi S Y,Sun Y T,Qiao C Y,et al,Binding of several anti-tumor drugs to bovine serum albumin:fluorescence study[J].J Luminescence,2009(129):541-547.
[12]Zhang H X,Gao S,Xiong Z J,et al.Fluorometric probing on the binding of hematoxylin to serum albumin[J]. Mol Biol Rep,2009(36):2299-2306.
[13]张方圆,倪永年.日落黄和β-胡萝卜素与牛血清白蛋白相互作用的对比研究[J].化学学报,2012(70):1379-1384.
[14]王玲,赵东旺,訾丽娟,等.阿魏酸与血清蛋白相互作用研究[J].河南师范大学报,2012(40):87-90.
[15]郭兴家,徐淑坤,佟健,等.荧光法研究原卟啉IX和牛血清白蛋白的相互作用[J].分析化学,2006(34):1668-1672.
[16]Sulkowska A,Rownicka J,Bojko B,et al.Interation of anticancer drugs with human and bovine serum albumin[J].JMol Struct,2003(133):651-653.
Study on interaction betweenβ-elemene and bovine serum album in by fluorescence spectroscopy and molecular modeling
LIU Yanju,LI Xiaofei,FAN Hang,LU Lina
(Pharmacy College,Henan University of Traditional Chinese Medicine,Zhengzhou 450046,China)
The interaction betweenβ-elemene and bovine serum albumin is studied by fluorescence spectroscopy and molecular modeling under the simulative human physiological condition(pH=7.40). At different temperatures(308K and 318 K),excitation wavelength(λex)is set as 280 nm to detect the variation of the bovine serum albumin(BSA)in 340 nm endogenous fluorescent intensity whenβ-elemene is added.Then,the interaction between theβ-elemene and BSA is analyzed by molecular modeling.The reaction mechanism of the two substances is static quenching,and the binding force thereof is hydrophobic interaction.The molecular modeling indicates that theβ-elemene is bonded with the subdomain A of bovine serum albumin through hydrophobic and electrostatic interactions,and the hydrophobic interaction is the predominant intermolecular force.This complies with the results acquired by fluorescence spectroscopy.Theβelemene and BSA are highly interacted;the former when made into medicines can be sent along with bloodstream to the pathogenic areas through the serum albumin of the latter as a carrier.
β-elemene;BSA;fluorescence spectroscopy;molecularmodeling
A
1674-5124(2015)09-0051-05
2015-01-14;
2015-03-07
河南省高等学校青年骨干教师资助项目(2012GGJS-091);河南中医学院科技创新人才支持计划(2014XCXRC04);河南省教育厅科学技术研究重点项目(12B150014);河南省科技厅技术攻关重点项目(102102310321)
刘艳菊(1979-),女,河南周口市人,副教授,博士,主要从事药物活性单元构筑的功能配合物研究。
