1型糖尿病大鼠模型早期胃平滑肌功能的改变研究
2015-08-16郝璋森梁红玉侯聪聪佟苗苗蒋建东
郝璋森,梁红玉,侯聪聪,佟苗苗,刘 帅,蒋建东,赵 丁,,4
(1.河北医科大学药学院,石家庄 050017;2.中国医学科学院/北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;3.石家庄市第四医院药剂科,石家庄 050000;4.河北医科大学中西医结合研究所,石家庄 050017)
1型糖尿病大鼠模型早期胃平滑肌功能的改变研究
郝璋森1,3,梁红玉1,侯聪聪1,佟苗苗1,刘 帅1,蒋建东2,赵 丁1,2,4
(1.河北医科大学药学院,石家庄 050017;2.中国医学科学院/北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;3.石家庄市第四医院药剂科,石家庄 050000;4.河北医科大学中西医结合研究所,石家庄 050017)
目的探讨1型糖尿病(type 1 diabetes mellitus)早期大鼠离体胃平滑肌收缩、舒张反应的改变。方法雄性SD大鼠,腹腔注射65mg/kg链脲佐菌素(STZ)溶液诱导1型糖尿病大鼠模型。采用离体器官肌张力分析方法,以电场刺激及激动剂诱发胃各部位平滑肌收缩、舒张反应,观察糖尿病早期大鼠离体胃平滑肌功能的改变。结果(1)电场刺激诱发1型糖尿病大鼠胃底平滑肌收缩反应小于正常大鼠(P<0.05),且收缩幅度紊乱,参差不齐;(2)正常大鼠及1型糖尿病大鼠胃体平滑肌收缩反应、胃窦自发收缩活动均无明显改变;(3)与正常大鼠相比,电场刺激诱发1型糖尿病大鼠胃底平滑肌舒张反应明显增加,而幽门环形肌收缩反应明显增加(P<0.01)。结论STZ造模4周的1型糖尿病大鼠胃平滑肌收缩舒张功能的变化中,胃各部位敏感性不同;胃底平滑肌收缩反应明显减小且紊乱,舒张反应明显增强;幽门环形肌舒张反应明显减小。提示在1型糖尿病早期大鼠胃平滑肌功能改变中,胃底和幽门可能最先发生病变,且主要源自神经调节的改变。
糖尿病;胃平滑肌;电场刺激;神经损伤;大鼠
糖尿病性胃轻瘫(diabetic gastroparesis,DGP)是糖尿病的常见并发症,病情隐匿,表现复杂,容易被忽视。调查显示DGP在糖尿病患者的发病率超过50%[1],其发病原因尚不完全清楚,主要涉及迷走神经功能紊乱、胃平滑肌形态学和微血管病变、高血糖和胃肠激素失调等[2-3]。胃肠运动的神经调节十分复杂,目前多认为,支配胃肠系统肌肉运动的兴奋性神经元递质主要为乙酰胆碱[4-5],抑制性运动神经元递质主要为一氧化氮(NO)、血管活性肠肽(VIP)及ATP[5-6]。长期以来,胃迷走神经损伤被认为在DGP的发病中起重要作用[7]。但是,在糖尿病早期支配胃平滑肌运动的兴奋性和抑制性神经功能如何改变,胃不同部位的神经和平滑肌活动受损情况是否同步等问题尚不甚明了。STZ模型大鼠作为研究人类糖尿病胃轻瘫的重要动物模型,以造模8周、12周或更长时间的研究报道为多,且结果多样,对糖尿病早期胃部病变的研究很少有报道。特别是,在重视早期预防,治未病的大环境下,研究早期糖尿病大鼠胃部病变发生特点和规律,了解实验动物与人类相关的差异性,为更好的利用模型动物研究疾病,探索预防和治疗DGP的新靶点和新思路提供实验依据。
本研究采用STZ诱导的糖尿病大鼠模型,调查1型糖尿病早期(4周)大鼠胃平滑肌收缩、舒张活动,探索神经调节或激动剂诱发收缩、舒张功能的改变情况,以及不同部位胃平滑肌功能损伤的差异。
1 材料和方法
1.1 药品及试剂
卡巴胆碱(CCh)购自ABCR GmbH&Co.KG公司;链脲佐菌素(streptozotocin,STZ)、硝普钠(SNP)、P物质(SP)、阿托品(Atr)、河豚毒素(TTX)和三磷酸腺苷(ATP)均购自Sigma公司。
1.2 动物模型的建立及标本制作
SD雄性大鼠(河北省实验动物中心提供,【SCXK(冀)2013-1003】,鼠龄6~8周,体重200~220g。用0.1mol/L枸橼酸钠缓冲液(pH4.5)将STZ配成1%的溶液,按65mg/kg体重单次腹腔注射给药(注射前禁食12h)[8],72h后尾静脉采血,用雅培血糖仪测定空腹血糖,大鼠血糖值≥300mg/dl(16.7mmol/L)说明模型成功[9],用于实验。正常大鼠及糖尿病大鼠在处死前称量体重,取尾静脉血测定血糖水平。按照文献所述[10-11],制作8mm×2mm胃底环、纵平滑肌,胃体环形肌,胃窦环、纵平滑肌和幽门环形肌标本。将肌条固定在盛有37℃K-H液[12]的10mL浴槽中,并持续通以95%O2和5%CO2混合气体。标本给予1g的前负荷,每15min换一次K-H液,平衡1h待标本活动平稳后开始实验。进行电场刺激实验的标本,实验结束前加入0.1μmol/LTTX,30min后给予电场刺激,考察电场刺激诱发的反应是否为神经源性反应。
1.3 大鼠胃平滑肌收缩反应的改变
1.3.1 胃底平滑肌收缩反应
电场刺激(电压50V,频率20Hz,波宽1ms,刺激时程10s,间隔100s)胃底平滑肌标本[13],记录张力变化,观察1μmol/LAtr对大鼠胃底平滑肌收缩反应的影响;采用累积给药法,观察CCh(0.01~30μmol/L)、KCl(1~80mmol/L)对大鼠胃底环形肌的收缩作用。
1.3.2 胃体环形肌收缩反应
电场刺激胃体环形肌标本,记录张力变化。刺激条件同胃底平滑肌。
1.3.3 胃窦平滑肌自发收缩活动
胃窦环、纵形平滑肌标本平衡1h,待稳定的自发性收缩出现后记录收缩活动。
1.4 大鼠胃平滑肌舒张反应的改变
1.4.1 胃底环形肌舒张反应
胃底环形肌标本给予0.3μmol/L CCh或0.1μmol/L SP引起收缩,待收缩反应达到平台期后进行电场刺激(电压50V,频率1、2、4、10Hz,波宽1ms,刺激时程10s,间隔100s)[14],观察记录电场刺激诱发舒张反应的情况。SP预收缩标本的实验在营养液中存在1μmol/LAtr条件下进行。
另取标本,给予0.3 μmol/LCCh引起收缩,待收缩反应稳定后,采用非累积给药法在浴槽中加入SNP(0.01、0.03、0.1、0.3、1、3、10μmol/L)或ATP(0.1、1、10、100、1000μmol/L),观察记录SNP或ATP诱发大鼠胃底环形肌舒张反应的情况。
1.4.2 幽门环形肌舒张反应
在静息张力下刺激幽门环形肌标本,刺激条件同胃底环形肌,观察记录电场刺激诱发舒张反应的情况。
1.5 统计学分析方法
实验数据以mean±SE表示,采用GraphPad Prism4.0软件进行数据统计分析和作图。电场刺激诱发的大鼠胃平滑肌收缩反应以每10个收缩反应的平均值(g)表示。两条量效曲线之间的统计学分析,首先采用双因素方差分析,当P<0.05时,进一步采用Bonferroni’s test比较两对应点间(同一药物浓度或刺激频率)的差异。两组数据之间的比较采用Student t-test。P<0.05为差异有统计学意义。
2 结果
2.1 糖尿病大鼠体重和血糖水平变化及胃组织外观改变
STZ(65mg/kg)腹腔注射诱导的糖尿病模型成功率为88%。与同周龄正常大鼠相比,糖尿病大鼠体重明显降低(表1);血糖水平明显升高(表2)。
与对照组相比,糖尿病大鼠胃明显增大,胃底增大尤其明显且瘫软无力,颜色发白。
2.2 大鼠胃平滑肌收缩反应的改变
胃底 电场刺激诱发糖尿病大鼠胃底环形肌收缩反应显著小于正常大鼠(降低约24.4%,P<0.05,图1),且收缩幅度明显紊乱,参差不齐(图2)。CCh(0.01~30μmol/L)、KCl(1~80mmol/L)诱发正常大鼠和糖尿病大鼠胃底环形肌产生浓度依赖性收缩反应,糖尿病大鼠与正常大鼠无显著差异(P>0.05,图3)。
电场刺激诱发糖尿病大鼠胃底纵形肌收缩反应显著小于正常大鼠(降低约20.3%,P<0.01,图2),且收缩明显紊乱,参差不齐;收缩幅度大于胃底环形肌标本,约为环形肌的120.5%(图2)。
与胃底环形肌相比,电场刺激正常大鼠胃底纵形肌标本,收缩幅度大于胃底环形肌,约为环形肌的110.6%(图2)。
胃体 电场刺激正常大鼠及糖尿病大鼠胃体环形肌,收缩幅度参差不齐,无法诱发稳定的收缩反应,且正常大鼠及糖尿病大鼠之间无显著性差异(图4A,B)。
电场刺激诱发的胃平滑肌收缩反应均能被1μmol/LAtr或0.1μmol/L TTX完全阻断。
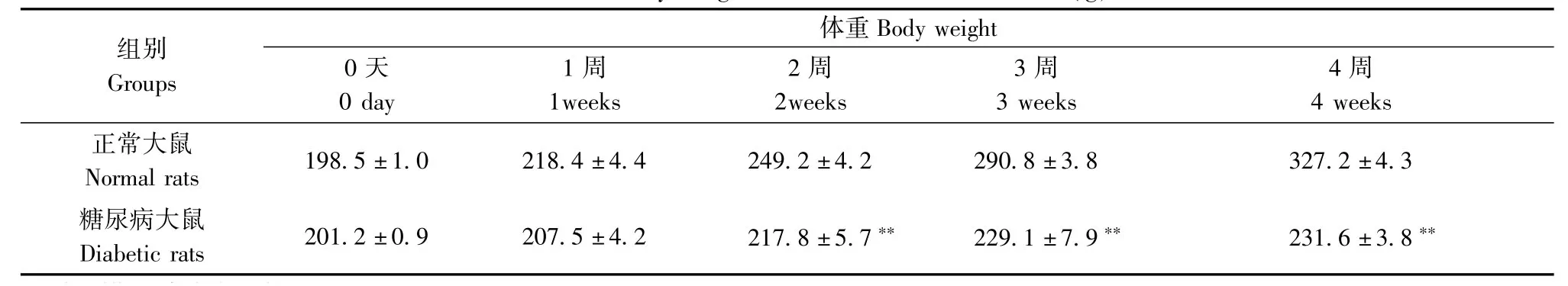
表1 正常大鼠和糖尿病大鼠体重的比较(g)Tab.1 The body weight in normal and diabetic rats(g)
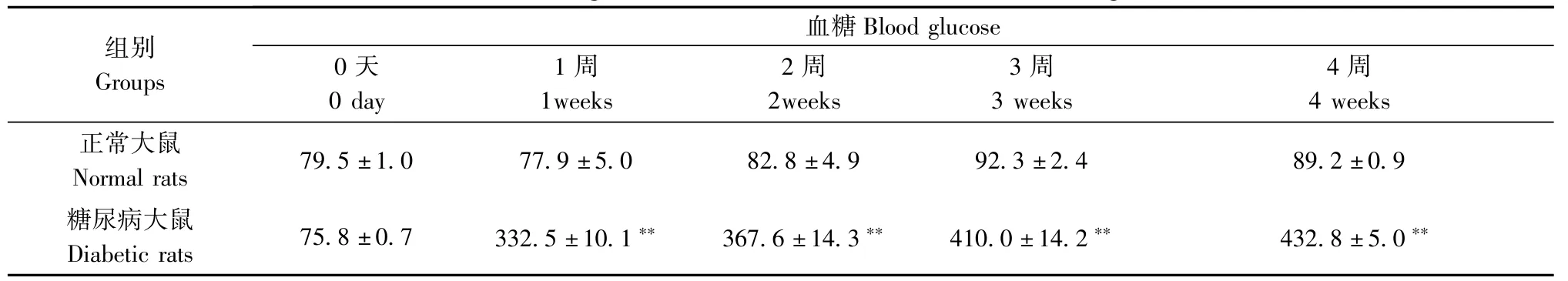
表2 正常大鼠和糖尿病大鼠血糖值(mg·dl-1)Tab.2 The blood glucose values in normal and diabetic rats(mg·dl-1)
胃窦 在静息张力下,正常大鼠及糖尿病大鼠胃窦环、纵形肌标本均可出现稳定的自发收缩活动,胃窦环形肌标本收缩频率分别为3.3±0.5、3.4 ±0.4次/分,纵形肌标本分别为2.7±0.3、2.8±0.3次/分。正常大鼠及糖尿病大鼠胃窦平滑肌自发收缩反应无显著性差异(图4C,D)。

注:与正常大鼠比,*P<0.05,**P<0.01;n=8。图1 电场刺激诱发大鼠胃底环形肌收缩反应Note:*P<0.05,**P<0.01 vs normal,n=8.Fig.1 Contractile responses to EFS in the isolated circular muscle strips of gastric fundus
2.3 大鼠胃平滑肌舒张反应的改变
胃底 应用0.3μmol/LCCh及0.1μmol/LSP预收缩标本时,糖尿病大鼠胃底环形肌舒张反应显著大于正常大鼠(CCh:1Hz时是正常大鼠的182.7%,P<0.01,图5A;SP:1Hz时是正常大鼠的181.9%,P<0.01,图5B)。SNP(0.01~10μmol/L)、ATP(0.1~1000μmol/L)使正常大鼠和糖尿病大鼠胃底环形肌产生浓度依赖性舒张反应,糖尿病大鼠与正常大鼠无明显差异(P>0.05,图6)。
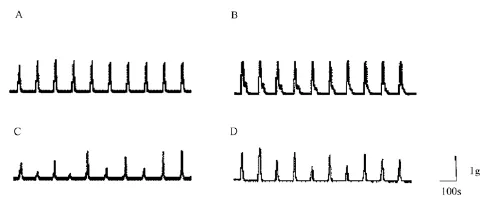
图2 电场刺激诱发正常(A,B)及糖尿病(C,D)大鼠胃底环形肌(A,C)及纵形肌(B,D)收缩反应Fig.2 Original traces showing the contraction in isolated circular(A and C)and longitudinal(B and D)muscle strips of gastric fundus from both normal(A and B)and diabetic(C and D)rats
糖尿病大鼠胃底纵形肌舒张反应显著大于正常大鼠(1Hz时是正常大鼠的163.5%,P<0.01),胃底纵形肌舒张反应小于胃底环形肌标本,约为胃底环形肌标本的90.7%(电场刺激正常大鼠胃底纵形肌,舒张反应约为胃底环形肌标本的95.1%)。
幽门 糖尿病大鼠幽门环形肌舒张反应显著小于正常大鼠(1Hz时较正常大鼠降低约29.2%,P<0.01,图7)。
电场刺激诱发的胃底平滑肌和胃窦环形肌舒张反应均能被0.1μmol/LTTX完全阻断。
3 讨论
根据胃运动的功能特点,将胃分为近端胃和远端胃[15]。近端胃包括胃底和胃体上部,以张力性收缩活动为主,调节胃内压力,主要起容受食物的作用。远端胃包括胃体下部和胃窦,以蠕动性收缩活动为特点,主要起胃泵的作用。有文献报道[16],引起糖尿病性胃轻瘫胃排空延缓的动力障碍机制包括胃电节律紊乱,胃体紧张性下降,胃窦收缩推进力减弱,幽门异常紧缩,以及胃窦-十二指肠运动失调等。
本研究采用STZ造模4周的1型糖尿病大鼠进行实验。4周内,1型糖尿病大鼠的血糖水平明显升高,并维持在约24mmol/L水平;体重显著下降。在STZ造模4周的1型糖尿病大鼠胃平滑肌实验中,电场刺激诱发的胃平滑肌收缩、舒张反应均能被0.1μmol/L TTX完全取消,表明所观察到的收缩舒张反应均为神经源性反应。Atr完全取消了电场刺激诱发的胃平滑肌收缩反应,表明引起收缩的兴奋性神经递质为乙酰胆碱。实验中发现,1型糖尿病大鼠胃底环、纵形肌对电场刺激诱发的收缩反应显著小于正常大鼠,且收缩反应明显紊乱;胃体平滑肌对电场刺激诱发的收缩反应与正常大鼠相比并无差异;胃窦平滑肌自发性收缩活动与正常大鼠相比无显著差异;幽门环形肌对电场刺激诱发的舒张反应显著小于正常大鼠。研究结果提示,在1型糖尿病早期大鼠胃平滑肌功能活动,胃底和幽门可能最先出现异常。
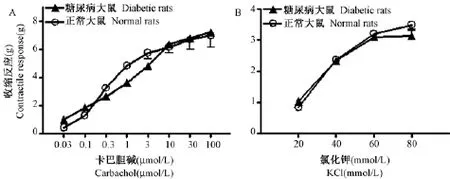
图3 卡巴胆碱(A)、KCl(B)诱发大鼠胃底环形肌收缩反应,n=8Fig.3 Contractile responses to carbachol or KCl in the isolated gastric fundus strips.n=8
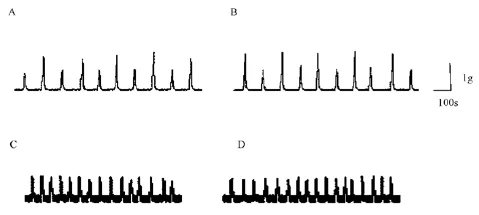
图4 电场刺激诱发正常(A,C)及糖尿病(B,D)大鼠胃体平滑肌收缩反应(A,B)及胃窦环形肌自发收缩活动(C,D)Fig.4 Original traces showing the contraction in isolated circular muscle strips of gastric body from both normal(A)and diabetic(B)rats;the contraction in isolated circular muscle strips of pylorus from both normal(C)and diabetic(D)rats

注:与正常大鼠比,**P<0.01,n=8。图5 卡巴胆碱(A)或P物质(B)预收缩后电场刺激诱发胃底环形肌舒张反应Note:**P<0.01 vs normal rats,n=8.Fig.5 Relaxant responses to EFS in the isolated circular muscle strips of gastric fundus.Strips were pre-contracted with CCh(A)orSP(B)

图6 硝普钠(SNP)、三磷酸腺苷(ATP)诱发大鼠胃底环形肌舒张反应,n=8Fig.6 Relaxant responses to SNP or ATP in the isolated circular muscle strips of gastric fundus.n=8

注:与正常大鼠比,**P<0.01,n=8。图7 电场刺激诱发大鼠幽门环形肌舒张反应Note:**P<0.01 vs normal rats.n=8.Fig.7 Relaxant responses to EFS in the isolated circular muscle strips of pylorus.
我们曾报道[17],在STZ诱导的早期糖尿病大鼠,电场刺激诱发膀胱逼尿肌收缩反应降低,与支配膀胱的胆碱能神经受损,乙酰胆碱释放减少有关。本研究结果显示,与正常大鼠相比,CCh及KCl诱发1型糖尿病大鼠胃底平滑肌收缩反应并无明显变化,但电场刺激诱发兴奋性神经递质乙酰胆碱释放的活动出现障碍,导致电场刺激产生的收缩反应降低并且紊乱。
在舒张反应的研究中,SNP或ATP诱发1型糖尿病及正常大鼠胃底环形肌舒张反应并无明显差异,而神经介导的1型糖尿病大鼠胃底环形肌舒张反应明显增强,表明1型糖尿病大鼠胃底环形肌舒张反应的异常主要来自突触前神经递质释放的改变,或许主要涉及NO和ATP。我们在实验中观察到,一氧化氮合酶抑制剂可明显降低胃底环形肌舒张反应(机制复杂,另文报道)。Karl&Julianne[18]的研究表明,STZ诱发8周的糖尿病大鼠胃底,非胆碱非肾上腺能神经诱发的舒张反应明显受损,且主要受NO调节;Burnstock等曾报道[19],在STZ诱发8周的糖尿病大鼠胃底,迷走神经的嘌呤能神经成分可能增强。舒张反应调节机制复杂,在STZ诱发糖尿病大鼠早期(4周)胃底及幽门舒张异常很可能和8周或更长时间的糖尿病模型有所不同,涉及哪些神经递质改变,如何改变,仍有待于进一步探讨。
4 结论
在利用STZ造模4周的糖尿病大鼠胃平滑肌收缩舒张反应的变化中,胃各部位敏感性不同;电场刺激胃底平滑肌收缩反应明显减小且紊乱,舒张反应明显增强;电场刺激幽门环形肌舒张反应明显减小。提示在1型糖尿病早期大鼠胃平滑肌功能改变中,胃底和幽门可能最先出现异常,且主要源自神经调节的改变。
[1]曹魏,石岩.糖胃舒对改善糖尿病胃轻瘫作用的研究[J].中医院学刊,2004,22(8):1479-1480.
[2]罗丹,刘诗.糖尿病性胃轻瘫的胃动力异常机制[J].胃肠病学,2007,12(6):372-374.
[3]雷辉.糖尿病胃轻瘫发病机制及治疗方法分析[J].中国医学创新,2014,11(1):152-153.
[4]Pfeiffer RF.Gastrointestinal dysfunction in Parkinson’s disease[J].The Lancet Neurology,2003,2:107-116.
[5]Mária Bagyánszki,Nikolett Bódi.Diabetes-related alterations in the enteric nervous system and its microenvironment[J].World Journal of Diatetes,2012,3(5):80-93.
[6]程小平,吴国泰,刘峰林.当归挥发油对实验性胃肠动力障碍的作用及机制研究[J].中药药理与临床,2011,27(4):54-56.
[7]李志芳.糖尿病病人胃肠运动障碍的研究进展[J].国外医学内科学分册,1998,25(1):5-8.
[8]Curro D,Ipavec V,Preziosi P.Neurotransmitters of the nonadrenergic non-cholinergic relaxation of proximal stomach[J].European Review for Medical and Pharmacological Sciences,2008,12(1):53-62.
[9]Belaia A,Lefebvre RA,Burnstock G.Motor activity and neurotransmitter release in the gastric fundus of streptozotocindiabetic rats[J].European Journal of Pharmacology,1991,194(3):225-234.
[10]陆英杰,连至诚,钟毅.糖尿病30周大鼠胃肌间丛神经元尼氏体的变化[J].中国糖尿病杂志,2010,18(4):303-305.
[11]周吕,柯美云主编.胃肠动力学[M].北京:科学出版社,1999.293-303.
[12]Ren LM,Burnstock G.Prominentsympathetic purinergic vasoconstriction in the rabbit splenic artery:potentiation by 2,2’-pyridylisatogen tosylate[J].British Journalof Pharmacology,1997,120(3):530-536.
[13]Salimeh A,MansoorK,Mahmood S,etal.Effectof indomethacin on electrical field stimulation-induced contractions of isolated transverse and longitudinal rat gastric fundus strips[J].World Journal of Gastroenterology,2005,11(34):5358-5361.
[14]Crystal CW,Akira S,Samie J,et al.Insulin restores neuronal nitric oxide synthase expression and function that is lost in diabetic gastropathy[J].Journal of Clinical Investigation,2000,106(3):373-384.
[15]高秀来,于恩华.人体解剖学[M].北京:北京大学医学出版社,2003.91-92.
[16]李卫东.糖尿病模型大鼠胃电异常与ENS、ICC病理损害及中药“脾胃康”作用研究[D].广东,广州中医药大学,2002.
[17]Ren LM,Zhuo YJ,Hao ZS,et al.Berberine improves neurogenic contractile response of bladder detrusor muscle in streptozotocin-induced diabetic rats[J].Journal of Ethnopharmacology,2013,150:1128-1136.
[18]Karl MJ,Julianne JR.Effect of diabetes on relaxations to nonadrenergic,noncholinergic nerve stimulation in longitudinal muscle of the rat gastric fundus[J].British Journal of Pharmacology,1995,116:1551-1556.
[19]Belai A,Lefebvre RA,Burnstock G.Motor activity and neurotransmitter release in the gastric fundus of streptozotocindiabetic rats[J].European Journal of Pharmacology,1991,194:225-234.
Alterations in the functions of gastric smooth muscle in type 1 diabetic rats
HAO Zhang-sen1,3,LIANG Hong-yu1,HOU Cong-cong1,TONG Miao-miao1,LIU Shuai1,JIANG Jian-dong2,ZHAO Ding1,2,4
(1.School of Pharmacy,Hebei Medical University,Shijiazhuang 050017,China;2.State Key Laboratory of Bioactive Substance and Function of Natural Medicines,Institute of Material Medical,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100050,China;3.Pharmacy Department,The Fourth Hospital of Shijiazhuang,Shijiazhuang 050000,China;4.Institute of Integrated Traditional and Western Medicine,Hebei Medical University,Shijiazhuang 050017,China)
ObjectiveTo investigate the alteration of contractile and relaxant responses of the isolated gastric smooth muscle in early type 1 diabetic rats.MethodsMale SD rats were administrated 65mg/kg sterptozocin(STZ)by intraperitoneal injection.Using the method of organ bath,contractile and relaxant responses were induced by electric field stimulation(EFS)and agonists on gastric smooth muscle in rats,we observe the alterations of contractile and relaxant responses of the gastric smooth muscle in early type 1 diabetic rats.Results(1)In type 1 diabetic rats,the contractile responses were decreased,and the contractile amplitudes were disordered significantly,compared with that of in normal rats(P<0.05);(2)There were no differences in the EFS-induced contractions on gastric body smooth muscle and thespontaneous contractions on gastric antrum in normal rats and type 1 diabetic rats;(3)Compared with normal rats,both the relaxations on gastric fundus smooth muscle,and the contractions on pylorus circular muscle were increased in type 1 diabetic rats(P<0.01).ConclusionsBased on the changes of contractile and relaxant responses on gastric smooth muscle in STZ-induced type 1 diabetic 4 weeks rats,the damages of gastric fundus and pylorus seem to occur first,and the alterations of neuromodulation are main reason,which affects the contractile and relaxant functions of gastric smooth muscle in early type 1 diabetic rats.
Diabetics mellitus;Gastric smooth muscle;Electric field stimulation;Neuropathy;Rats
R-332
A
1671-7856(2015)11-0052-07
10.3969.j.issn.1671-7856.2015.11.012
河北省自然科学基金石药基金项目(C2011206175);河北省科技厅科技支撑计划项目(142777114D)。
郝璋森(1989-),男,硕士,从事糖尿病动物实验研究。
赵丁(1965-),女,教授,博士,主要从事糖尿病、肥胖动物模型及相关药理学研究,E-mail:zhaodingd@163.com。
﹞2015-10-19
技术方法
