剪切波在TI-RADS 4级甲状腺结节中的应用价值探讨*
2015-08-14崔可飞司彩凤刘媛祎
马 笑,崔可飞,付 超,司彩凤,刘媛祎
(郑州大学第一附属医院超声科,郑州 450052)
实时剪切波弹性成像技术(real-time shear wave elastogfaphy,SWE)为近年来发展起来的一种新型弹性成像技术,它通过发射声辐射脉冲对组织施加激励,使组织中产生足够强度的剪切波,以彩色编码技术实时显示出组织的硬度信息[1-2]。不仅实现了声波下的触诊,而且是目前唯一能测定表示组织绝对硬度——杨氏模量值的系统,具有客观、重复性好、受操作者影响小等优点[3-4]。大量研究结果表明,剪切波联合常规超声可提高对甲状腺结节良恶性的鉴别诊断能力[5]。本研究拟用剪切波对TI-RADS 4级结节进行判定,以期更好地应用于临床。
1 资料与方法
1.1 一般资料 2012年5月至2013年12月在本院经超声发现的甲状腺单发实性病灶患者251例,其中女153例,男98例,年龄10~81岁,平均(38.1±17.4)岁,所有病例均经超声引导下穿刺活检或手术病理证实。
1.2 方法
1.2.1 仪器与方法 (1)使用法国Supersonic imagine公司推出的Aicplorer型SWEI成像超声诊断仪,探头频率为7.5~13.0MHz。患者仰卧位,充分暴露颈部,发现甲状腺病灶后先常规超声记录病灶的大小、形态特征、内部回声分布、有无衰减、边界、有无钙化及血流分布情况,然后加用剪切波弹性成像模式。嘱患者屏气,探头轻轻放于皮肤,选定取样框,覆盖病灶,待图像稳定后定帧、存储。每个结节需要连续采集3个SWE图像。彩色量程图标显示的单位是千帕(kPa),默认量程为0~180kPa。于检查后1周调出SWE图像,由5年以上工作经验的超声医师测量各病灶,同一病灶重复测量5次,取平均值。图像质量控制:SWE操作时,轻置探头,尽量不施压,冻结图像时嘱患者屏气,静置图像不低于3s[6]。对常规超声发现的甲状腺结节依据Horvath等[7]的诊断标准对其进行TIRADS分类。
1.2.2 观测者内及观测者间重复性分析 随机选择30例患者,遵循双盲法原则,由两位超声医师分别测量两次杨氏模量平均值(间隔1周)。
1.3 统计学处理 数据分析采用SPSS17.0软件,计量资料以表示,组间比较采用两独立样本t检验。确定剪切波最佳界点及诊断价值采用ROC曲线,敏感性、特异性间的比较采用χ2检验。观测者内及观测者间一致性评价采用组内相关系数(ICC)。以P<0.05为差异有统计学意义。
2 结 果
2.1 病理结果 251例甲状腺单发实性结节直径大小3~49 mm,平均(17.27±8.24)mm。其中良性病变149例(其中结节性甲状腺肿114例、腺瘤18例、增生结节7例、腺瘤样结甲4例、桥本病6例),恶性病变102例(其中乳头状癌79例,滤泡性甲状腺癌11例,髓样癌7例,未分化癌3例,鳞癌2例)。
2.2 常规超声诊断结果 本研究251例甲状腺结节中,根据TI-RADS分类标准,TI-RADS 2级者33例,3级者48例,4级者112例,5级者58例。
2.3 诊断效能分析 251例甲状腺结节良、恶性甲状腺病灶的杨氏模量平均值分别为(32.68±22.67)、(72.06±27.20)kPa,二者比较差异有统计学意义(t=11.12,P<0.05),见图1、2。绘制ROC曲线得出曲线下面积为0.86,最佳界值为48.55kPa,此时敏感性、特异性分别为85.3%、86.6%(图3)。112例TI-RADS 4级结节良、恶性甲状腺病灶的杨氏模量平均值分别为(39.49±29.94)、(68.19±31.16)kPa,二者比较差异有统计学意义(t=12.45,P<0.05)。绘制ROC曲线得出曲线下面积为0.74,最佳界值为51.08kPa,敏感性、特异性分别为75.0%、78.3%(图4)。以E1为界值诊断TI-RADS4级甲状腺结节,敏感性、特异性分别为75.0%、77.7%,与应用E2诊断TI-RADS 4级结节的敏感性、特异性差异无统计学意义(P>0.05)。

图1 结节性甲状腺肿
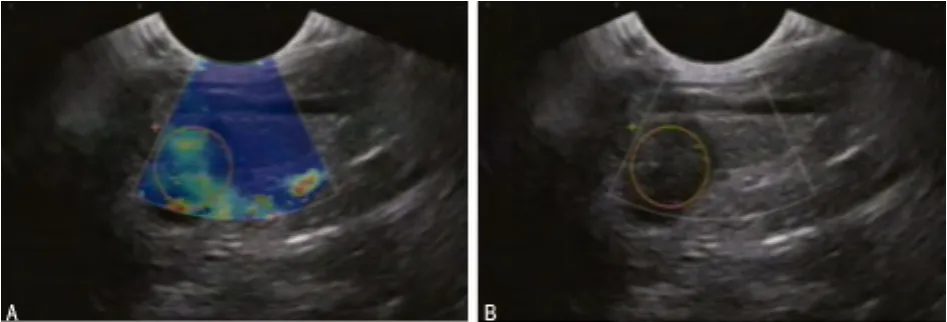
图2 甲状腺乳头状癌

图3 SWE诊断所有结节ROC曲线
2.4 观测者内、观测者间重复性 观测者内、观测者间一致性(重复性)的信度分析,见表1、2。

图4 SWE诊断TI-RADS 4级结节ROC曲线

表1 观测者内杨氏模量平均值的组内一致性分析结果
表2 观测者间杨氏模量平均值的组内一致性分析结果
3 讨 论
为规范化评估甲状腺结节,避免检查者主观因素的影响,Horvath等[7]提出建立甲状腺影像报告和数据系统(TIRADS)。诊断标准依据恶性率的不同将甲状腺结节划分为2~6级,其中4级定义为不确定性质结节,建议结合其他检查以进一步明确性质。而SWE是一种鉴别甲状腺良恶性结节的一种新的超声检查手段,它通过换能器发出剪切波,代替传统的人为探头施压对组织进行激励,通过测量剪切波在不同组织中的传播速度从而计算该组织的杨氏模量值,从而利用恶性病灶更质硬的原理得到病灶的良恶性信息。具体公式为E=3ρc2。该方式不仅实现了声波下的触诊,而且是目前惟一能定量测定测定组织杨氏模量值的系统,具有客观、可重复性好、受操作者影响小等优点[3]。不仅能独立诊断甲状腺结节的良恶性,更是能协助细针穿刺更准确的找到多发病灶中的恶性结节或是良恶性混合病灶中的恶性部分,具有广阔的临床应用前景[8-9]。大量研究结果证明,其与常规超声联合,可进一步提高其诊断甲状腺结节的准确性[5]。
但以往研究多是对各级别甲状腺结节整体进行研究,从而探索期诊断价值及确定界值,少见报道对TI-RADS 4级结节进行单独讨论。而TI-RADS 4级结节则因为其超声表现的特殊性,常规超声很难对其良恶性进行良好的评定[10],这就要求SWE可以提供更有价值的诊断信息。有研究报道不同的超声表现可对剪切波的数值产生一定的影响[11]。故以往对全部甲状腺结节的弹性成像研究是否也适用于TI-RADS 4级结节呢?还是TI-RADS 4级结节因其超声表现的特殊性,会对弹性成像造成一定的干扰,从而需要一个新的判定标准?此问题尚未见文献报道。故本研究对全部结节(TI-RADS各类别)进行SWE检查,并应用所得到界值对TI-RADS 4级结节进行进一步判定,从而探讨整体的结节的弹性成像界值是否可应用于TI-RADS 4级结节中。
本研究得到的界值E1为48.55kPa,将它应用到诊断TIRADS 4级结节,敏感性、特异性为75.0%,77.7%,与使用E2界值对TI-RADS 4级结节进行判定的敏感性、特异性差异无统计学意义(P>0.05)。这说明超声表现在一定程度上对甲状腺结节的剪切波弹性成像应用没有影响。且以往的全部甲状腺结节确定的界值亦可适用于TI-RADS 4级结节。
但剪切波反应的是组织的硬度信息,存在一定的误诊率[12]。若良性结节发生钙化、纤维化等,造成硬度升高,可误认为恶性病变[13];而恶性结节发生囊性变等,造成硬度减低,易误认为是良性病变。故在诊断甲状腺结节良恶性时,尚需联合常规超声对结节进行判定[14]。
本研究探讨了整体甲状腺结节的SWE界值亦可应用于TI-RADS 4级结节。且二者ROC曲线下面积均较高,说明剪切波诊断甲状腺结节良恶性的优势。说明剪切波可在常规超声的基础上进一步提高对TI-RADS 4级的诊断准确率。
[1]Park AY,Son EJ,Han K,et al.Shear wave elastography of thyroid nodules for the prediction of malignancy in a large scale study[J].Eur J Radiol,2014,30(11):912-915.
[2]Liu B,Liang J,Zheng Y,et al.Two-dimensional shear wave elastography as promising diagnostic tool for predicting malignant thyroid nodules:aprospective singlecentre experience[J].Eur Radiol,2014,30(9):717-719.
[3]Szczepanek-Parulska E,Wolinski K,Stangierski A,et al.Comparison of diagnostic value of conventional ultrasonography and shear wave elastography in the prediction of thyroid lesions malignancy[J].PLoS One,2013,8(11):e81532.
[4]Magri F,Chytiris S,Capelli V,et al.Shear wave elastography in the diagnosis of thyroid nodules:feasibility in the case of coexistent chronic autoimmune Hashimoto′s thyroiditis[J].Clin Endocrinol(Oxf),2012,76(1):137-141.
[5]Russ G,Royer B,Bigorgne C,et al.Prospective evaluation of thyroid imaging reporting and data system on 4550 nodules with and without elastography[J].Eur Endocri-nol,2013,168(5):649-655.
[6]Yoon JH,Jung HK,Lee JT,et al.Shear-wave elastography in the diagnosis of solid breast masses:what leads to false-negative or false-positive results[J].Eur Radiol,2013,23(9):2432-2440.
[7]Horvath E,Majlis S,Rossi R,et al.An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management[J].J Clin Endocrinol Metab,2009,94(5):1748-1751.
[8]Ma BY,Parajuly SS,Ying SX,et al.Application of shear wave elastography in fine needle aspiration biopsy for thyroid nodule[J].J Pak Med Assoc,2014,64(8):954-957.
[9]Wolinski K,Szczepanek-Parulska E,Stangierski A,et al.How to select nodules for fine-needle aspiration biopsy in multinodular goitre.Role of conventional ultrasonography and shear wave elastography-apreliminary study[J].Endokrynol Pol,2014,65(2):114-118.
[10]Moon HJ,Kwak JY,Kim EK,et al.A taller-than-wide shape in thyroid nodules in transverse and longitudinal ultrasonographic planes and the prediction of malignancy[J].Thyroid,2011,21(11):1249-1253.
[11]Kim JK,Baek JH,Lee JH,et al.Ultrasound elastography for thyroid nodules:a reliable study[J].Ultrasound Med Biol,2012,38(9):1508-1513.
[12]Rago T,Santini F,Scutari M,et al.Elastography:new developments in ultrasound for predicting malignancy in thyroid nodules[J].J Clin Endocrinol Metab,2007,92(8):2917-2922.
[13]武敬平,王瑛,赵玉珍.甲状腺占位性病变剪切波速度与组织纤维化评分之间的相关性研究[J].中华超声影像学杂志,2013,22(6):492-495.
[14]Jin ZQ,Lin MY,Hu WH,et al.Gray-scale ultrasonography combined with elastography imaging for the evaluation of papillary thyroid microcarcinoma:as a prognostic clinicopathology factor[J].Ultrasound Med Biol,2014,40(8):1769-1777.
