不同光照强度及温度对甘蔗脱毒原种苗增殖效果的影响
2015-08-11武媛丽昝丽梅张树珍杨本鹏
武媛丽 昝丽梅 张树珍 杨本鹏


摘 要 选用甘蔗‘新台糖22号为供试材料,分别研究了不同光照条件[40、60、80、100、120 μmol/(m2·s)]和温度条件(25、26、27、28、29、30、31和32℃)对甘蔗脱毒原种苗组织培养中增殖率以及植株生长状态的影响。结果表明:光照和温度对甘蔗组培苗的增殖及形态建成有着极其显著的影响,且当光照在100~120 μmol/(m2·s),温度在28~30℃,甘蔗脱毒原种苗增殖率最为理想。
关键词 甘蔗 ;脱毒原种苗;组织培养;光照强度;温度
分类号 S566.1 ;Q813.1
Abstract We choose ROC22 as research materials. And try to figure out the effects of different light intensity [40, 60, 80, 100, 120 μmol/(m2·s)]and various temperatures (25℃, 26℃, 27℃, 28℃, 29℃, 30℃, 31℃, 32℃) on the proliferation of virus-free original sugarcane seeding. The results revealed that light intensity and temperature played a key role in the proliferation and morphologization during sugarcane seedling growth. When the light intensity was between 100 to 120 μmol/(m2·s) and the cultivate temperature was between 28 to 30℃ the sugarcane had the best rate of proliferation and morphology.
Keywords virus-free original seeding of sugarcane ; tissue culture ; light intensity ; temperature
甘蔗(Saccharum officinarum L.)是热带、亚热带地区的重要经济作物,不仅是最主要的糖料作物,也是生产乙醇、葡萄糖等原料的能源作物[1]。中国是世界主要产糖国之一。甘蔗是中国制糖的主要原料,中国食糖产区主要集中在西南边远少数民族地区。因此,发展甘蔗生产,对于促进蔗糖产业的发展、稳定和振兴边疆经济尤其是农业经济,甚至对整个国民经济的发展及生活质量的提高都具有较为重要的地位和作用[2]。
甘蔗是无性繁殖作物,多年宿根栽培过程中,会受到多种病原物的反复侵染,使种性退化,进而造成甘蔗含糖量和产量下降。甘蔗花叶病和宿根矮化病是造成甘蔗品种退化的主要因素,且普通物理化学方法难以根除,成为中国甘蔗单产及含糖量提高的主要制约因素[3]。由中国热带农业科学院热带生物技术研究所研发的热处理结合腋芽分生组织培养技术培育的甘蔗脱毒种苗,能够彻底脱除甘蔗茎段所带的花叶病和宿根矮化病等病原,成功解决了中国甘蔗种性退化及良种繁育上的技术难题,提高了甘蔗产量和含糖量[4]。
本研究在前期研究基础上,探讨了光照和温度条件对甘蔗脱毒原种苗增殖效果的影响。由于组培苗生长在一个密闭的环境中,在光照周期下CO2浓度低,黑暗条件下则CO2浓度会升高,同时存在光照弱、湿度高的问题,限制了组培苗的光合作用[5-7]。温度是植物生长发育的一个重要的外界因素,因此,室内培养温度对甘蔗组培苗的生长和增殖也有举足轻重的作用。为此,笔者分析了在这样一个密闭的系统中,光照强度以及培养温度对甘蔗组培苗增殖率和生长状态的影响,旨在为甘蔗脱毒原种苗提供最优的室内培养条件,使其生长潜力尽可能得到最大程度的发挥。
1 材料与方法
1.1 材料
供试材料为中国热带农业科学院热带生物技术研究所甘蔗研究中心的新台糖22号脱毒原种苗。
1.2 方法
1.2.1 初始培养
把在起始培养基上长出的甘蔗小芽(经检测无病无毒的小芽,称为原原种苗)接种于增殖培养基(MS+1.0 mg/L+KT 0.5 mg/L+蔗糖3%,pH 5.8)上,于光照度100 μmol/(m2·s)、光照时间12 h/d条件下培养。
1.2.2 光照强度对甘蔗脱毒原种苗增殖及生长的影响
甘蔗脱毒种苗继代增殖时,在人工气候箱中进行不同光照强度对其增殖效果的比较。白天(7:00~19:00)光照强度分别设定为40、60、80、100、120 μmol/(m2·s),晚上(19:00至次日7:00)不照光。每处理接种100瓶,重复3次,培养15 d后观察其生长情况及并计算增殖系数。
1.2.3 培养温度对甘蔗脱毒原种苗增殖及生长的影响
甘蔗脱毒原种苗继代增殖时,在人工气候箱中进行不同温度对其增殖效果的比较。温度设定为25、26、27、28、29、30、31和32℃。每处理接种100瓶,设3个重复,培养15 d后观察其长势及增殖系数。
1.2.4 数据分析
采用SPSS 19.0进行方差分析,差异显著性检验用Duncan法。
2 结果与分析
2.1 光照强度对甘蔗脱毒原种苗增殖及生长的影响
不同光照强度对甘蔗脱毒原种苗增殖效果的影响见表1。表1的数据分析结果表明:在光照强度40~60 μmol/(m2·s)时,原种苗增殖率较低,叶色呈黄色至淡绿色,植株瘦弱,生长缓慢,尤其在40 μmol/(m2·s)时,植株松散发脆,严重生长不良;当光照强度达到80 μmol/(m2·s)时,原种苗增殖率超过2,叶色为绿色,植株生长正常;当光照强度达到100 μmol/(m2·s)时,原种苗增殖率达到2.2,叶色浓绿,植株生长正常;当光照强度达到120 μmol/(m2·s)时,原种苗增殖率达到2.3,叶色浓绿(图1,转接3 d拍摄),但与光照强度为100 μmol/(m2·s)时增值系数差异不显著(P>0.05),且当光照强度为100 μmol/(m2·s)和120 μmol/(m2·s)时,原种苗的增殖系数均显著高于其他光照强度(P<0.05)(表1)。表明,甘蔗脱毒原种苗在增殖培养时,最适宜的光照强度是100~120 μmol/(m2·s)。
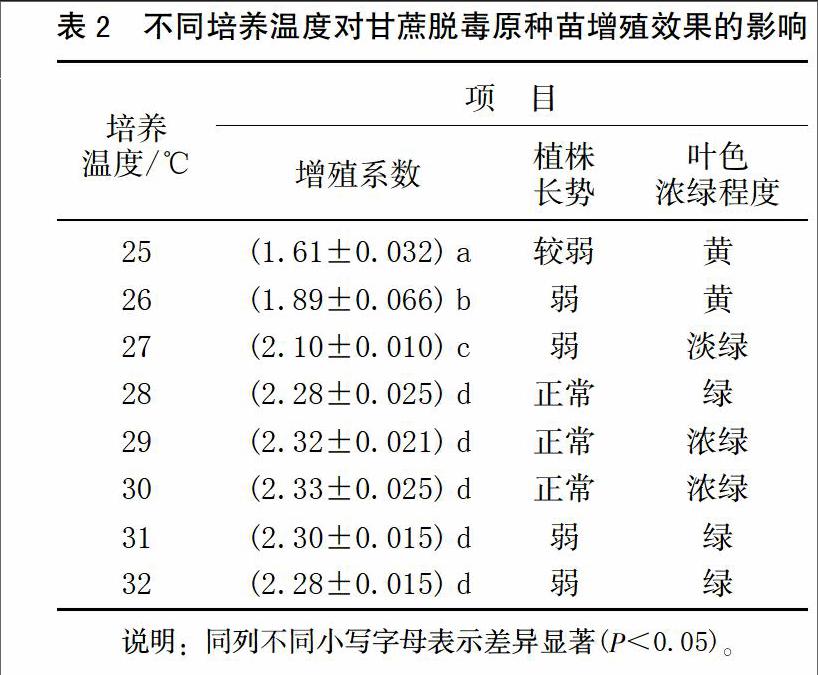
2.2 培养温度对甘蔗脱毒原种苗增殖及生长的影响
不同培养温度对甘蔗脱毒原种苗增殖效果的影响见表2。从表2的数据分析结果可以看出:25℃时的繁殖系数最低,植株生长量最小,随着培养温度的升高,增殖率显著提高,叶色逐渐由黄变绿。28~32℃时,甘蔗脱毒原种苗增殖系数可达2.28~2.33,显著高于25~27℃下甘蔗组培苗的增殖率。其中,28~30℃时,叶色正常,植株健壮,最适宜甘蔗脱毒原种苗的生长、扩繁,(图2,转接3 d拍摄)。31~32℃时的繁殖系数最高也可达到2.3,植株生长量大,但可能是因为培养温度过高,植株生长过旺、茎较细、叶片薄、叶茎细长,导致植株易早衰。因此,从甘蔗脱毒原种苗组培苗生产的实际出发,28~30℃可作为室内组织培养的最佳温度。
3 讨论
甘蔗是生长在热带、亚热带地区的C4植物,生物量大,生长发育需要较高的光照强度和温度才能满足其需要[8]。根据这一特点,本研究进行了室内甘蔗原种苗增殖培养过程中光照强度和培养温度对其增殖、生长的比较试验。
增殖率是植物组织培养中衡量芽增殖的一个很重要指标[9]。本试验表明,不同光照和培养温度下,甘蔗组培苗的增殖及生长效果的差异很大。光照强度较强时(100~120 μmol/m2·s,约8 000~9 600 lx)增殖较为理想,主要表现为增殖率较大,植株叶色正常,芽较为粗壮。当温度在28~30℃时,最有利于甘蔗脱毒原种苗的生长、扩繁,其增殖系数高,植株健壮。以上光照和温度范围对甘蔗组培植株的增殖率和形态建成起到了很好的促进作用。研究还表明,甘蔗组培苗增殖所需的光照强度远远超过其他常见热带作物,如香蕉组培苗增殖最适光强仅为1 000 lx[10],而番木瓜组培苗继代增殖的最适光照强度则为2 000 lx[11]。此外,同属禾本科作物的小麦,在继代培养时所需光照强度为3 500 lx[12],也远低于甘蔗继代增殖所需的光照强度。其中的主要原因可能是由于甘蔗为高光强C4植物,对光能的利用效率高于一般C3植物。
植物生长与能量分配密切相关[13]。在甘蔗脱毒原种苗增殖培养过程中似乎也存在这样的问题,当温度在28~30℃时,对甘蔗脱毒原种苗的增殖及生长最为适宜。本研究中,随着温度升高,推测外界所提供的能量也随之增加,但是甘蔗组培苗的增殖效果并不显著增加,反而已分化的丛生芽抽高旺盛,这可能与分化增殖的能量分配相关。
影响植株增殖因素很多,包括营养成分、pH值、渗透压、温度、光照等[14]。本试验结果表明,可以通过调节光照、温度,以此来调节甘蔗脱毒原种苗的增殖和生长的关系,使其达到一个最佳点,使其有较高增殖率的同时也有较好的长势。本研究通过对甘蔗脱毒原种苗组织培养中,对其增殖率有较大影响两个外界条件,即最适光照强度和最适培养温度的问题进行了研究,找出了甘蔗脱毒原种苗工厂化繁殖的适宜光照强度范围在100~120 μmol/(m2·s),适宜的培养温度为28~30℃。完善了甘蔗脱毒种苗室内工厂化培育关键技术体系。在该光照强度下可以保证甘蔗脱毒原种苗每15 d可增殖2.2倍以上,为室内工厂化培养优质甘蔗脱毒原种苗提供了保障。
参考文献
[1] 滕 峥,李 鸣,崔永祯,等. 农杆菌介导冷调节基因(Cbcor15a)遗传转化甘蔗体系的建立[J]. 南方农业学报, 2014,45(8):1 333-1 339.
[2] 吕 静. 国际糖业保护政策对中国食糖产业的影响[D]. 大连:东北财经大学,2010
[3] 杨本鹏,张树珍,蔡文伟,等. 甘蔗健康种苗田间栽培主要农艺性状比较[J]. 热带作物学报,2010,31(2):171-175.
[4] 杨本鹏,张树珍,杨 学,等. 甘蔗健康种苗培育体系的建立[J]. 热带作物学报,2006,27(4):74-77.
[5] Dube S, Vidaver W. Photosynthetic competence of plants grown in vitro[J]. Physiol Plant,1992,84: 409-416.
[6] Buddendorf-Joosten J M C, Woltering E J. Components of the gascous environment and their eddect on plant growth and wvelopment in vitro[J]. Plant Growth Reg, 1994, 15: 1-16.
[7] Kozai T, Fujiwara K, Kitaya Y. Modeling,measurement and control in plant tissue culture [J]. Acta Hort, 1996, 393: 63-73.
[8] Botha F C. Future prospects, In genetics, ,genomics and breeding of sugarcane[M]. Science Publishers, 2010, 31: 249-264.
[9] 郑洪立,王季槐,叶春海,等. 温度和光照对香蕉组培苗增殖和生根的影响[J]. 广西农业科学,2007,38(4):368-370.
[10] 郑洪立,叶春海, 王季槐,等. 温度和光照对香蕉组培苗生长和增殖的影响[J]. 热带作物学报,2008,29(4):455-459.
[11] 周 鹏,黎小瑛,沈文涛,等. 番木瓜幼稚组培苗生产体系的建立[J]. 热带作物学报,2005,26(1):44-46.
[12] 张 伟. 小麦组织培养再生体系及单倍体植物诱导技术优化研究[D]. 北京:中国农业科学院,2014.
[13] 李 博. 生态学[M]. 北京:高等教育出版社,2000:72-73.
[14] Mahanom J,Norzulaani K,Rofina Y O. Plant regeneration from embryogenic suspension cultures of Musa acuminata cv. Mas (AA) [J]. Plant Cell, Tissue and Organ Culture, 2003, 75(3): 209-214.
