TDZ和暗培养对蝴蝶兰叶片不定芽发生的影响
2015-08-11陆顺教等
陆顺教等


摘 要 以蝴蝶兰幼嫩花梗诱导的无菌苗叶片为外植体,以MS为基本培养基,研究不同暗培养时间和TDZ浓度对蝴蝶兰叶片诱导不定芽的影响。结果表明:暗培养和TDZ对接种的蝴蝶兰叶片的成活率均具有显著影响,暗培养60 d时,叶片的存活率在90%以上,而在同一暗培养时间条件下,叶片的存活率随着TDZ浓度的增加而上升;在TDZ浓度为3.0 mg/L,暗培养60 d时,蝴蝶兰存活叶片不定芽的诱导率最高,达到93.45%;诱导的不定芽数最多,平均每个外植体诱导的不定芽数为13.22个。综合考虑外植体的成活率、不定芽诱导率和诱导的不定芽数,蝴蝶兰叶片诱导不定芽的最佳条件为:MS+TDZ 3.0 mg/L,暗培养60 d。
关键词 蝴蝶兰 ;叶片 ;不定芽 ;TDZ ;暗培养
分类号 S682.31
Abstract Used leaves of in vitro plantlets which induced from young pedicels of Phalaenopsis as explants and the MS as basal medium, the effect of dark culture phase and TDZ on adventitious shoot induction from leaves of Phalaenopsis were investigated. The result showed that: dark culture and TDZ had a significant impact on survival rate of inoculated leaves, and the survival rate was more than 90% when the dark culture phase was 60 d, the survival rate increased with the increase of TDZ concentrations under same dark culture phase; The highest inductivity of 93.45% and maximum average number of adventitious shoots were obtained on the MS medium supplemented with 3.0 mg/L TDZ and under 60 d dark culture. Considering of survival rate, regeneration rate and adventitious shoot number, the optimum culture condition for adventitious shoots induction from leaf explants of Phalaenopsis was MS appended with 3.0 mg/L TDZ and 60 d dark culture treatment.
Keywords Phalaenopsis ; leaf ; adventitious bud ; TDZ ; dark culture
蝴蝶兰为兰科蝴蝶兰属植物,是兰科中最具观赏价值的花卉之一,因其花型奇特、色彩丰富、花期持久,在热带兰中具有“兰花皇后”的美称,在国内外花卉市场极受欢迎[1]。蝴蝶兰在商业生产中需要大量的种苗,但蝴蝶兰是单茎性气生兰,植株极少发育侧芽,较难进行分株繁殖。因此,组织培养是蝴蝶兰种苗高效繁育的重要手段[2]。蝴蝶兰通过组织培养获得大量种苗的方式主要有2种:一是通过无菌播种获得;二是通过外植体诱导产生原球茎或丛生芽,再通过原球茎或丛生芽增殖培养从而获得大量幼苗。商业生产中的蝴蝶兰大多是杂交品系,因此前者虽然简单易行,可短期内获得大量幼苗,但其后代变异率高,难以获得品质整齐的大规模种苗;后者变异率低,原球茎或丛生芽增殖系数高,幼苗品质较一致,适合商业生产种苗的大规模繁育。近年来,蝴蝶兰在茎尖[3-4]、花梗腋芽[4-5]、花梗节间段[6-7]、根尖[8-9]及根段[10]的组织培养上已经取得了很大进展。但以茎尖为外植体,不仅外植体材料少,还会因切取茎尖而损伤母株;以花梗作为外植体在取材时间上受到限制;以根尖和根段作为外植体诱导原球茎困难,诱导率低。叶片虽是蝴蝶兰组培快繁最好的外植体材料,但叶片诱导原球茎较为困难。目前,蝴蝶兰叶片诱导不定芽的组培快繁虽有少量研究[11-12],但缺少针对某一特定条件深入系统的研究。本研究以蝴蝶兰叶片为外植体,对影响蝴蝶兰叶片诱导不定芽的关键因素TDZ(Thidazuron,噻二唑苯基脲)浓度和暗培养时间进行研究,为蝴蝶兰的高效组培快繁和种质创新奠定基础。
1 材料与方法
1.1 材料
外植体取自中国热带农业科学院热带作物品种资源研究所热带兰花种质资源圃保存的黄花红唇金边蝴蝶兰品种,取其幼嫩花梗进行诱导培养获得该品种的无菌苗,诱导方法参照卜朝阳等[5]的方法。待无菌幼苗长到3片全展叶时,取其叶片作为试验材料。
1.2 方法
1.2.1 实验设计
采用单因素设计,分别进行以下试验:(1)不同浓度TDZ对叶片不定芽再生的影响:以MS为基本培养基,分别添加0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mg/L的TDZ,以不添加TDZ为对照;(2)不同暗培养时间对叶片不定芽再生的影响:叶片分别接种到各个TDZ浓度处理的培养基中,分别在暗培养箱中培养0(对照)、10、20、30、40、50、60 d,然后移至光照培养。
所有培养基均添加30 g/L的蔗糖、6.5 g/L卡拉胶,pH值调至6.0,分装至培养瓶中,每瓶分装30 mL,120 ℃高温高压灭菌后备用。取生长较一致的无菌苗,剪取顶部叶片,在正面轻轻的横划几刀,正面朝上置于培养基上,盖好瓶盖,置于(25±1)℃的暗培养室培养,然后根据暗培养试验设计的暗培养时间分别转至光照培养。每个处理做3个重复,每个重复接种10瓶,每瓶接种4个外植体。
1.2.2 项目测定
接种70 d后统计外植体的存活率、存活外植体不定芽诱导率、平均不定芽诱导数。
外植体存活率=存活外植体数/接种外植体数×100%
存活外植体不定芽诱导率=诱导不定芽外植体数/存活外植体数×100%
平均不定芽诱导数=诱导的不定芽总数/诱导不定芽外植体数
1.2.3 数据分析
试验所得数据采用SAS9.0软件进行处理与分析。
2 结果与分析
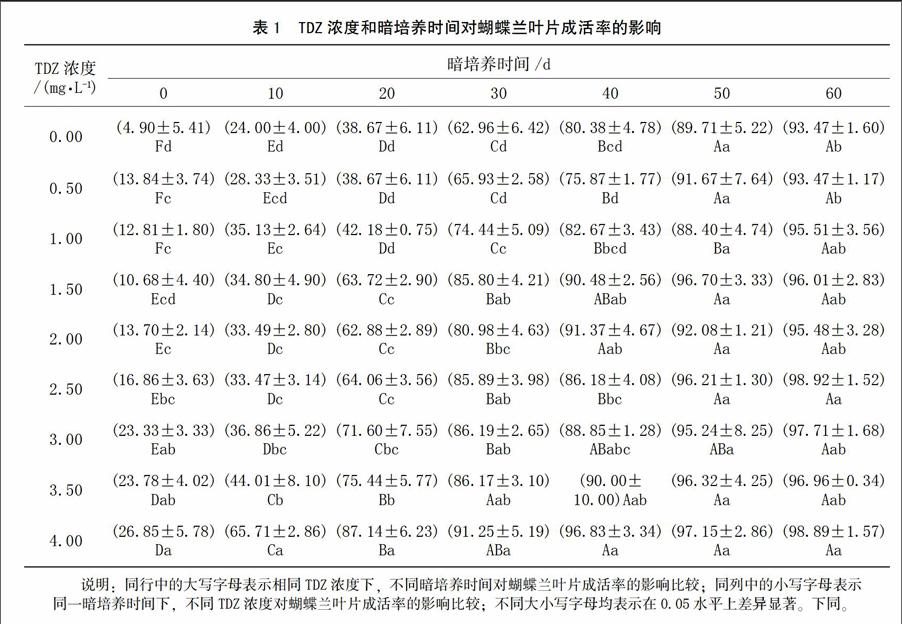
2.1 TDZ和暗培养对蝴蝶兰叶片成活率的影响
由表1可知,暗培养对蝴蝶兰叶片在组织培养中的成活率具有显著影响,在相同TDZ浓度条件下,随着暗培养时间的延长,叶片的成活率呈逐渐上升的趋势。暗培养60 d时,叶片的成活率最高;而未进行暗培养的叶片成活率不到30%,最高仅为26.85%。除了暗培养,TDZ对提高组培过程中蝴蝶兰叶片的成活率也具有显著的作用,在相同暗培养时间下,叶片的成活率随着TDZ浓度的增加而相应提高;在暗培养60 d,TDZ浓度为2.50 mg/L时,叶片的成活率达到最高98.92%。但当暗培养时间在50 d或以上时,叶片的成活率随TDZ浓度的增加虽略有提高,但不同浓度之间无显著性差异。因此,有利于蝴蝶兰叶片组培中外植体成活率的最佳条件为:MS+TDZ 2.50 mg/L+暗培养60 d。
2.2 TDZ和暗培养对蝴蝶兰叶片诱导不定芽的影响
由表2可知,TDZ对蝴蝶兰叶片诱导不定芽的影响显著,在相同暗培养时间条件下,蝴蝶兰叶片不定芽诱导率随着TDZ浓度的增加呈逐渐上升的趋势,在TDZ浓度为3.0 mg/L时达到最大值,之后随着TDZ浓度的增加而逐渐下降;其中在暗培养60 d,TDZ浓度为3.0 mg/L时,诱导率达到最大值,为93.45%。而暗培养同样对蝴蝶兰叶片诱导不定芽具有促进作用,在相同的TDZ浓度条件下,随着暗培养时间的延长。蝴蝶兰叶片不定芽的诱导率逐渐上升,在暗培养60 d时诱导率达到最高。综合TDZ浓度与暗培养时间对蝴蝶兰叶片诱导不定芽的作用,在MS+TDZ 3.0 mg/L+暗培养60 d时,蝴蝶兰叶片可获得最高的不定芽诱导率。
2.3 TDZ和暗培养对蝴蝶兰叶片不定芽分化的影响
由表3可知,TDZ和暗培养均可促进蝴蝶兰叶片不定芽的分化,蝴蝶兰叶片分化的不定芽数量随着TDZ浓度的增加和暗培养时间的延长而增多,其中在TDZ为3.0 mg/L,暗培养60 d时,分化的不定芽数量达到最高,每片叶平均分化的不定芽数量达到13.22个。之后则随着TDZ浓度的增加不定芽数的数量逐渐减少。因此,蝴蝶兰叶片诱导不定芽过程中,在MS+TDZ 3.0 mg/L+暗培养60 d条件下,单个外植体可获得最多的不定芽。
3 讨论与结论
近年来,关于蝴蝶兰的组培快繁研究已经做了大量的研究,但大多数集中在原球茎发生途径,然而原球茎发生途径的组培再生过程周期长,且发生细胞变异的可能性比较高[13]。而由叶片直接诱导不定芽的再生方式是通过直接器官发生途径实现的。一般认为,直接再生具有以下优势:一是分化时间短,在一定程度上缩短种苗繁育周期;二是通过直接出芽的方式可减少变异率,保持亲本的优良特性;三是外植体材料不受限制,可常年进行。但叶片分化不定芽发育成植株是一个非常复杂的脱分化、再分化的过程,在整个过程中受到多个因素的影响,本研究针对影响因素中的暗培养时间和外源激素TDZ的浓度进行了研究。
已有研究结果表明,暗培养可降低组培外植体材料的褐化,进而提高成活率,这已在春兰[14]、蝴蝶兰[15]、春石斛[16]、寒兰[17]等兰花组织培养中得到证实,本研究结果发现,暗培养可提高蝴蝶兰叶片外植体的成活率,与上述研究结果一致。暗培养对梨叶片不定芽再生具有显著的影响[18-19]。邢文等[20]在研究玫瑰叶片的直接再生中发现暗培养对不定芽的分化具有一定的促进作用。另外,在黑莓和黄瓜的叶片再生研究中,暗培养均对不定芽的再生具有明显的促进作用[21-22]。本研究结果表明,暗培养可提高蝴蝶兰叶片不定芽诱导率及分化的不定芽数,这与上述研究结果相似。在蝴蝶兰研究方面,程强强等[11]研究认为,短时间的暗处理有利于蝴蝶兰叶片不定芽的诱导,但其研究结果还发现,15 d的暗处理时间诱导率达到最高,且随着暗处理时间的延长,诱导率逐渐下降。而杨海芸等[8]的研究结果表明适当时间的暗培养有利于不定芽的发生,其中以暗培养21 d诱导效果最佳。以上2个蝴蝶兰叶片诱导不定芽的暗培养时间与本研究存在差异,这可能是由于所选材料的基因型不同造成的,而程强强等[11]的研究结果表明相同条件下不同基因型的蝴蝶兰叶片不定芽诱导率存在显著差异。综上所诉,不同基因型的蝴蝶兰叶片诱导不定芽需要的暗培养时间存在差异。
TDZ是人工合成的不同于腺嘌呤类细胞分裂素的苯基脲衍生物的一种,作为一种有效的植物生长调节剂广泛应用于植物组织培养中直接诱导叶片不定芽的形成研究中[23]。本研究结果发现,TDZ浓度为3.0 mg/L时,对蝴蝶兰叶片不定芽的诱导效果最好。而程强强等[11]在蝴蝶兰叶片诱导不定芽的研究中,结果发现在TDZ 3.0 mg/L条件下,‘红天使的不定芽诱导率和诱导的平均不定芽数均达到最高,与本研究结果一致。杨海芸等[8]研究认为TDZ 1.5 mg/L为蝴蝶兰叶片不定芽的最佳诱导浓度。Latip等[24]的研究结果发现TDZ浓度在0.1~0.3 mg/L时,叶片不定芽诱导率最高,而且这两者的研究结果在诱导率和不定芽的分化数量上均低于本研究,其可能的原因是外植体材料基因型不同造成的,另外,这2个研究所设置的TDZ浓度最高值均较小(前者最高为2.0 mg/L,后者为1.0 mg/L),未能全面体现TDZ的浓度梯度。
参考文献
[1] 卢思聪. 中国兰与洋兰[M]. 北京:金盾出版社,1994.
[2] 胡松华. 热带兰花[M]. 北京:中国农业出版社,2003.
[3] Tokuhara K, Mii M. Induction of embryogenic callus and cell suspension culture from shoot tips excised from flower stalk buds of Phalaenopsis(Orchidaceae)[J]. In Vitro Cell Dev Biol Plant, 2001, 37(3): 457-461.
[4] 张元国,刁家连,刘玉娥,等. 蝴蝶兰花梗腋芽组培再生技术体系的研究[J]. 山东农业科学,2004,6(1):3-5.
[5] 卜朝阳,蒋慧萍,满若君. 蝴蝶兰花梗离体培养及叶片诱导类原球茎研究[J]. 江苏农业科学,2008,3(1):147-150.
[6] 鲁雪华,郭文杰,徐立晖,等. 蝴蝶兰花梗节间段培养繁殖的初步研究[J]. 园艺学报,2002,29 (5) :491-492.
[7] 苏家乐,陈尚平,汤久顺,等. 蝴蝶兰花梗节间切段的类原球茎诱导与增殖[J]. 植物生理学通讯,2007,43(5):876-878.
[8] 杨海芸,黄珊珊,鲍忠赞,等. 蝴蝶兰根尖组织培养[J]. 林业科技开发,2009,23(3):120-123.
[9] Park S Y, Murthy H N, Paek K Y. Protocorm-like body induction and subsequent plant regeneration from root tip cultures of Doritaenopsis[J]. Plant Science, 2003, 164(5): 919-923.
[10] 李进进,廖俊杰,柯丽婉,等. 蝴蝶兰根段的组织培养[J]. 植物生理学通讯,2000,36(1):37.
[11] 程强强,庄东红,许大熊,等. TDZ高效诱导蝴蝶兰叶片不定芽及植株再生[J]. 植物科学学报,2011,29(4):524-530.
[12] 杨海芸,吴 震,王广东,等. 不同培养条件对蝴蝶兰离体叶片不定芽发生的影响[J]. 南京农业大学学报,2007,30(1):44-49.
[13] Chen W H, Chen T M, Fu Y M, et al. Studies on somaclonal variation in Phalaenopsis[J]. Plant Cell Reports, 1998, 18(1): 7-13.
[14] 王宝宁,张 显,宋军阳. 秦岭野生春兰组织培养过程中的褐化控制研究[J]. 北方园艺,2011,35(5):169-172.
[15] 崔广荣,张子学,胡能兵,等. 蝴蝶兰原球茎液体增殖培养的研究[J]. 激光生物学报,2009,18(2):189-194.
[16] 张新平. 春石斛兰组培增殖及兰花试管开花研究[D]. 杨凌:西北农林科技大学,2008.
[17] 雷文瑾. 寒兰组织培养中酚污染控制研究初探[J]. 南方园艺,2009,20(3):17-18.
[18] 苏艳丽,田 鹏,魏闻东. 红星梨叶片不定梢诱导及增殖培养[J]. 经济林研究,2015,33(1):103-106.
[19] 陶爱群,尹 婷,谢深喜. 黄金梨叶片再生体系建立研究[J]. 湖南农业科学,2012,5(1):108-111.
(下转第35页)
