人参皂苷Rg1通过糖皮质激素受体相关NF-κB信号通路发挥抗炎作用抵抗酒精性肝炎研究
2015-08-10楚世峰陈乃宏中国医学科学院北京协和医学院神经科学中心药物研究所北京00050湖南中医药大学中医诊断学湖南省重点实验室湖南长沙40007湖南中医药大学湖南长沙4008
高 岩,楚世峰,陈乃宏,3*(.中国医学科学院北京协和医学院神经科学中心药物研究所,北京 00050;.湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 40007;3.湖南中医药大学,湖南 长沙 4008)
·补益药研究·
人参皂苷Rg1通过糖皮质激素受体相关NF-κB信号通路发挥抗炎作用抵抗酒精性肝炎研究
高 岩1,楚世峰2,陈乃宏1,3*
(1.中国医学科学院北京协和医学院神经科学中心药物研究所,北京 100050;2.湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 410007;3.湖南中医药大学,湖南 长沙 410208)
目的人参皂苷Rg1是人参提取物中最具药理活性的皂苷之一。基于实验室前期研究及对肝炎的认识,本实验的目的在于研究Rg1在酒精诱导的小鼠肝炎模型中是否发挥抗炎作用,并探讨其可能机制。方法口服给予C57BL/6小鼠6 g/kg酒精,1 h后给予Rg1(10,20或40 mg/kg)或者阳性对照地塞米松(1 mg/kg)连续9 d。对血清进行生化分析、肝组织染色观察、免疫组化以及WB蛋白检测。结果与模型组比较,发现Rg1显著提高小鼠的生存率并降低异常升高的血清生化指标 (P<0.05)。病理和超显微结构表明酒精性肝损伤后肝组织病变情况,而Rg1反转其病变。过度产生的炎症因子包括TNF-α、IL-1β及IL-6亦被Rg1抑制。Rg1通过影响糖皮质激素受体调节NF-κB使肝脏恢复到正常情况。结论Rg1可能发挥配体作用促进糖皮质激素受体调节NF-κB进而对抗酒精性肝炎。
人参皂苷Rg1;酒精性肝炎;抗炎作用;糖皮质激素受体;NF-κB
酒精性肝炎(Alcoholic liver disease,ALD)在世界范围内均是一种高发病率和死亡率的疾病诱因[1],而酒精性肝炎的诱因包括肝性脂质变性,进程性的肝纤维化,肝硬化到肝细胞癌[2]。每年全球滥用酒精引发约330万人死亡,大约5.1%的全球负担来自酒精滥用[3]。酒精性肝炎的进程与多因素相关,包括基因遗传、营养以及环境因素等。
肝脏是主要的代谢器官,有毒化学物质乃至药物都可以诱发肝损伤[4]。酒精诱发的肝脏损伤主要包括直接对肝细胞的损害及代谢产物毒性,氧化应激则是其中的主要原因,诱发炎症级联反应。甾类激素能阻止肝脏炎症反应。在严重肝炎情况下,激素可以提高短期生存率[5]。糖皮质激素是抗炎常用药,可以抵抗炎症,免疫反应和活化转录因子等[6]。糖皮质激素可以与其受体结合,激活后可以入核,激活或者抑制下游相关的基因表达。糖皮质激素主要通过调节NF-κB来发挥抗炎作用[7]。激素具有有效的抗炎作用,但是长期使用可能会诱发严重副反应,甚至导致炎症积聚。大量和长期使用糖皮质激素会导致水盐平衡失调。激素对一些严重肝炎患者甚至无效[5]。
人参是一种运用广泛的药用植物,可以发挥很好的生化和药理学作用[8]。人参皂苷Rg1是一种活性较强的皂苷,具有很好的补益作用提高中枢神经系统的学习能力和记忆力[9]。除了在神经药理学方面的应用外,Rg1在肝病保护中也发挥了独特的作用:包括脂多糖/氨基半乳糖,四氯化碳及缺血等实验模型[10-14]。在此次实验中我们发现Rg1抑制了NF-κB的作用,而这种作用与糖皮质激素有着密切的关系,特别是Rg1通过糖皮质激素受体发挥抗炎作用时并未产生相应的副作用。所有结果证明Rg1可以作为潜在的临床用药对抗酒精性肝炎。
1 材料
1.1 药品及试剂
Rg1购自云南极粹生物科技有限公司;酒精购自红星酒厂;阳性对照药地塞米松购自Adamas-beta公司;米非司酮(RU486)购自紫竹药业;抗体购自Santa Cruz或Sigma公司;其他试剂为国产或进口分析纯试剂。
1.2 实验动物
雄性C57BL/6小鼠购自维通利华有限公司,SPF级,体质量18-22 g。常规饲养,实验过程遵守实验动物与保护的有关规则。
2 方法
2.1 实验分组
小鼠随机分为7组,提前给予RU486,Rg1或地塞米松3 d。组别:空白对照组,模型组(6 g/kg),RU486组(20 mg/kg),地塞米松阳性对照组(1 mg/ kg),Rg1组(40 mg/kg),地塞米松&模型组,Rg1&模型组。
2.2 模型制备
小鼠适应性伺养7 d,饮食饮水自理。实验开始时,首先给予Rg1,RU486地塞米松3 d,剂呈同上。之后给予除空白对照组以外各组灌胃酒精 (6 g/ kg),1 h前灌胃给予Rg1(10,20或40 mg/kg)地塞阳性对照组地塞米松(1 mg/kg)连续9 d实验期间观察小鼠体质量变化及毛色等改变,记录小鼠死亡率变化。取材前1 d晚禁食,留取肝组织及血清,进一步实验分析。
2.3 指标检测
2.3.1 线粒体电镜检测 取小鼠肝脏组织戊二醛固定,电镜下观察小鼠肝脏线粒体受损情况(北京天坛医院)。
2.3.2 细胞因子测定 通过合成炎症因子相关引物,利用RT-PCR方法观察Rg1对抗炎症因子作用。
2.3.3 肝脏病理学检查 取小鼠肝脏组织,4%甲醛固定,常规病理切片,HE染色,光镜下观察。
2.4 统计学方法
实验结果依据数据处理软件Graphpad 5.0进行统计分析,数据用组间差异显著性表示。
3 结果
3.1 Rg1提高肝炎小鼠生存率
如图1所示,模型组小鼠生存率在第2天由90%降至第9天的10%(P<0.001);Rg1各组 (10,20 和 40 mg/kg)生存率分别为 50%,50%和 70% (40 mg/kg,P<0.05)。空白对照组小鼠在整个实验周期无死亡发生。
3.2 Rg1保护线粒体超微结构
依据电镜结果可以发现模型组与空白对照组相比具有很大差异。在对照组中(图2),肝细胞微结构正常;模型组中出现空泡,线粒体嵴结构破坏甚至消失。在给予Rg1之后,超微结构部分恢复接近空白对照组。
3.3 Rg1逆转过度生成的炎症因子
炎症因子IL-6与酒精性肝损伤息息相关。酒精不仅可以活化巨噬细胞,也可以强烈促进炎症因子的释放。如图3所示,与空白对照组相比,IL-6在模型组中显著增加,但是Rg1可以缓解这一变化。与IL-6类似,炎症相关的TNF-alpha和IL-1beta在RNA水平也有显著的降低。但是给予RU486后,Rg1的这一缓解作用受到抑制。
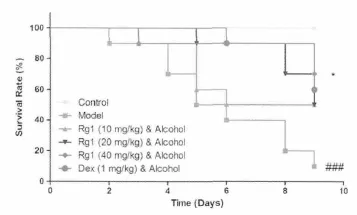
图1 人参皂苷Rg1提高酒精损伤小鼠生存率(n=4)

图2 人参皂苷Rg1改善小鼠肝脏超微结构异常变化

图3 Rg1影响TNF-alpha、IL-1beta和IL-6炎症因子的表达(n=4)
3.4 糖皮质激素配体Rg1缓解肝病变
通过HE染色观察可以发现,与正常对照组相比,酒精模型组有炎症细胞浸润;Rg1&RU486组可见静脉扩张,内膜脱落,肝细胞肿胀、坏死,汇管区有大量炎症细胞浸润。与超显微结果类似,给予Rg1后可以明显改善严重的肝细胞坏死情况,而RU486可以抑制Rg1该种保护作用。如图4所示。
3.5 Rg1调节糖皮质激素受体及其相关NF-κB信号通路
RU486是一种糖皮质激素受体抑制剂,阻断糖皮质激素受体入核发挥作用。根据WB结果可知,在病理情况下,Rg1与地塞米松均表现出促进糖皮质激素入核作用。而这种作用被RU486阻断,这表明Rg1可能与地塞米松类似是一种糖皮质激素配体。同时我们发现,酒精促进NF-κB入核,而NF-κB作用被Rg1阻断,p-IκB生成减少。同样Rg1抑制NF-κB入核的作用被RU486阻断。如图5所示。
以上结果提示,Rg1可能通过促进糖皮质激素受体及其相关NF-κB信号通路发挥抗肝炎作用。Rg1可能是一种糖皮质激素受体的配体。

图4 人参皂苷Rg1对组织形态学影响(H&E染色)
4 讨论
作为一种在全世界十分常见的流行公共健康问题,酒精性肝损伤导致严重的公众负担和健康危害[15-17]。在中国酒精性肝损伤被认为是排在病毒性肝炎之后的第二大疾病[18]。酒精诱发的损伤主要发生在肝脏,因为肝细胞具有多种调节代谢相关的酶系统,包括乙醇脱氢酶,乙醛脱氢酶以及CYP2E1等。过度的酒精代谢能损伤糖皮质激素受体功能,导致持续的炎症反应。目前营养疗法是比较有效治疗酒精性肝炎的疗法。而激素治疗虽然已经被使用多年,但是因为其有严重的副作用仍然被限制使用。所以寻找到一种临床使用安全有效的药物十分必要。
给予Rg1可以有效提高C57BL/6小鼠生存率,逆转血清生化指标异常升高。同时,组织学病变也被Rg1逆转,抑制炎症因子的过度产生。Rg1可能作为糖皮质激素受体的配体,促进糖皮质激素受体入核发挥抗炎作用,阻止NF-κB活化入核阻止其下游相关产物表达。加入RU486后,Rg1及地塞米松调节糖皮质激素受体阻断NF-κB的作用消失,表明Rg1可能是糖皮质激素受体的配体。Rg1不仅在中枢神经系统中具有很好的药理学作用,在对抗肝脏疾病时也有显著疗效。尽管我们发现了Rg1作为潜在抗酒精性肝炎的药物,但是需要更多的实验研究Rg1的药理机制及潜在风险。

图5 病理情况下给予人参皂苷Rg1对肝脏GR及NF-κB的作用(n=4)
[1]Bertola A,Mathews S,Ki SH,et al.Mouse model of chronic and binge ethanol feeding (the NIAAA model)[J].Nat Protoc, 2013,8(3):627-637.
[2]Altamirano J,Bataller R.Alcoholic liver disease:pathogenesis and new targets for therapy[J].Nature Reviews Gastroenterology &Hepatology,2011,8(9):491-501.
[3]WHO.Global status report on alcohol and health 2014[M]. World Health Organization,2014:1-365.
[4]Wu S,Yue Y,Tian H,et al.Carthamus red from Carthamus tinctorius L.exerts antioxidant and hepatoprotective effect against CCl(4)-induced liver damage in rats via the Nrf2 pathway [J].Journal of Ethnopharmacology,2013,148(2):570-578.
[5]Louvet A,Naveau S,Abdelnour M,et al.The Lille model: a new tool for therapeutic strategy in patients with severe alcoholic hepatitis treated with steroids[J].Hepatology,2007,45(6):1 348-1 354.
[6]Smoak KA,Cidlowski JA.Mechanisms of glucocorticoid receptor signaling during inflammation[J].Mechanisms of Ageing and Development,2004,125(10-11):697-706.
[7]Lavrovsky Y,Chatterjee B,Clark RA,et al.Role of redox-regulated transcription factors in inflammation,aging and age-related diseases[J].Experimental Gerontology,2000,35(5):521-532.
[8]Lee Y,Chung E,Lee KY,et al.Ginsenoside-Rg1,one of the major active molecules fromPanax ginseng,is a functional ligand of glucocorticoid receptor[J].Molecular and Cellular Endocrinology,1997,133(2):135-140.
[9]Sun C,Lai X,Huang X,et al.Protective effects of ginsenoside rg1 on astrocytes and cerebral ischemic-reperfusion mice[J].Biological&Pharmaceutical Bulletin,2014,37(12):1 891-1 898.
[10]Tao T,Chen F,Bo L,et al.Ginsenoside Rg1 protects mouse liver against ischemia-reperfusion injury through anti-inflammatory and anti-apoptosis properties[J].Journal of Surgical Research,2014,191(1):231-238.
[11]Li GJ,Sun P,Wang Q,et al.Wall.ex Lindl.attenuates CClinduced hepatic damage in imprinting control region mice[J]. Experimental and Therapeutic Medicine,2014,8(3):1 015-1 021. [12]Korivi M,Hou CW,Huang CY,et al.Ginsenoside-Rg1 Protects the Liver against Exhaustive Exercise-Induced Oxidative Stress in Rats[J].Evidence-based Complementary and Alternative Medicine,2012:1-8.
[13]Komatsu K-i,Tanaka H,Nakagawa D,et al.Effect of Notoginseng Extracts and their components on Lipopolysaccharide and Galactosamine Mixture-induced Impaired Hepatic Function in Mice[J].The Pharmaceutical Society of Japan,2012,132(7): 831-836.
[14]GengJ,PengW,HuangY,etal.Ginsenoside-Rg1 from Panax notoginseng prevents hepatic fibrosis induced by thioacetamide in rats[J].European Journal of Pharmacology,2010,634 (1-3):162-169.
[15]Liu J,Wang X,Liu R,et al.Oleanolic acid co-administration alleviates ethanol-induced hepatic injury via Nrf-2 and ethanol-metabolizing modulating in rats[J].Chemico-Biological Interactions,2014,221:88-98.
[16]Rehm J,Samokhvalov AV,Shield KD.Global burden of alcoholic liver diseases[J].Journal of Hepatology,2013,59(1):160-168.
[17]Ding RB,Tian K,Huang LL,et al.Herbal medicines for the prevention of alcoholic liver disease:A review[J].Journal of Ethnopharmacology,2012,144(3):457-465.
[18]Zhang FK,Zhang JY,Jia JD.Treatment of patients with alcoholic liver disease[J].Hepatobiliary&Pancreatic Diseases International,2005,4(1):12-17.
(本文编辑 李 杰)
Anti-inflammatory Function of Ginsenoside Rg1 on Alcoholic Hepatitis through Glucocorticoid Receptor Related Nuclear Factor-kappa B Pathway
GAO Yan1,CHU Shifeng2,CHEN Naihong1,3*
(1.State Key Laboratory of Bioactive Substances and Functions of Natural Medicines,Department of Pharmacology,Institute of Materia Medica,Neuroscience Center,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100050,China;2.Key Laboratory of Diagnostics of Traditional Chinese Medicine,Collaborative Innovation Center of Digital Traditional Chinese Medicine,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China; 3.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
ObjectiveGinsenoside Rg1 is one of the most pharmacological active constituents from ginseng extract.Based on prior experimental results and the understanding of alcoholic hepatitis,the major aim of this study is to investigate whether Rg1 is beneficial in a rodent model mimic alcoholic hepatic injury associated with binge drinking and explore the underlying possible mechanisms.MethodsC57BL/6 mice were given oral consumption of 6 g/kg alcohol 1 h after treated with Rg1(10, 20 and 40 mg/kg)or dexamethasone (1 mg/kg)for 9 consecutive days.Blood were performed biochemical analyses and liver fragments were processed for microscopy, immunohistochemistry and western blot analysis.ResultsCompared with the model group,Rg1 treatment significantly reversed the high mortality rate induced by alcohol consumption and also alleviated liver impairment as evidenced by the decrease of serum parameters.Meanwhile,histological and ultrastructural analysis of alcoholic groups showed hepatocellular impairment but restored in Rg1-treated groups.Overproductive inflammatory cytokines including TNF-α,IL-1β and IL-6 were also suppressed by Rg1.Rg1 modulated liver to normal levels by adjusting the glucocorticoid receptor related NF-κB pathwayConclusionThis study demonstrates that Rg1 might promote glucocorticoid receptor mediating the repression of NF-κB and inhibit the inflammatory reactions in alcoholic hepatitis.
ginsenoside Rg1;alcoholic hepatitis;anti-inflammation;glucocorticoid receptor;NF-κB pathway
R285
A
doi:10.3969/j.issn.1674-070X.2015.12.001
2015-11-25
国家自然科学基金项目(81274122、81373997、81273629、81473570);国家“重大新药创制”科技重大专项(2012ZX09301002-004、2012ZX09103101-006);教育部长江学者和创新团队发展计划(PCSIRT)(IRT1007);教育部博士点基金重点项目(20121106130001);北京市自然科学基金(7131013、7142115);新药作用机制研究与药效评价北京市重点实验室资助项目(BZ0150)。
高 岩,女,在读博士研究生,研究方向:中药防治肝病研究。
*陈乃宏,男,教授,博士研究生导师,E-mail:chennh@imm.ac.cn。
