厦门霉素生物合成基因簇在白色链霉菌及吸水链霉菌FR-008中的异源表达
2015-08-08张金龙
张金龙
(上海交通大学 生命科学技术学院,上海 200240)
0 引言
苯并吡喃类化合物被证明有多种生物活性和生理活性,由于其具有较低的细胞毒性以及良好的细胞膜穿透性,因此有成为理想的药物模板化合物的特质[1].该类化合物具有抗炎活性[2-3],抗菌活性[4-5],降血压及降血糖作用[6-7],拥有抗肿瘤的活性[8-10],并是治疗艾滋病的潜在药物[11].
本课题组前期从红树林来源的厦门链霉菌318菌株[12]中分离得到一种苯并吡喃类化合物,并将其命名为厦门霉素[13-14].该化合物已被申请专利[15],指出其具有抑制ICAM-1(细胞间黏附分子-1)/LFA-1(淋巴细胞功能相关抗原-1)介导的细胞黏附作用.本实验室也对厦门霉素的立体绝对构型进行了解析[13],并对其生物学功能进行了研究,证实厦门霉素有抑制纤维化的多种生物效应.例如在体外抑制肺过度纤维化、通过抑制局部炎症来弱化肥胖性疤痕以及减弱机械应力的作用[13-14].因此它可能成为抗纤维化作用的潜在药物.以上表明,厦门霉素可以作为合成药物的前体,因此厦门霉素的大量制备具有深远意义.但厦门霉素在厦门链霉菌318菌株中产量较少,且发酵周期长,难以满足工业生产的需要.如何实现厦门霉素的高效表达,已成为研究的必然趋势.
本课题组已克隆得到厦门霉素基因簇[16](共5个基因:ximA、ximB、ximC、ximD和ximE),将其整合到异源表达质粒pSET152中,并命名为pLMO09404[16].吸水链霉菌FR-008发现于20世纪80年代初,是一株抗生素产生菌[17],该菌株发酵时间短(只需3 d左右),具有适用于多种抗生素的工业化生产的潜质[18],且遗传背景较为清晰[19-25].白色链霉菌可以产各种色素及抗生素,已经被用于工业化生产的研究中[26-27].本研究中,将质粒pLMO09404分别与吸水链霉菌FR-008及白色链霉菌进行接合转移,检测厦门霉素是否能在白色链霉菌及吸水链霉菌FR-008中表达.
1 材料和方法
1.1 材料
1.1.1 菌株和质粒
所用菌株、质粒及引物见表1.

表1 菌株、质粒和引物信息Tab. 1 Information of strain, plasmid and primer
1.1.2 培养基和抗生素
大肠杆菌培养基为LB,链霉菌种子液培养基为TSB培养基[28],孢子悬浮液[28]用于孢子离心后重新悬浮孢子的培养基,2×孢子萌发液[28]为大肠杆菌-链霉菌接合转移的培养基,发酵培养基为GYM培养基[28],氨苄青霉素使用终质量浓度为100 mg/L,阿泊拉霉素(Apramacin,Apr)使用终质量浓度为50 mg/L,氯霉素萘(Chloramphenicol,Chl)使用终质量浓度为12.5 mg/L,卡那霉素(kanamycin,Kan)使用质量浓度为12.5 mg/L,啶酮酸使用质量浓度为25 mg/L.
1.1.3 实验仪器
高效液相色谱仪为Agilent 1200;质谱仪,Waters ACQUITYTM UPLC & Q-TOF MS Premier;紫外分析仪,Beckman公司.
1.2 实验方法
1.2.1 质粒及链霉菌基因组DNA的提取
大肠杆菌感受态细胞制备和质粒DNA提取、转化等操作参见文献[29].链霉菌培养、链霉菌孢子制备及链霉菌基因组DNA提取操作步骤参见文献[28].
1.2.2 大肠杆菌和吸水链霉菌FR-008,白色链霉菌之间的接合转移
将质粒pLMO09404及质粒pSET152分别转入大肠杆菌ET12567(pUZ8002)中,得到2个供体菌株大肠杆菌ET12567(pUZ 8002/ pLM009404)和大肠杆菌ET12567(pUZ 8002/ pSET152).将转化后的两株大肠杆菌分别接种于50 mL 新鲜的LB培养基(加入质量浓度为 50 mg/L 阿泊拉霉素、25 mg/L 卡那霉素及12.5 mg/L氯霉素)中,37 ℃,220 r/min,培养至OD600为0.4~0.6,分别离心收集菌体沉淀,用LB培养基洗涤2次,最后将菌体分别悬浮于1.5 mL LB培养基中待用. 取链霉菌FR-008,白色链霉菌孢子悬液100 μL,离心收集孢子沉淀,悬浮于5 mL0.05 mol/L、pH 8.0 的TES 缓冲液中,50 ℃热激10 min,迅速冷却至室温,加等体积2×孢子萌发液,37 ℃,220 r/min,培养2 h,离心收集孢子沉淀,重悬于200 μL LB培养基中.各取200 μL大肠杆菌ET12567(pUZ8002/ pSET152)和大肠杆菌ET12567(pUZ 8002/ pLM009404)分别与孢子悬浮液混合涂布于SFM固体培养基上,28 ℃静止培养18 h后用1 mL 含阿泊拉霉素和萘啶酮酸的水覆盖,继续培养2~3 d后长出接合子.
1.2.3 PCR验证条件
PCR反应参数:95 ℃变性5 min;95 ℃ 30 s,60 ℃ 1 min ,72 ℃ 1 min ,35个循环;72 ℃延伸5 min.
1.2.4 白色链霉菌及吸水链霉菌FR-008发酵条件
将链霉菌孢子悬液接种到SFM固体培养基中,28 ℃静止培养4 d;挑取单菌落,接种到TSB液体培养基(含阿泊拉霉素)中, 28 ℃,220 r/min,培养2 d作为种子液.按10%接种量将TSB种子液接种到发酵培养基GYM中,28 ℃,220 r/min,培养3 d,收集发酵液待测.
1.2.5 色谱检测条件
色谱柱为Agilent 1200 Eclipse XDB-C18(4.6 × 150 mm,5 μm),柱温26 ℃,流动相为A 和B两相梯度洗脱,A:乙腈,B: 1‰甲酸水.洗脱程序: 0~8 min,A为15%~60%;8~19 min,A为60 %;19~23 min,A为60%~85%;23~30 min,A为85%;30~32 min,A为85%~15%;32~36 min,A为15%.流速0.5 mL/min,紫外检测波长为254 nm,进样量为10 μL.
1.2.6 质谱检测条件
源温度115 ℃,去溶剂化温度350 ℃,锥形气体流量50 L/h,脱溶剂气体流量600 L/h,毛细管电压 3 000 V.
2 结果与讨论
2.1 PCR验证接合转移
将质粒pLMO09404和质粒pSET152分别导入吸水链霉菌FR-008及白色链霉菌得到S.albus-152,S.albus-09404,S.hygroscopicusFR008- 152以及S.hygroscopicusFR008-09404共4株菌株.用厦门霉素基因簇中的一个基因ximC的引物及质粒pSET152的引物用PCR方法分别检测S.xiamenensis318,S.albus,S.albus-152,S.albus-09404,S.hygroscopicusFR-008,S.hygroscopicusFR008-152以及S.hygroscopicusFR008-09404共7株菌株,见图1,其中基因ximC的PCR产物长度为821 bp,质粒pSET152的PCR产物长度为301 bp.结果表明在S.albus,S.albus-152,S.hygroscopicusFR-008以及S.hygroscopicusFR008-152中检测不到基因ximC,说明在S.albus,S.albus-152,S.hygroscopicusFR-008以及S.hygroscopicusFR008-152中不存在厦门霉素基因簇;在S.albus-152,S.hygroscopicus和S.hygroscopicusFR008-152中可以检测到质粒pSET152的存在,表明质粒pSET152已经接合转移入到S.albus-152和S.hygroscopicusFR008-152中.由于质粒pLMO09404是由质粒pSET152和厦门霉素基因簇整合而成,所以若菌株中有质粒pLMO09404,则基因ximC的引物及质粒pSET152的引物用PCR方法都可检测到,结果在S.albus-09404,以及S.hygroscopicusFR008-09404可以检测到基因ximC和pSET152,表明质粒pLMO09404已经接合转移入到S.albus-09404,以及S.hygroscopicusFR008-09404中.在S.xiamenensis318中可以检测到基因ximC,说明在S.xiamenensis318中有厦门霉素基因簇.
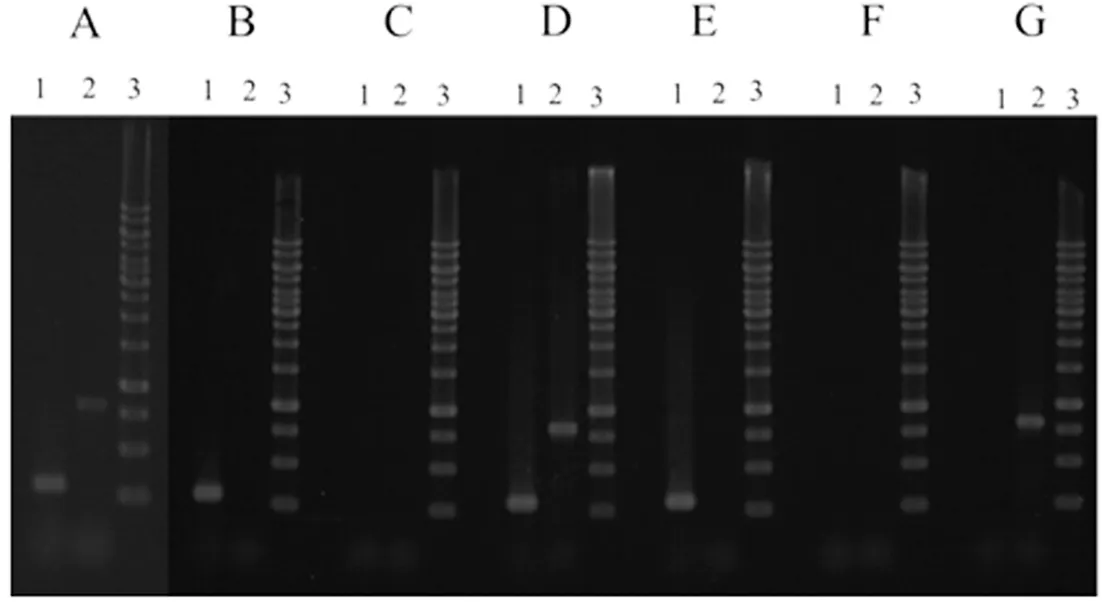
图1 PCR检测7个菌株Fig. 1 The identification of the 7 strains by PCR
注: 泳道1: pSET152引物,泳道2:ximC基因引物,泳道3:Marker,A:S.hygroscopicusFR008-09404;B:S.hygroscopicusFR008-152;C:S.hygroscopicusFR-008;D:S.albus-09404;E:S.albus-152;F:S.albus;G:S.xiamenensis318 Marker 为Thermo Scientific GeneRuler 1 kb DNA Ladder
2.2 HPLC验证异源表达
将S.xiamenensis318、S.albus、S.albus-152、S.albus-09404、S.hygroscopicusFR-008、S.hygroscopicusFR008-152及S.hygroscopicusFR008-09404共7株菌株发酵,取发酵液进行HPLC检测.在S.xiamenensis318可以在保留时间16 min时检测到厦门霉素,见图2 A,其在254 nm的紫外吸收图谱见图2 A.S.hygroscopicusFR-008和S.hygroscopicusFR008-152在保留时间16 min时没有峰出现,见图3,S.hygroscopicusFR008-09404在保留时间16 min时检测到厦门霉素,见图2 C,其在254 nm的紫外吸收图谱见图2 C,结果初步表明厦门霉素基因簇在S.hygroscopicusFR-008得到表达.S.albus和S.albus-152在保留时间16 min时没有峰出现,见图3,S.albus-09404在保留时间16 min时检测到厦门霉素,见图2 B,其在254 nm的紫外吸收图谱如图2 B,结果初步表明厦门霉素基因簇在S.albus-09404得到表达.

注: A)厦门霉素; B)S.hygroscopicusFR008-09404异源表达产物; C)S.albus-09404异源表达产物.
图2厦门霉素的紫外吸收图谱
Fig.2TheUVAbsorbanceofthemiamenmycin
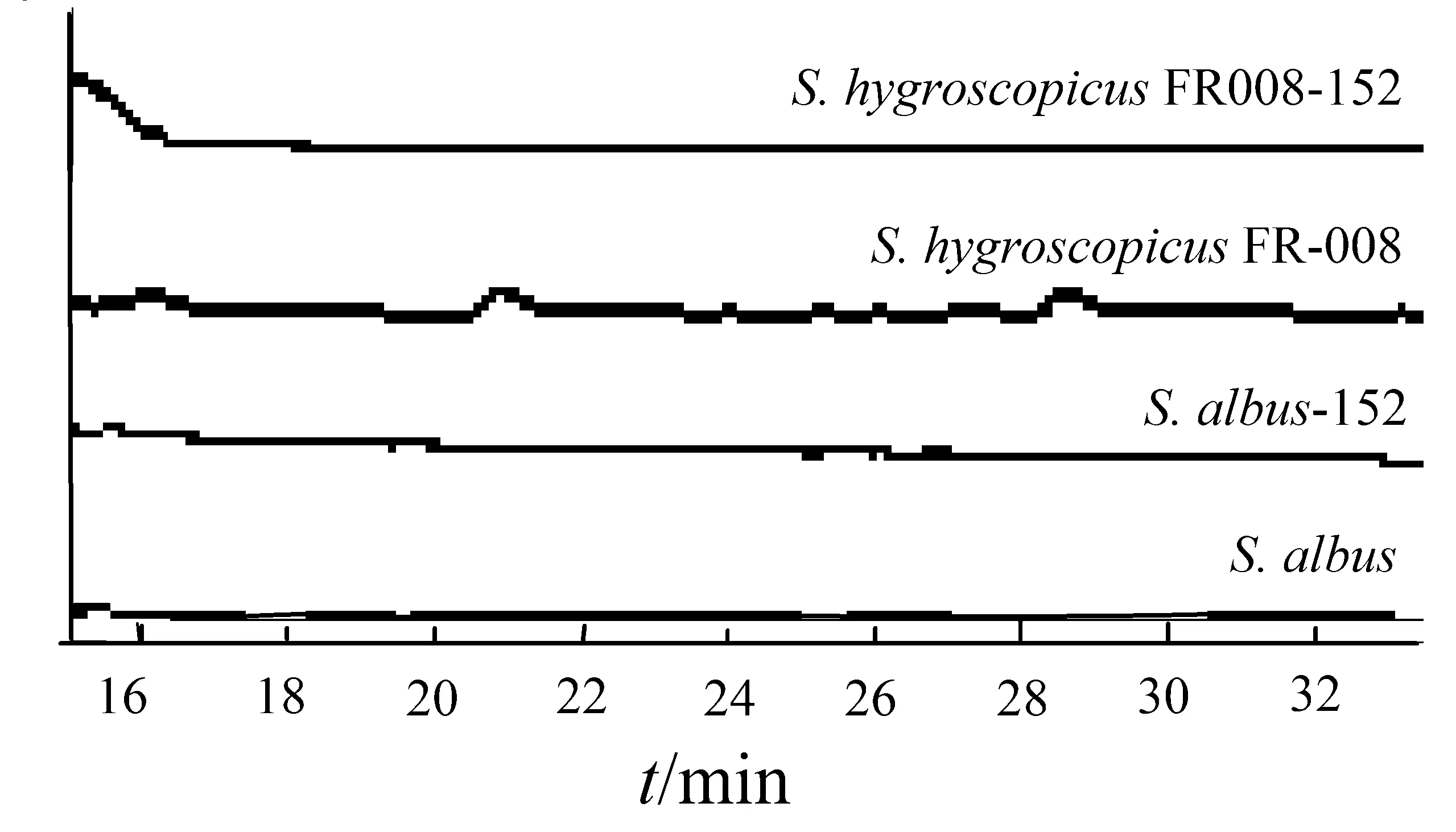
图3 HPLC检测4个菌株的发酵液Fig.3 The identification of the 4 strains fermented liquid by HPLC
2.3 质谱验证异源表达
将厦门霉素、S.hygroscopicusFR008-09404异源表达产物和S.albus-09404异源表达产物进行质谱检测.结果发现S.hygroscopicusFR008-09404异源表达产物和S.albus-09404异源表达产物的质谱图与厦门霉素的质谱图是一致的,结果见图4.质谱表明厦门霉素在白色链霉菌及吸水链霉菌FR-008中表达成功.
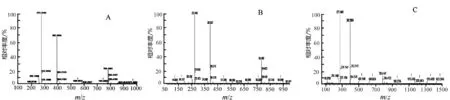
注: A)厦门霉素的质谱图; B)吸水链霉菌FR008-09404表达的厦门霉素的质谱图; C)S. albus-09404表达的厦门霉素的质谱图.
3 结论
厦门霉素可以作为抑制炎症和抗纤维化药物的潜在药物,它在野生株的发酵液少量存在,但无论是从发酵液里直接提取还是通过化学反应直接产生厦门霉素都存在成本高、不适合生产的问题.在厦门霉素的生物合成基因簇被探明后,就有可能通过基因改造的方法让菌株直接生产大量的厦门霉素实现产业化.本研究成功将厦门霉素的生物合成基因簇在可作为工业发酵的底盘菌株白色链霉菌及吸水链霉菌FR-008进行异源表达,在理论上为研究厦门霉素的生物合成机制及调控提供便利条件,并为进一步的遗传改造生产高附加值的苯并吡喃类化合物奠定了基础.
厦门霉素可在吸水链霉菌FR008-09404及白色链霉菌中表达,其中在吸水链霉菌FR008-09404的产量与野生株S.xiamenensis318中的产量相当,而在白色链霉菌中的产量较少,这可能是由于培养菌株都是在GYM培养基中发酵,其培养条件也相同,但GYM培养基及发酵条件可能并不是吸水链霉菌FR008-09404和白色链霉菌产厦门霉素的最优培养基及发酵条件,以后可以通过优化培养基及培养条件来提高产量.在S.hygroscopicusFR008-09404及S.albus-09404的发酵液中HPLC检测到其野生株和对照菌株S.hygroscopicusFR008、S.albus、S.hygroscopicusFR008-152和S.albus-152中没有的产物,可为以后分离新的苯并吡喃类化合物奠定基础.
