脑淀粉样病变致脑出血的机制探讨
2015-08-07付培平靳玫
付培平 靳玫
[摘要] 目的 探讨淀粉样脑血管病(CAA)引发脑出血的临床特点、发病机制及预后相关因素分析。 方法 对我院近3年收治的CAA引发的23例脑出血患者,均行头颅CT、MRI及SWI检查,计算颅内出血的体积、进行入院及出院时GCS评分及出院时mRS评分,进行预后分析,并结合文献对其发病机制进行深入探讨。 结果 CAA引发的脑出血有自发性、多灶性及短期复发的特点,头颅CT对新鲜出血敏感,MRI对新鲜出血和陈旧性出血均可显示,SWI显示皮质及皮质下有多个微出血灶,而基底节区、脑干、小脑无微出血灶。 结论 CAA是非高血压脑出血的重要原因;SWI示脑出血特征性表现可作为诊断依据,GCS评分出院比入院增加,出院时mRS评分与入院时GCS评分及脑出血体积有相关性。
[关键词] 脑淀粉样病变;脑出血;发病机制
[中图分类号] R743.3 [文献标识码] A [文章编号] 1673-9701(2015)21-0004-04
[Abstract] Objective To investigate the clinical features, pathogenesis and prognosis related factors of cerebral amyloid angiopathy(CAA) induced cerebral hemorrhage. Methods Twenty-three patients with CAA induced cerebral hemorrhage who had been treated in our hospital in the recent 3 years were given head CT, MRI and SWI examination. The intracranial hemorrhage volume, GCS scores at hospital admission and discharge and mRS scores at hospital discharge were calculated, and the prognosis analysis was conducted. The pathogenesis was investigated in-depth combining literature. Results CAA induced cerebral hemorrhage had the features of spontaneity, mulifocality and short-term recurrence. Head CT was sensitive to fresh hemorrhage, MRI could display both fresh hemorrhage and old hemorrhage, and SWI displayed cortical and subcortical multiple microbleeds but no basal ganglia region, brainstem or cerebellum microbleeds. Conclusion CAA is an important cause of non-hypertensive cerebral hemorrhage. Cerebral hemorrhage features displayed by SWI can serve as the diagnostic reference; The GCS scores at hospital discharge increase compared to those at hospital admission; The mRS scores at hospital discharge are correlated to the GCS scores and cerebral hemorrhagic volume at hospital admission.
[Key words] Cerebral amyloid angiopathy; Cerebral hemorrhage; Pathogenesis
脑淀粉样血管病(cerebral amyloid angiopathy,CAA)是淀粉样物质沉积在脑内血管导致症状性脑血管功能障碍的一种疾病,是老年人的一种卒中类型[1]。脑淀粉样血管病目前已经被列入脑出血的原因之一,既往临床上很难与脑动脉粥样硬化所致的脑出血鉴别,仅在病理检查时才能确诊。但是近年来,由于对痴呆认识的提高和CT、MRI、SWI的普及,该病的诊断率逐年增加。为加强对淀粉样血管病性脑出血的认识,现将我院近3年收治的23例相关性脑出血(CAA-related hemorrhages,CAAHS)患者的临床资料进行观察,现报道如下。
1 资料与方法
1.1 一般资料
本组患者23例均来自我院神经内科2012年1月~2014年12月的住院患者,其中男13例,女10例,年龄60~89岁,平均(74.5±9.2)岁。23例均无高血压病史,发病时出现高血压病者6例,伴有头痛者10例,伴智能减退者5例,伴有痴呆者3例,出现精神障碍者5例;短暂性脑缺血发作(TIA)者经抗凝、抑制血小板聚集治疗后引发脑出血6例,出现意识障碍3例,表现为失语、偏瘫者5例,视力障碍、偏瘫者4例,四肢瘫痪者5例。23例均静态急性起病,首次起病来诊者10例,2次复发者8例,3次复发者4例,4次复发者1例。
1.2 方法
所有患者入院后均急诊行头颅CT检查,给予常规治疗待病情稳定后行头颅MRI及SWI检查。头部CT 脑血肿体积计算方法[在脑出血最大层面上,(血肿的最大横径×垂直长径×血肿层数)÷2]。根据患者年龄、性别、是否合并高血压病、昏迷程度及神经系统缺损体征、脑出血次数、脑出血间隔时间进行入院和出院时格拉斯(glasgow coma scale,GCS)昏迷评分量表及出院时改良Rankin 量表(modified rankin scale,mRS常用脑卒中量表)进行评分[2]。23例脑出血患者均行脱水、降颅压、稳压,维持水、电解质平衡治疗及支持对症治疗。8例行颅内血肿碎吸术,3例行侧脑室引流术。对于合并TIA患者予卡马西平治疗,对于合并血管炎者予免疫抑制剂环磷腺苷治疗。
1.3 观察指标及疗效标准[2]
观察患者的血压、昏迷程度、神经系统缺失体征及脑出血次数,头颅CT、MRI及SWI显示病灶数目及出血量大小,入院、出院进行GCS评分及mRS评分。疗效标准:GCS评分≥15分者为临床痊愈,GCS评分增加3~5分者为好转,GCS评分无变化者为无效,GCS评分0分者为死亡。
1.4 统计学处理
应用SPSS13.0统计学软件进行数据处理,计量资料用均数±标准差(x±s)表示,组间比较采用t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 脑病灶检查情况
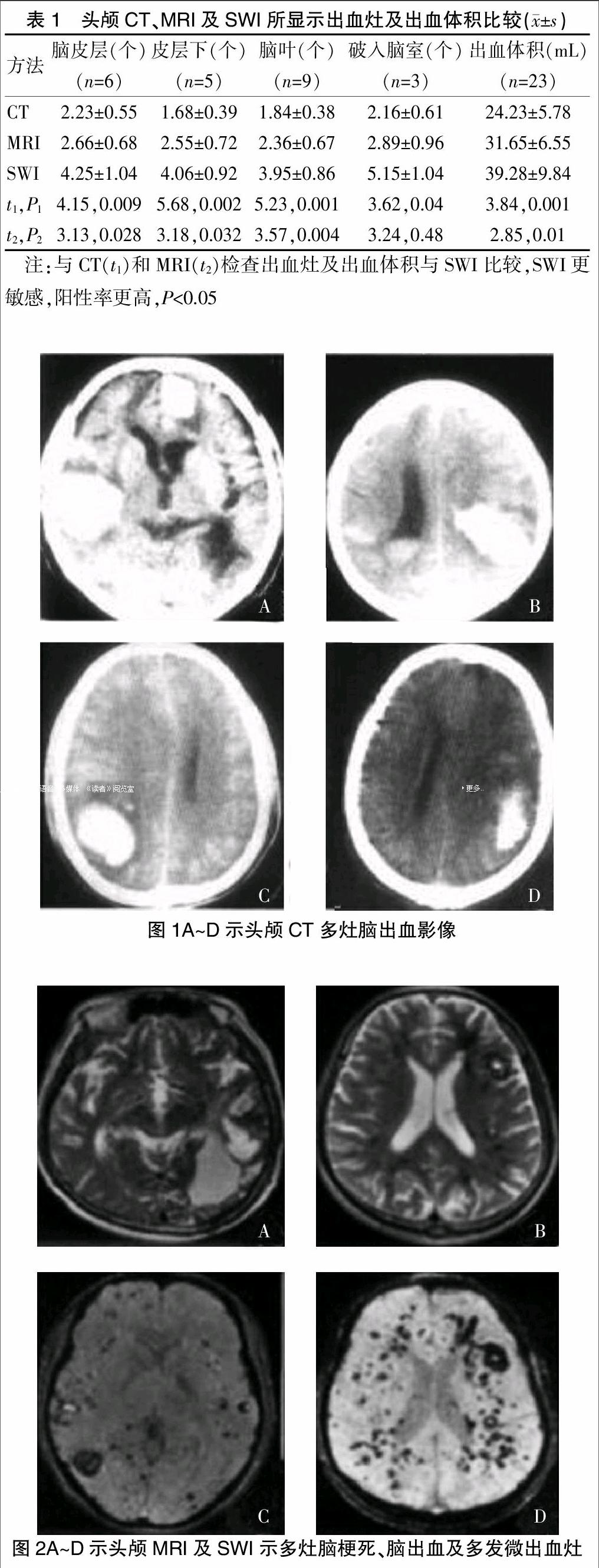
脑出血均为脑实质出血,分布在脑皮层、皮层下及脑叶。3例破入脑室,CT表现为高密度灶,CT值58~90 HU,周围低密度环绕,有占位效应。头颅MRI显示,表现为急性期、亚急性期和慢性期血肿混合,T1WI表现为以低、等信号的混杂信号,部分灶内见点状、片状或环状短T1信号,在T2WI和FLAIR上呈以低、高信号为主的混杂信号。在SWI上,均显示为多发出血灶,均表现为皮层-皮层下多发点状或小圆形,低信号灶,边界清楚,部分病灶中心可见点状或斑片状高信号(“靶征”),SWI显示的出血灶数目明显多于常规MRI序列。见表1。
2.2头颅CT、MRI及SWI影像结果
见图1A~D、图2A~D。
2.3量表评分及预后
治疗后,23例患者死亡2例,临床痊愈7例,好转9例,再次复发脑出血3例,植物状态2例。GCS 评分出院比入院时明显增加(P<0.05)。见表2。
3 讨论
脑淀粉样血管病(cerebral amyloid angiopathy,CAA)是以刚果红和硫磺素染色阳性的淀粉样物质(β-amyloid peptide,Aβ)沉积于脑中、小动脉和毛细血管壁为特征的一种脑小血管疾病的一种类型[4],Aβ的沉积与其产生增多和清除减少有关。淀粉样蛋白由39~42个氨基酸组成,电镜下淀粉样蛋白沉积血管基底膜,受累血管基底膜透明变性、玻璃样变,细小动脉瘤形成。血管脆性增加,容易破裂出血,从而引起多灶性、自发性、反复性颅内出血。
从本组临床资料可以看出,CAA致脑出血(CAA-related hemorrhages,CAAHS)的临床表现据脑出血的位置和血肿体积大小而不同,主要表现为头痛、智能障碍、偏瘫、四肢瘫及意识障碍,且表现为2次、3次甚至4次出血,据神经系统缺失体征,可以判定为2个病灶及多个病灶存在,有反复性和多灶性自发性颅内出血的特点。这是由于CCA 主要累及软脑膜和皮质动脉和皮质下血管,主要分布于枕叶和额叶,刚果红染色可显示病变血管及其周围的橘红色物质沉积,即Aβ沉积[5]。目前发现有7种物质可以在中枢神经系统沉积,最主要的物质仍为β-淀粉样蛋白(Aβ);基因多态性和突变是CAA发生的主要分子机制[6];现已发现载脂蛋白E(ApoE)、早老素1(PST1)、α-抗糜蛋白酶等基因都可能参与CAA发生。其中APOE基因的3种等位基因中,ε4可促进Aβ在脑血管壁的沉积,ε2可诱发脑出血,是CAAHS的独立危险因素[7]。研究显示,充满淀粉样蛋白的血管内皮功能不全而不能抑制循环的纤维蛋白溶酶和纤溶酶激活物,从而导致微出血及更大的血肿。
从本组影像学资料可以看出,CAA所致脑出血第一次出血20%呈单发灶,80%呈多发灶,多次出血者均呈多发灶,且形态不规则,伴有较大出血灶,更伴有较小的出血灶及微小出血灶。头颅的影响学结果显示:均表现为多发、多脑叶出血灶,脑出血的部位多位于皮质或皮质交界区,以颞叶、枕叶、顶叶受累常见,额叶次之,血肿较大可破入脑室,表现为脑室内积血[8]。本组病例均未发现脑干、脑白质、基底节部位出血。头颅CT所显示病灶均为高密度灶,CT值符合脑出血。由于CAAH 具有反复性和容易复发的特点,常表现为急性、亚急性和慢性期血肿混合存在,故头颅MRI结果示:在T1WI、T2WI和FLAIR 上表现为低、等、高信号同时存在的混杂信号,故显示病灶明显比头颅CT多。头颅SWI 结果所示:23例均表现为大量微出血灶,多位于皮层-皮层下多发点状或小圆形低信号灶,直径多≤5 cm,边界清楚,较大病灶体积同头颅CT或MRI诊断;这些病灶除5例在 T2WI 上相应位置见数个小圆形低信号外,其余 18例在常规MRI 上均未见显示(图2A~2D);全部病例在 SWI 上均显示了常规头颅CT或MRI不能显示的病灶。这是由于SWI利用了三维采集、高分辨力、薄层重建的梯度回波序列,且SWI具有对含铁血黄素沉积和局部磁场差异性很小的不均匀性高度敏感的特点,故能更好地显示微量出血、微小血管和细小的血管畸形以及其他小血管病变;因此SWI较常规MRI序列对颅内出血及多发微小出血灶有着更高的检出率,更能反映CAAH 的多发性特点,提高了CAAH 的诊断与鉴别诊断能力;脑微出血是CAAH 诊断的必要条件[9]。
研究表明 CAAHS在> 60 岁的患者中很常见,发病率与年龄部分呈正相关[10]。CAA 的诊断主要依靠临床症状及常规影像学表现,确诊有赖于病理活检,病理结果多数是在患者出现脑叶巨大血肿清除术后获得,应属于病情相对晚期阶段,而在没有明显的临床症状前,是难以确诊的。SWI 由于其对于微出血灶显示的敏感性,在未出现明显临床症状前,则可能得到较明确的诊断,为早期的干预治疗提供了依据;由于抗凝剂可能加重 CAA 患者颅内出血的风险,CAA 的早期诊断有助于指导临床抗凝治疗,评估合并 TIA 或者其他需要抗凝治疗患者的风险-效益比;对于类似于中风先兆及 TIA 的短暂性神经症状发作表现而与需要抗凝溶栓的缺血性脑卒中、TIA 难以鉴别的CAA 患者,SWI 上皮层-皮层下多发低信号,少见于基底节区、丘脑、脑干及深部白质,这一特征有助于早期发现微出血灶及早期诊断 CAA,改变了以往脑淀粉样血管病单纯依靠有创性病理诊断的局面,为本病的早期干预提供客观的影像学依据,使改善预后成为可能。
从本组资料可以看出:部分 CAA 患者有类似于中风先兆及短暂性脑缺血(TIA)的短暂性神经症状发作,进行溶栓抗凝治疗后引起脑出血;既往研究提示,抗凝治疗可明显增加CAAH 再出血的风险,应避免[11], 对于脑出血的治疗同高血压脑出血,恢复后要避免使用抗凝剂,慎用抗血小板类药物,部分血管炎患者使用免疫抑制剂有效率很低。单灶出血、血肿体积较小者临床痊愈率高,多次出血、血肿体积较大者死亡率较高;患者近期预后mRS评分与 GCS 评分及脑出血体积显著相关,说明入院时神经功能缺损的严重程度及脑出血体积是影响预后的危险因素。Salat等的研究亦指出 GCS评分低、血肿体积大(>60 mL)及出血破入脑室是导致CAAHs高死亡率的危险因素[11],与本文研究的结果基本一致。
综上所述,对CAA目前尚无有效疗法,头颅CT和MRI对微出血灶显示差,SWI显示的皮质及皮质下有多个微出血灶而基底节区、脑干、深部白质无微出血灶是CAAHS的特征性表现[12],可作为诊断依据。对于CAA所致TIA及脑出血不能应用抗凝剂,免疫抑制剂治疗可能有效。如何预防以及有效清除CAA 患者脑血管壁上沉积的Aβ可能是治疗CAA 的关键,也是国内外医学研究的热点。
[参考文献]
[1] 吴江,贾建平,崔丽英,等. 神经病学[M]. 北京:人民卫生出版社,2005:184-186.
[2] Jiang JY,Zhang J,Zhong TA,et al. Effect of multiple factors on progrosis of patients with severe head injuries[J]. Academic Journal of Second Military Medical University,2001,22(8):763-766.
[3] 李朝华,王晶,霍杰,等. 实用急救医学答疑[M]. 北京:科技文献出版社,2008:109-112.
[4] Pantoni L. Cerebral small vessel disease:from pathogeresis and clinical charateristics to therapeutic challenges[J]. Lancet Neurol,2010,9(2):689-701.
[5] Weller RO,Preston SD,Subash M,et al. Cerebral amyloid angiopathy in the aectiology and immunotherapy of Alzheimer disease. Alzheimers Res Attems[J]. Topogyaphieal Distribution of Cerebral Amyloid Angiopathy and Neurol Sei, 2007,25(7):49-55.
[6] 熊永洁,张苏明. 脑淀粉样血管病研究进展[J]. 中华神经病学杂志,2011,44(6):416-418.
[7] Revesz T,Holton JL,Lashley T,et al. Genetics and molecular pathogenesis of sporadic and hereditary cerebral amyloid angiopathies[J]. Acta Neuropathol,2009,11(8):115-130.
[8] 闫欣,胡洪涛,马志刚,等. 脑淀粉样血管病相关性脑出血的临床研究[J]. 中风与神经疾病杂志,2013,30(2):638-641.
[9] 魏微,张微微. 脑淀粉样血管病相关的脑卒中研究进展[J].神经损伤与功能重建, 2009,4(2):447-449.
[10] Vernooi J MW,Vander Lugt A,Zkrnm MA,et al. Prevalence and risk factors of cerebral microbleeds[J]. Rotterdam Scan Studyheurology,2008,70(6):1208-1209.
[11] Salat DH,Smith EE,Tuch DS,et al. White matter auterations in cerebral amyloid angiopathy measured by diffusion tensor imaging[J]. Stroke,2006,37(8):1759-1764.
[12] Kang HS,Kim JH. Plasma matirix metalloproteinases,cytokines and angiogenic factors in moyamoya disease[J]. Neural Neurosurg Psychiatry,2010,81(6):673-678.
(收稿日期:2015-03-26)
