慢性应激状态对老年性骨质疏松症影响的实验研究
2015-08-06赵志坤等
赵志坤等
[摘要] 目的 研究慢性应激状态对老年性骨质疏松症病变程度的影响,为老年性骨质疏松症的预防和治疗提供可靠的实验依据。 方法 选取SPS级快速老化小鼠SAM-P6(3月龄,雄性)24只,随机分为实验组和对照组(n = 12),实验组每日给予不可预见性慢性温和应激,对照组正常饲养,4周后检测血清学指标和micro-CT各项参数,综合评估骨代谢水平和骨强度。 结果 实验4周末,实验组小鼠体重比实验开始时明显下降,差异有统计学意义(P < 0.05);与对照组比较,实验组血钙、碱性磷酸酶水平均显著增加(P < 0.05),血清骨钙蛋白水平明显降低(P < 0.05),而血清Ⅰ型胶原氨基末端肽水平显著增加(P < 0.05),骨密度明显降低(P < 0.05),骨小梁相对体积显著降低(P < 0.01),骨小梁数目明显减少(P < 0.05)。 结论 慢性应激状态加剧骨丢失,降低骨强度,加重老年性骨质疏松症严重程度,在老年性骨质疏松症的预防和治疗过程中应予以重视。
[关键词] 应激;骨质疏松;骨密度;骨微结构
[中图分类号] R681 [文献标识码] A [文章编号] 1673-7210(2015)06(c)-0026-04
骨质疏松症是以骨量减少、骨密度降低、骨组织结构改变为特点,导致骨正常负载功能减弱和骨折危险性增加的一种综合征[1-3],多见于老年人。老年性骨质疏松症是常见的原发性骨质疏松症类型。目前我国人口老龄化现象正呈现快速发展态势,如何预防和治疗老年性骨质疏松症,具有重要的临床价值和社会意义。研究表明,抑郁是骨质疏松症的危险因素,导致骨量减少[4]。但是,应激状态对老年性骨质疏松症疾病进程的影响尚需要进一步研究。本研究旨在探讨慢性应激状态对老年性骨质疏松症病变程度的影响,为老年性骨质疏松症的预防和治疗提供可靠的实验依据。
1 材料与方法
1.1 实验动物
选取SPF级快速老化小鼠SAM-P6(3月龄,雄性)24只,平均体重为(21.28±0.27)g,由军事医学科学院实验动物中心SAM鼠繁育屏障系统提供,实验动物质量合格证编号为SCXR(京)2012-0004。所有实验动物在同等环境下分笼饲养,予以正常饮食,环境温度(23±1)℃,平均相对湿度55%,每天光照与黑暗各12 h循环交替,饲养7 d以适应实验环境。
1.2 实验分组与取材
按照随机数字表法,将所有实验动物分为两组,即实验组和对照组,每组12只。实验组给予不可预见性慢性温和应激(unpredictable chronic mild stress,UCMS),按照Mineur等[5]的方法并加以改进制备UCMS小鼠模型,每天随机选取刺激时间,并随机给予下列应激刺激之一:电击足底(10 mA,间隔1 min刺激l次,共30次);昼夜颠倒(24 h);冰水游泳(8℃,15 min);热刺激(电暖器照明15 min);去除垫料(24 h);变换饲养环境温度(24 h更替);倾斜鼠笼(24 h);置于塑料管限制活动(60 min);夹尾(2 min)。同种刺激不连续出现,持续4周。对照组不给予任何刺激,正常饲养。在持续给予刺激4周后,禁食12 h,对各组小鼠摘除眼球取血,通过颈椎脱臼法处死后,迅速剥离股骨,尽量剔除附着的肌肉等软组织,注意避免损伤骨皮质,留取完整的股骨段,用生理盐水浸透的纱布包裹后,置于-20℃冰箱保存备用。
1.3 血清学指标的测定
采用迈瑞BS-220全自动化生化分析仪测定血清中钙、磷和碱性磷酸酶(ALP)的含量。通过酶联免疫吸附试验(ELISA)试剂盒检测血清骨钙蛋白及Ⅰ型胶原氨基末端肽(NTx)水平,所有操作严格按照试剂盒说明书进行。
1.4 micro-CT检测
将备用股骨样本在室温下解冻后,置于micro-CT系统(GE公司)的检测管内,在高分辨率下沿标本长轴方向扫描,扫描厚度为20 μm,获取连续的micro-CT图像。在完成扫描后重建整体结构,选取股骨近端骨组织为兴趣区域(region of interests,ROI),采用三维直接测量法分析骨微结构各项参数,包括骨密度(bone mineral density,BMD)、骨小梁相对体积(bone volume/total volume,BV/TV)、骨小梁数目(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁分离度(trabecular separation,Tb.Sp)、结构模型指数(structure model index,SMI)等。
1.5 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;以P < 0.05为差异有统计学意义。
2 结果
2.1 两组小鼠的一般状况
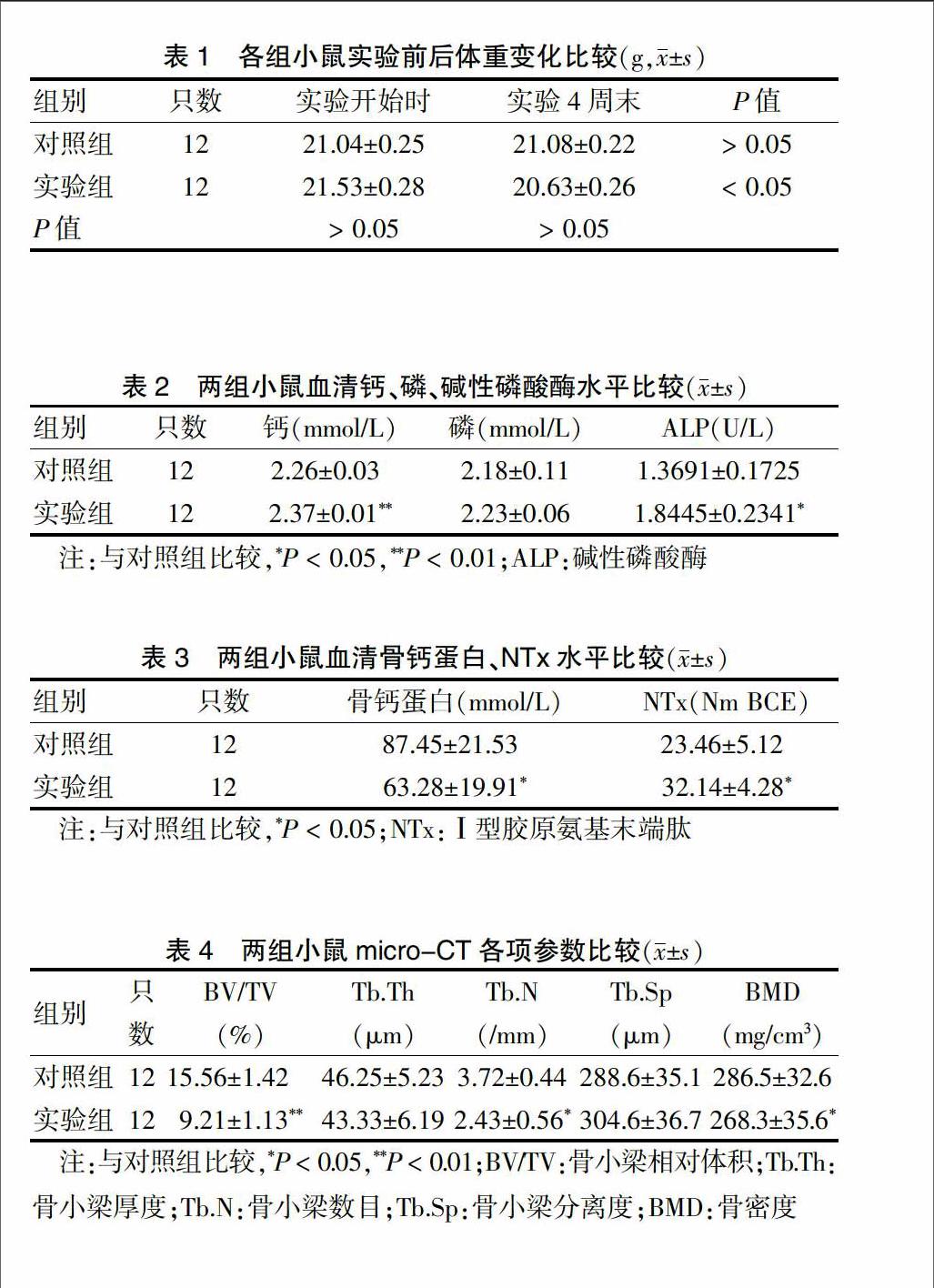
所有实验动物均进入结果分析,无脱落。实验开始时,实验组和对照组平均体重差异无统计学意义(P > 0.05)。在给予应激刺激4周后,实验组小鼠体重略低于对照组,但两组差异无统计学意义(P > 0.05);与实验前相比,实验组在实验4周末的体重明显下降(P < 0.05),而对照组未见明显改变(P > 0.05)。见表1。
2.2 两组小鼠血清学指标比较
实验4周末,与对照组相比,实验组小鼠血清钙、ALP含量均显著增加,差异有统计学意义(P < 0.05),而血磷水平虽然有一定程度的升高,但差异无统计学意义(P > 0.05)。见表2。对骨形成相关特异性标志物进行血清学测定,结果发现,实验组血清骨钙蛋白水平明显降低,而血清NTx水平显著增加,差异有统计学意义(均P < 0.05)。见表3。
2.3 两组小鼠micro-CT检测指标比较
实验4周末,实验组BMD明显低于对照组,差异有统计学意义(P < 0.05)。与对照组比较,实验组BV/TV显著降低(P < 0.01),Tb.N减少(P < 0.05);Tb.Th呈降低趋势,但差异无统计学意义(P > 0.05);Tb.Sp呈现增加趋势,但差异无统计学意义(P > 0.05)。见表4。
3 讨论
快速老化小鼠SAM-P6是经典的老年性骨质疏松症动物模型,其在6~8周即可明显老化[6]。为排除雌激素水平变化对实验结果可能造成的干扰,本实验选择雄性SAM-P6进行研究,观察慢性应激状态对老年性骨质疏松症病理生理变化的影响。实验结果表明,慢性应激状态会改变骨质疏松症相关检测指标,加重骨质疏松状态,说明慢性应激状态在骨质疏松的发病机制、病程进展及治疗过程中可能发挥重要作用。
钙是骨矿化的基本物质,而磷促进骨基质的合成和骨矿沉积,影响骨细胞对钙的摄入,导致骨细胞结构和功能的改变,两者相互影响,血钙、血磷的稳定是骨生长和矿化的必要条件。本实验处于应激状态的实验组血钙、血磷均呈现升高趋势,可能与应激引发的神经内分泌改变和骨代谢紊乱有关[7-9]。
ALP是在骨矿化过程中扮演重要角色的非胶原蛋白[10],在成骨活跃时可由成骨细胞大量分泌。血清中约有50%的ALP来源于骨,因此血清ALP含量在一定程度上可反映骨的代谢变化。研究表明,当存在快速骨质丢失或骨折风险时,血清ALP水平呈增高趋势,可能是由伴随着骨吸收亢进而出现的代偿性骨形成和骨转换增强引起的[11-12]。本次实验结果发现,实验组血清ALP水平显著高于对照组,提示处于慢性应激状态时骨转换率明显增加。
通过检测血清或尿液中各项比较敏感的骨转换生化标志物,将有助于更加明确机体的骨代谢状态[13]。骨钙蛋白在骨代谢过程中主要由成骨细胞合成和分泌,是反映成骨细胞活性的血清学特异性敏感指标[14-15],其特异性不受骨代谢紊乱的影响。NTx是矿化骨中Ⅰ型胶原降解产生的交联物的一部分,在骨吸收时释放入血,部分出现于尿液中,是特异性地反映骨吸收状态的敏感指标[16]。通过检测小鼠血清中骨钙蛋白和NTx水平,结果发现,与对照组相比,处于慢性应激状态的小鼠,其血清骨钙蛋白水平显著降低,而NTx水平明显升高,提示实验组小鼠成骨减少,破骨增加,骨转化率增加,说明慢性应激状态不利于骨代谢正常和稳定水平的维持。
骨密度降低和骨结构异常是骨质疏松症的重要特征[2]。为直观观察实验动物骨量丢失程度和骨结构改变情况,micro-CT是目前最常用的影像学标准检测技术之一[17]。该技术不仅能检测骨密度的变化,还可以对骨质量改变进行全面评价,相对传统的双能X线吸收测量法(DEXA)具有明显的优势。通过该技术,笔者对近端股骨这一骨质疏松症常见骨折部位进行检测,结果发现,实验组小鼠除了BMD明显降低外,同时BV/TV、Tb.N等骨质量参数也发生明显负性改变,说明慢性应激状态可改变骨强度,加重骨质疏松症骨微观结构的改变。
本研究尚存在一些不足之处。此次实验观察时间为4周,相对较短;未进一步行骨组织形态计量学检测、骨生物力学测量等,以更加全面评估实验动物骨质改变情况;采用SAM-P6作为老年性骨质疏松症动物模型,仅能反映人体老化的部分特征,因此仍然需要进一步进行更多的实验研究和临床试验。
综上所述,通过本次实验研究对骨代谢状态指标和骨质量等的综合分析,初步认为,慢性应激会导致老年性性骨质疏松症病变程度的加重,长期处于应激状态将不利于老年性性骨质疏松症的预防和治疗。因此,对于长期忍受病痛折磨或精神压力的老年性患病人群,尤其应当注意重度骨质疏松症的预防。在治疗过程中,应当按照生物-心理-社会医学模式的要求,给予老年人群良好的人文关怀和积极的心理干预。
[参考文献]
[1] Lewiecki EM,Bilezikian JP,Binkley N,et al. Update on osteoporosis from the 2014 Santa Fe Bone symposium [J]. Endocrine Research,2015,25:1-14.
[2] Golob AL,Laya MB. Osteoporosis:screening,prevention,and management [J]. The Medical Clinics of North America,2015,99(3):587-606.
[3] Lindsay R. Osteoporosis treatment and fracture outcomes [J]. JAMA Intern Med, 2015,125:245-250.
[4] Bab IA,Yirmiya R. Depression and bone mass [J]. Annals of the New York Academy of Sciences,2010,1192:170-175.
[5] Mineur YS,Prasol DJ,Belzung C,et al. Agonistic behavior and unpredictable chronic mild stress in mice [J]. Behavior Genetics,2003,33(5):513-519.
[6] Watanabe K,Hishiya A. Mouse models of senile osteoporosis [J]. Molecular Aspects of Medicine,2005,26(3):221-231.
[7] Lapmanee S,Charoenphandhu N,Krishnamra N,et al. Anxiolytic-like actions of reboxetine, venlafaxine and endurance swimming in stressed male rats [J]. Behavioural Brain Research,2012,231(1):20-28.
[8] Charoenphandhu N,Teerapornpuntakit J,Lapmanee S,et al. Duodenal calcium transporter mRNA expression in stressed male rats treated with diazepam, fluoxetine, reboxetine,or venlafaxine [J]. Mol Cell Biochem,2012,369(1-2):87-94.
[9] Yirmiya R,Goshen I,Bajayo A,et al. Depression induces bone loss through stimulation of the sympathetic nervous system [J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(45):16876-16881.
[10] Zhang DW,Wang ZL,Qi W,et al. The effects of Cordyceps sinensis phytoestrogen on estrogen deficiency-induced osteoporosis in ovariectomized rats [J]. BMC Complementary and Alternative Medicine,2014,14:484.
[11] Lumachi F,Ermani M,Camozzi V,et al. Changes of bone formation markers osteocalcin and bone-specific alkaline phosphatase in postmenopausal women with osteoporosis [J]. Annals of the New York Academy of Sciences,2009, 1173(Suppl 1):E60-63.
[12] Mukaiyama K,Kamimura M,Uchiyama S,et al. Elevation of serum alkaline phosphatase (ALP) level in postmenopausal women is caused by high bone turnover [J]. Aging Clinical and Experimental Research,2014,59:451-458.
[13] Garnero P. Biomarkers for osteoporosis management:utility in diagnosis,fracture risk prediction and therapy monitoring [J]. Molecular Diagnosis & Therapy,2008,12(3):157-170.
[14] Kanbur NO,Derman O,Sen TA,et al. Osteocalcin. A biochemical marker of bone turnover during puberty [J]. International Journal of Adolescent Medicine and Health,2002,14(3):235-244.
[15] Wei J,Karsenty G. An overview of the metabolic functions of osteocalcin [J]. Reviews in Endocrine&Metabolic Disorders, 2015,13(3):180-185.
[16] Wendlova J. NTx——a sensitive laboratory parameter of bone resorption [J]. Bratislavske Lekarske Listy,1998,99(6):327-330.
[17] Bouxsein ML,Boyd SK,Christiansen BA,et al. Guidelines for assessment of bone microstructure in rodents using micro-computed tomography [J]. Journal of Bone and Mineral Research:the Official Journal of the American Society for Bone and Mineral Research,2010,25(7):1468-1486.
(收稿日期:2015-03-24 本文编辑:程 铭)
