流式细胞仪检测线粒体膜电位方法的研究
2015-08-05张楠曦
岳 磊,张 垚,张楠曦
(哈尔滨工业大学生命科学与技术学院,哈尔滨150080)
细胞活动的能量主要来自ATP,而80% 以上的ATP是在线粒体中合成的.线粒体是糖、脂肪和氨基酸最终氧化释放能量的场所,线粒体为一双层膜围成的囊状结构,外膜与内膜间的空腔称为外室,由内膜包围的腔称为内室或线粒体基质.线粒体外膜通透性较大,分子质量在15 ku以下物质可自由通过,因此胞质成分与线粒体外室基本相似.线粒体内膜通透性小,分子质量大于1.5 ku物质不易通过,但内膜存在一些载体蛋白与通道以便运输某些物质.质子泵存在于内膜,它将基质内质子泵入外室,从而形成横跨线粒体内膜的线粒体跨膜电位(mitochondrial membrane potential,用 Δψm表示)[1-3].跨膜电位内室为负,外室为正.事实上,Δψm的变化可以暗示着线粒体蛋白复合体的结构改变、细胞色素C的释放、ATP合成不足等多种线粒体功能相关变化,也可以提示由线粒体通路介导的细胞凋亡、细胞死亡、细胞自噬等细胞机体的产生机理.
流式细胞仪(Flow Cytometer,FCM)是以流式细胞术为核心技术,集光学、电子学、流体力学、细胞化学、生物学、免疫学以及激光和计算机等多门学科和技术于一体的先进科学技术设备[4].它可以对快速直线流动状态中的单列细胞或生物颗粒进行逐个、多参数、快速的定性、定量分析或分选,具有检测速度快、测量参数多、采集数据量大[5]、分析全面、分选纯度高、方法灵活等特点,是现代科学研究中的先进仪器之一.本文采用常见的4种检测线粒体膜电位的荧光染料,通过流式细胞仪进行比较,以判定每种方法的优缺点.
1 材料和方法
1.1 实验仪器
CO2培养箱(Thermo Forma);流式细胞仪(BD FACSCalibur);紫外交联仪(Gene CL-1000);低速台式离心机(TDL-40C);台式微量冷冻离心机(Beckman X-22R)
1.2 细胞及主要试剂
人类宫颈癌细胞Hela由哈尔滨工业大学生命科学与技术学院提供;罗丹明123和JC-1试剂盒购自北京碧云天公司;TMRE购自Invitrogen公司;DiOC6(3)荧光染料购自Sigma公司.
1.3 实验方法
1.3.1 细胞培养
Hela细胞培养于含体积分数为10%胎牛血清的DMEM培养液中,并加入100 IU/mL青霉素及100 IU/mL链霉素,置37℃、5%的CO2培养箱中培养,实验时取对数生长期细胞.
1.3.2 实验对照组
对照组为未处理的Hela细胞组,实验组Hela细胞经UV照射后,培养24 h,收集细胞,各组细胞终浓度均为5×105个/mL.
1.3.3 罗丹明123检测法
取对数生长期细胞,胰酶EDTA消化,用PBS制成细胞悬液,PBS漂洗2次(1 500 r/min,10 min),加入0.5 mL罗丹明123染液(5 mg/L)(避光操作),培养箱中染色30 min,用PBS清洗1次(1 500 r/min,10 min),过200目尼龙网,流式细胞仪检测,激发波长为488 nm.
1.3.4 DiOC6(3)检测法
取对照组和实验组细胞,胰酶EDTA消化,用PBS制成细胞悬液,PBS漂洗2次,加入DiOC6至终浓度40 nmol/L,室温避光孵育20 min,流式细胞仪分析前PBS缓冲液洗涤细胞.
1.3.5 TMRE 检测法
取对照组和实验组细胞,胰酶EDTA消化,用PBS制成细胞悬液,PBS漂洗2次,加入TMRE至终浓度为100 nmol/L,37℃孵育30 min,用PBS清洗1次,流式细胞仪检测.
1.3.6 JC -1 检测法
取对数生长期细胞,胰酶EDTA消化,用PBS制成细胞悬液,PBS漂洗2次,终浓度JC-1(1 mmol/L)进行染色,37℃平衡30 min,流式细胞仪检测细胞的荧光强度(具体步骤参照试剂盒说明书).
2 实验结果
图1~3为单色荧光染料结果分析的直方图,图中横坐标为荧光道数,表示相对荧光强度,纵坐标表示细胞数.以对照组为参照图,在主峰的左侧设置门M1,门内的数值表示荧光强度下降的细胞百分数.
2.1 罗丹明123荧光染料检测
罗丹明123是一种可透过细胞膜的阳离子荧光染料,是一种线粒体跨膜电位的指示剂.正常细胞中能够依赖线粒体跨膜电位进入线粒体基质,荧光强度减弱或消失.而在线粒体膜完整性被破坏时,线粒体膜通透性转运孔开放,罗丹明123重新释放出线粒体,发出强黄绿色荧光[6].罗丹明123检测结果如图1所示.从图1中可以看出,处理组(29.83%)与对照组(4.21%)相比,门 M1的细胞百分数增多,叠加图中也清晰的看到处理组的峰左移,结果表明UV照射后的Hela细胞罗丹明123荧光强度减弱,Δψm明显降低.
2.2 DiOC6(3)荧光染料检测
DiOC6(3)是一类亲脂性荧光染料,用于标记细胞膜和疏水性组织.这是一类环境敏感型荧光染料,当它与膜结合或者与亲脂性生物分子(例如蛋白质,虽然在水中其荧光强度很弱)结合时,其荧光强度显著增强.它们具有很高的淬灭系数,偏光依赖性和很短的激发寿命.一旦应用于细胞中,这种染料会在细胞内质膜中逐步扩散,导致在其最佳浓度条件下,将整个细胞染色.488 nm激发时最大发射波长为527 nm,呈绿色荧光[7-8].DiOC6(3)检测结果如图2所示.从图2中可以看出,处理组(19.07%)与对照组(3.76%)相比,门 M1的细胞百分数增多,叠加图中能看到处理组的峰左移,说明UV照射后的Hela细胞Δψm降低.
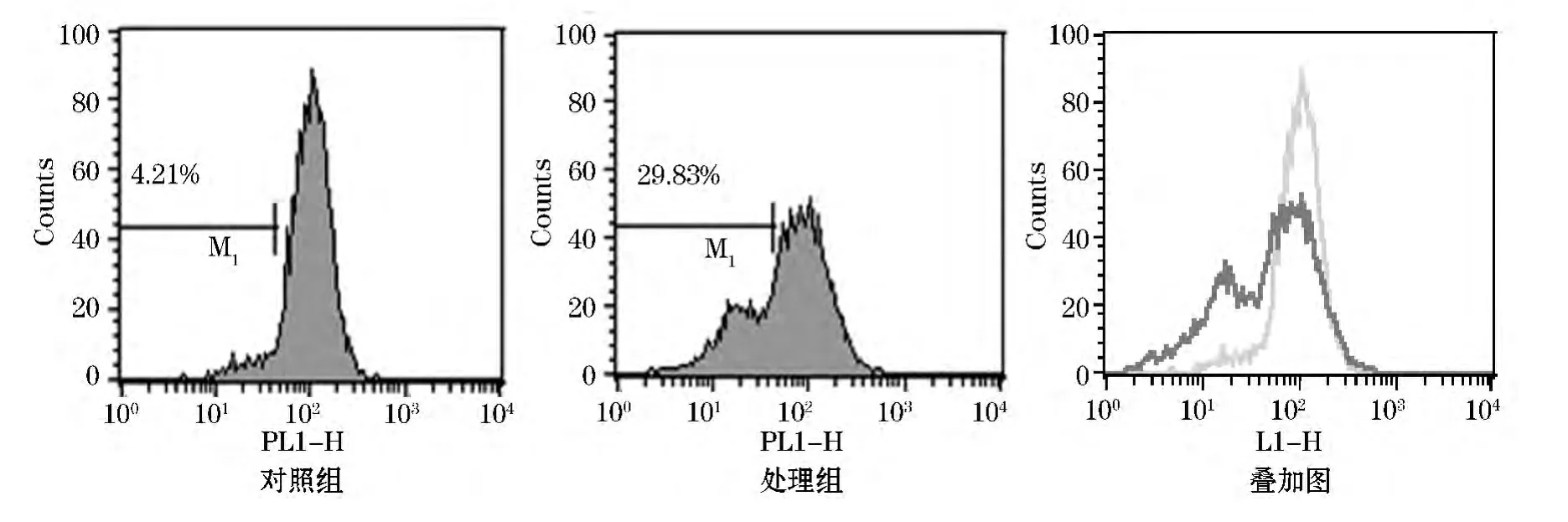
图1 罗丹明123试剂检测结果
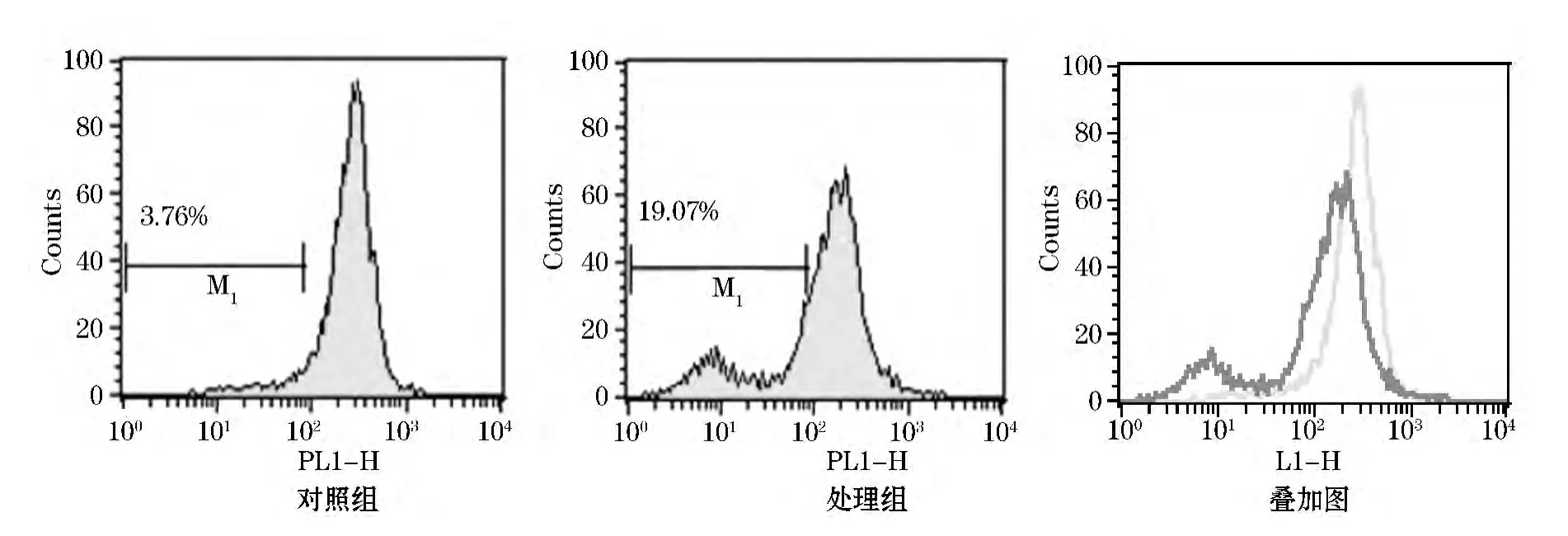
图2 DiOC6(3)试剂检测结果
2.3 TMRE荧光染料检测
TMRE荧光探针为一种带正电荷、对细胞通透、无毒的荧光染料,其激发光波长为543 nm,发射波长为560 nm.在正常生理条件下,线粒体膜的电压为内负外正,带正电的TMRE可迅速进入并聚集在线粒体内.mPTP的开放使线粒体的膜电位消失,导致TMRE从线粒体释放,因此线粒体内TMRE荧光强度变化可以适当地反映线粒体膜电位的高低[9-11].TMRE 检测结果如图3所示,该试剂选用FL2通道,处理组(13.65%)与对照组(3.23%)相比,荧光强度减少10.42%,结果表明UV照射后的Hela细胞TMRE荧光强度减弱,Δψm降低.
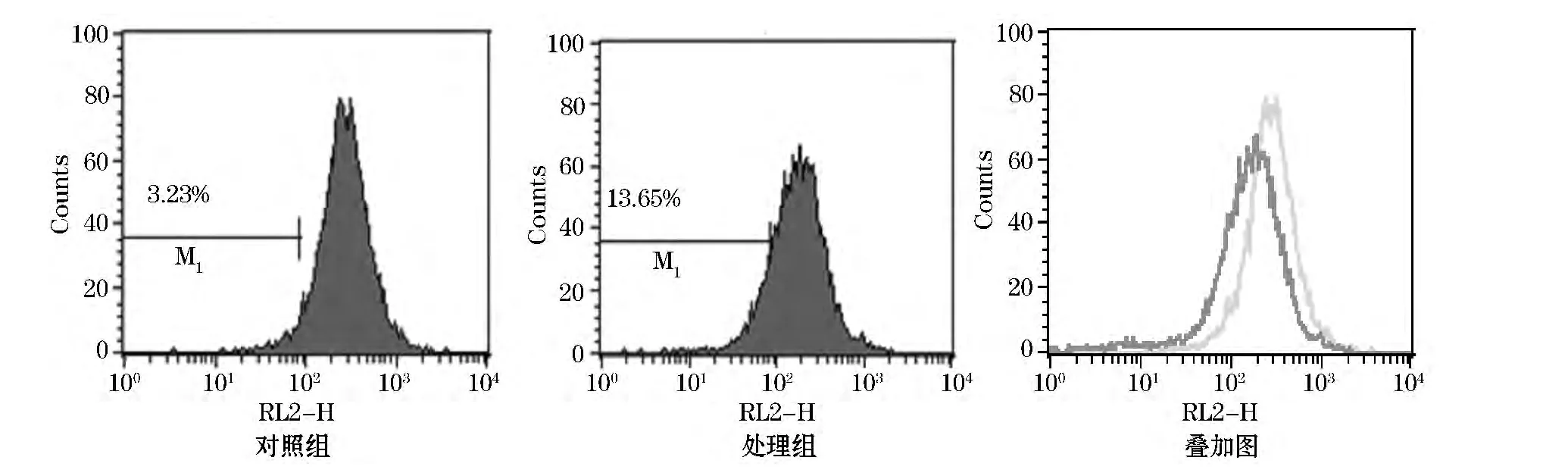
图3 TMRE试剂检测结果
2.4 JC-1荧光染料检测
JC-1是一种广泛用于检测线粒体膜电位的阳离子型亲脂性荧光探针,能够自由穿过细胞膜,随细胞膜电位的变化而在膜两侧保持动态平衡..可以检测细胞、组织或纯化的线粒体膜电位.在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,可以产生红色荧光,激发波长为490 nm,发射波590 nm;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,可以产生绿色荧光,激发波长为488 nm,发射波长为529 nm.这样就可以非常方便地通过荧光颜色的转变来检测线粒体膜电位的变化[12].JC-1试剂检测结果如图4所示.由于JC-1在检测时发出两种荧光,因此其结果分析采用二维散点图,用“十”字门将图谱分成四个象限.右上象限(UR)表示JC-1在细胞内以聚合物形式存在,发出红色荧光;右下象限(LR)表示JC-1在细胞内以单体形式存在,发出绿色荧光.由图4可以看出,Hela细胞经UV照射后,处理组(16.40%)与对照组(4.46%)相比,绿色荧光明显增强,表示JC-1单体形态增多,提示UV处理后的细胞Δψm降低.

图4 JC-1试剂检测结果
3 讨论
研究结果表明,4种荧光染料均可以用流式细胞仪进行线粒体膜电位的检测.但由于每种染料的检测原理不同,在染液浓度及孵育时间上也不同,在实际实验中还要根据不同的实验目的选择不同的染料.
罗丹明123是流式细胞仪检测Δψm的常用荧光染料,它与线粒体结合能力较高,容易破坏电子传递链(ETC),并且释放缓慢,因此在瞬时荧光染料释放期间减少对膜电位变化的影响.罗丹明123这一特点,使得它成为实时检测细胞急性损伤中线粒体膜电位变化的首选荧光染料.
DiOC6(3)检测Δψm的方式与罗丹明123比较相似,但与其他荧光染料相比较,DiOC6(3)对线粒体呼吸有较高的毒性,并且由于其实验用剂量较低,使得该染料对试验操作的精准度要求较高.这两种染料在流式细胞仪上均用FL1通道检测[13].
TMRE是一种在非淬灭模式下检测Δψm的荧光染料,它与线粒体结合能力较弱,并且释放迅速,适用于检测慢性损伤细胞中线粒体膜电位的变化,或者检测不同方法处理的各实验组Δψm差异,在流式细胞仪中用FL2通道检测.
与上述单色荧光探针不同,JC-1在检测线粒体膜电位时是通过聚集体与单体的光谱转换来获得荧光信号,因此JC-1往往被认为是可靠的Δψm指示剂.由于JC-1有较强的光敏感性,并且它的聚集体不能快速的与单体达到平衡状态,因此在使用JC-1染料时要特别注意探针的使用浓度和反应时间.JC-1一般更多的用于细胞凋亡早期线粒体膜电位变化的检测[14-15].
本实验采用紫外照射的方式诱导细胞产生凋亡,大量实验研究表明,在细胞凋亡中,线粒体起着中心调控作用,而且在凋亡的早期阶段,首先发生的是线粒体膜电位的改变.通过这一特点,我们考察了4种荧光染料对在细胞凋亡中Δψm变化的指示作用.结果显示:罗丹明检测到的 Δψm变化较大,实验组与对照组比较相差25.62%,这可能与罗丹明123适用于检测细胞急性损伤中线粒体膜电位变化相关.
不仅仅是细胞凋亡,在其他线粒体调控机制中,线粒体膜电位的变化也是重要监测指标之一.随着科学技术的发展,流式细胞仪已实现多个激光器获得多色荧光参数,同时完成分类、实现实时同步分析的功能,这大大提高了流式细胞仪的应用范围及精确度,也使其成为检测线粒体膜电位的重要科学手段.由于每个染料的检测原理不同,与线粒体的结合方式不同,在实际应用中要根据不同的实验选择不同的染料,以保证获得较为准确的实验结果.
[1]HANADA M,NOGUCHI T,YAMAOKA T.Amrubicin induces apoptosis in human tumor cells mediated by the activation of caspase-3/7 preceding a loss of mitochondrial membrane potential[J].Cancer Science,2006,97(12):1396- 1403.
[2]CLAYTON R,CLARK J B,SHARPE M.Cytochrome c release from rat brain mitochondria is proportional to the mitochondrial functional deficit:implications for apoptosis and neurodegenerative disease[J].Journal of Neurochemistry,2005,92(4):840-849.
[3]王敬春,苗 术,黄海涛.流式细胞仪在细胞凋亡检测中的应用[J].齐齐哈尔医学院学报,2007,28(8):970-971.
[4]赵书涛,武晓东,王 策,等.流式细胞仪的原理、应用及最新进展[J].现代生物医学进展,2011,11(22):4378-4381
[5]范宁娟,项 萍,段 敏.应用流式细胞仪检测细胞凋亡的4种方法的比较[J].安徽农业科学,2014,42(32):11240-11242.
[6]SCH NFELDER U,RADESTOCK A,ELSNER P,et al.Cyclodextrin-induced apoptosis in human keratinocytes is caspase-8 dependent and accopanied by mitochondrial cytochrome c release[J].Experimental Dermatology,2006,15(11):883 -890.
[7]谷牧人,李骏白,张筱骅,等.苦参碱对人乳腺癌MCF-7细胞的促凋亡作用及其对线粒体跨膜电位的影响分析[J].中国生化药物杂志,2015,25(2):39-41.
[8]FINUCANE D M,WETZEL E B,WATERHOUSE N J,et al.Bax-induced caspase activation and apoptosis via cytochrome c release from mitochondria is inhibitable by Bcl- xl[J].Journal of Biological Chemistry,1999,274(4):2225-2233.
[9]PERRY S W,NORMAN J P,BARBIERI J,et al.Mitochondrial membrane potential probes and the proton gradient:a practical usage guide[J].Biotechniques,2011,50(2):98 -115.
[10]SHAPIRO H M.Membrane potential estimation by flow cytometry[J].Methods,2000,21:271 -279.
[11]ARBAMOV A Y,DUCHEN M R.Mechanisms underlyingthe loss of mitochondrial membrane potential in glutamate excitotoxicity[J].Biochim.Biophys,2008,1777:953 -964.
[12]CHINOPOULOS C,TRETTER L,ADAM -VIZI V.Depolarization of in situmitochondria due to hydrogen peroxide induced oxidative stress in nerve terminals:inhibition of alpha-ketoglutarate dehydrogenase[J].Neurochem,1999,73:220 -228.
[13]李强翔,石梅兰,蔡光先.铁皮石斛对高糖环境下人脐静脉内皮细胞线粒体膜电位的影响[J].卫生研究,2014,43(6):1022-1025.
[14]GRAY G K.Therapeutic CK2 inhibition attenuates diverse prosurvival signaling cascades and decreases cell viability in human breast cancer cells[J].Oncotarget,2014,15(5):6484 -6496.
[15]于 淼,于 洋,刘林涛.石蒜碱对人白血病细胞K562凋亡作用的实验研究[J].哈尔滨商业大学学报:自然科学版,2014,30(2):157 -160.
