中性蛋白酶水解藏羊血清蛋白制备抗氧化肽的研究
2015-08-02高丹丹兰家国赵佩佩
高丹丹,兰家国,赵佩佩,曹 竑
(西北民族大学生命科学与工程学院,甘肃兰州 730030)
中性蛋白酶水解藏羊血清蛋白制备抗氧化肽的研究
高丹丹,兰家国,赵佩佩,曹 竑
(西北民族大学生命科学与工程学院,甘肃兰州 730030)
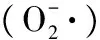
藏羊血清蛋白,中性蛋白酶,水解,响应面,抗氧化活性
羊血即牛科动物山羊或绵羊的血,主要成分为多种蛋白质,含少量脂类、葡萄糖及无机盐等。蛋白质主要是血红蛋白,其次是血清白蛋白、血清球蛋白和少量纤维蛋白。羊血性平、味咸,入脾经;主要用于各种内出血、外伤出血的食疗[1]。近几年来采用动物血液蛋白源制备生物肽的研究较为活跃,Brant[2]报道从牛血血红蛋白中分离得到两种吗啡肽。任建东等[3]曾报道过在鹿茸血的Alcalase水解物有抗氧化活性和ACE抑制活性;刘骞[4]等人研究了酶水解猪血浆蛋白的工艺条件,获得具有抗氧化活性的猪血浆蛋白肽。2011年,Adje[5]等采用胃蛋白酶水解牛血红蛋白得到26段血红蛋白源抗菌片段,其中13段是新发现的抑菌肽。但目前国内对藏羊血清水解肽的研究较少。本研究在前期研究的基础上采用中性蛋白酶水解藏羊血清蛋白,在单因素实验的基础上,利用响应面分析法(Response Surface Methodology,RSM)对水解工艺条件进行优化,并对水解产物的抗氧化活性进行分析,为藏羊血清蛋白抗氧化活性肽的开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
藏羊血清蛋白(藏系绵羊血清采取于青海省海西州天峻县,经真空冷冻干燥,-20 ℃保存待用)。
中性蛋白酶(90000 U/g,中生瑞泰);DPPH、BHT 美国sigma公司;邻二氮菲、邻苯三酚(没食子酚)、菲咯嗪、Tris等试剂均为国产分析纯。
1.2 仪器与设备
JA2003N电子天平 上海天平仪器厂;PB-10型精密pH计 Sartorius公司;HWS28型电热恒温水浴锅 西安禾普生物科技有限公司;GL-3250B控温磁力搅拌器 江苏其林贝尔仪器制造有限公司;TGL-16M高速台式冷冻离心机 湘仪离心机仪器有限公司;Labconco Freezoneil台式冻干系统 上海比朗仪器有限公司;6010型紫外分光光度计 美国惠普有限公司。
1.3 实验方法
1.3.1 藏羊血清蛋白酶液的制备 准确称取5 g藏羊血清蛋白,加入100 mL的超纯水溶解,调节其至一定pH,加入一定量的酶,在特定的温度下进行水解,95 ℃灭酶15 min,加入一定量10% TCA后,8000 r/min离心15 min,取上清液待分析用。
1.3.2 水解度的测定 水解度的测定方法采用茚三酮比色法[6],计算公式如下:

式中:As为酶解液中的总游离氨基数,mmol;A1为原料蛋白强酸水解后的总游离氨基数,mmol;A0为原料蛋白中固有的游离氨基数,mmol。
1.3.3 单因素实验设计 以藏羊血清蛋白水解度(DH)为评价指标,pH为7,反应时间为4 h,温度为50 ℃的条件下,研究不同[E]/[S](800、1600、2400、3200、4000 U/g)对水解度的影响;在pH为7,反应时间为4 h,[E]/[S]为2400 U/g的条件下,研究不同温度(分别为30、40、50、60、70 ℃)对水解度的影响。在温度为50 ℃,反应时间为4 h,[E]/[S]为2400 U/g的条件下,研究不同pH(分别为5.0、6.0、7.0、8.0、9.0)对水解度的影响;在温度为50 ℃,pH为7.0,[E]/[S]为2400 U/g的条件下,研究不同反应时间(分别为2.0、3.0、4.0、5.0、6.0 h)对水解效果的影响,确定各因素的最佳水平。
1.3.4 响应面实验设计 在单因素实验的基础上,根据Box-Behnken中心组合设计原理,选取温度、pH、反应时间3个显著的因素为自变量(分别以A、B、C表示),以水解度为响应值设计了3因素3水平共17个实验点的响应面分析实验,因素水平如表1所示,处理数据采用统计软件Design Expert 8.0完成。

表1 Box-Behnken实验设计
1.3.5 藏羊血清多肽抗氧化能力的测定
1.3.5.1 DPPH自由基清除能力的测定 将冻干的多肽粉末配制成1、2、4、6、8 mg/mL的多肽溶液,分别吸取各浓度的多肽液和1%的BHT溶液1 mL于试管中,加入0.4 mmol/L的DPPH自由基溶液(用无水乙醇配制)0.2 mL和2.0 mL的蒸馏水,混匀反应体系,室温下置于黑暗中反应30 min,517 nm波长处测定其吸光度A1。以等体积的无水乙醇代替DPPH溶液为空白组,记为A2;以同体积的蒸馏水代替样品溶液为对照组,记为A0。所有测定值均为三次结果的平均值,根据以下公式计算自由基清除率[7]。
式中:A0为对照实验(水代样品溶液)的吸光度;A1为样品实验吸光度;A2为样品干扰实验(无水乙醇代DPPH溶液)的吸光度。
1.3.5.2 羟自由基(·OH)清除能力测定 采用邻二氮菲法。参考吴淳涛[8]等人的方法并稍加改进。准确量取0.75mmol/L的邻二氮菲溶液1.0mL于试管中,再依次加入pH为7.4的PBS缓冲液2.0mL以及蒸馏水1.0mL,混匀反应体系,加入1.0mL的0.75mmol/LFeSO4溶液,然后用0.12%的双氧水(现配现用)1.0mL启动反应,立即震荡混匀,记为AP;用同体积的蒸馏水代替0.12%的双氧水,其余的条件均同AP处理方法,记为Ab;用同体积的多肽液代替1.0mL的蒸馏水,其余条件均同AP处理方法,记为As。三个管AP、Ab、As置于37 ℃水浴锅中保温1h,反应结束后,以蒸馏水调零,在536nm波长处测定各管的吸光度,并计算羟自由基的清除率。
式中:Ap为1mL邻二氮菲+2mLPBS+1mLFeSO4+1mLH2O2+1mLH2O的吸光值;Ab为1mL邻二氮菲+2mLPBS+1mLFeSO4+2mLH2O的吸光值;As为1mL邻二氮菲+2mLPBS+1mLFeSO4+1mLH2O2+1mL样品溶液的吸光值。
式中:A空为空白对照液的吸光值;A样为样品溶液的吸光值。
1.4 数据统计分析
采用F检验对响应面实验数据进行方差分析以评价模型的统计意义,数据分析软件采用DesignExpert8.0和SPSS19.0。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 酶与底物浓度比([E]/[S])对水解效果的影响 不同[E]/[S]对藏羊血清蛋白水解度的影响如图1所示,水解度随着加酶量的增加而增加,加酶量800U/g到2400U/g变化的幅度较大。此后,随着加酶量的增加其曲线上升的趋势幅度变小。这是因为加酶量在一定范围内,随着加酶量的提高,反应体系水解度逐渐上升,当加酶量超出一定范围后,由于酶浓度逐渐饱和,使酶解速度的增加趋于饱和[10],此时继续增大加酶量对反应速率无大的影响,且过分的酶解还会产生苦味物质。因此,确定其最适合的加酶量为2400U/g。

图1 [E]/[S]对水解度的影响Fig.1 Effect of [E]/[S]on the degree of hydrolysis
2.1.2 温度对水解度的影响 温度对藏羊血清蛋白水解度的影响如图2所示,水解度在温度30~50 ℃随着温度的升高而增加,随着温度的继续上升其水解度呈下降的趋势。此后,随着温度的增加其曲线上升的趋势幅度变小。这是因为温度对酶促反应的影响一般有两个方面:一方面是当温度升高时,反应速度加快;另一方面,随着温度的升高,酶逐渐发生了变性,因而反应速度降低,酶促反应的最适温度就是这两种过程平衡的结果。在低于最适温度时,以前一种效应为主;而在高于最适温度时,以后一种效应为主[11]。在酶解的最初阶段,酶变性尚未表现出来,前一种效应占主导地位,所以当温度低于50 ℃时,水解度随温度升高而增加;但当温度高过最适宜温度时,酶蛋白变性逐渐突出,后一种效应占主导地位,所以当温度高于50 ℃时,水解度随温度升高反而降低;当酶解温度为50 ℃时,水解度最大。因此,确定其最适合的温度是50 ℃。
2.1.3 pH对水解度的影响 pH对藏羊血清蛋白水解度的影响如图3所示,可知水解度在pH从5.0~7.0随着pH的升高而增加,之后随着pH继续增大其水解度呈下降的趋势。这是因为每一种酶都有其适合的pH作用范围,在这个作用范围内酶的催化活性部位含有的可解离的基团得到了最充分的解离,使酶的活性中心与蛋白质底物充分结合,从而将底物最大程度地转化为水解产物,使水解度达到最大值,pH偏高偏低都会导致水解度的下降。因此,本研究确定其最适合的pH是7.0。
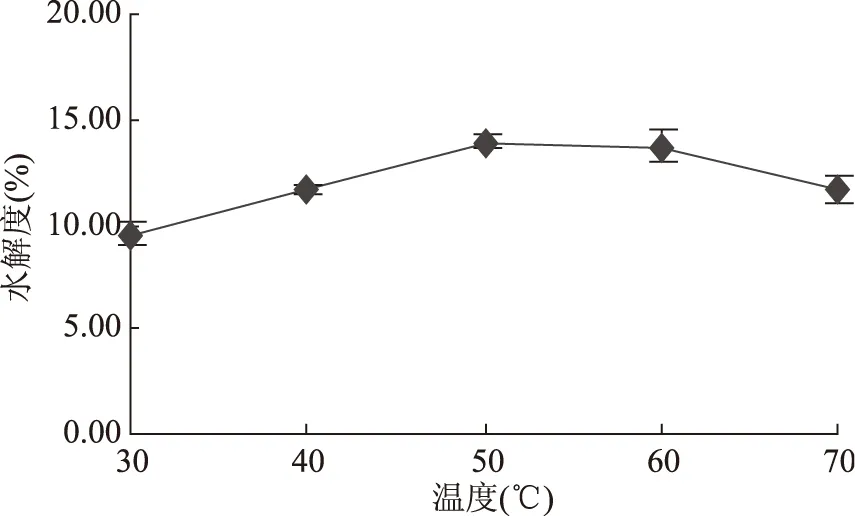
图2 温度对水解度的影响 Fig.2 Effect of temperature on the degree of hydrolysis
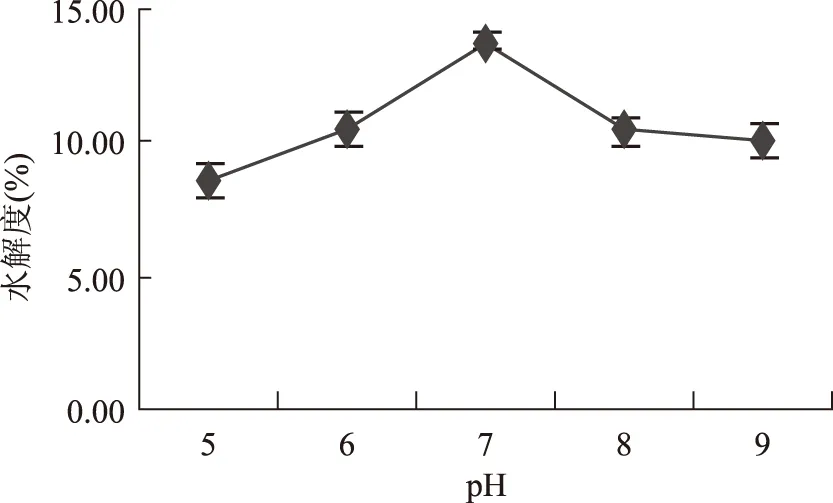
图3 pH对水解度的影响Fig.3 Effect of pH value on the degree of hydrolysis
2.1.4 时间对水解度的影响 水解时间对藏羊血清蛋白水解度的影响如图4,随着时间的延长,水解度逐渐升高。但当水解到5 h后,水解度变化趋于平缓。究其原因,随着酶解反应的进行:底物浓度减小,反应位点逐渐被酶分子饱和;产物浓度增加,其竞争性抑制变强;酶活性随反应时间增加会降低;中间复合物[ES]在经历了初始阶段的积累后达到稳态,趋于恒定[12]。从节约时间和能源的角度考虑,确定其最适合的水解时间是5 h。
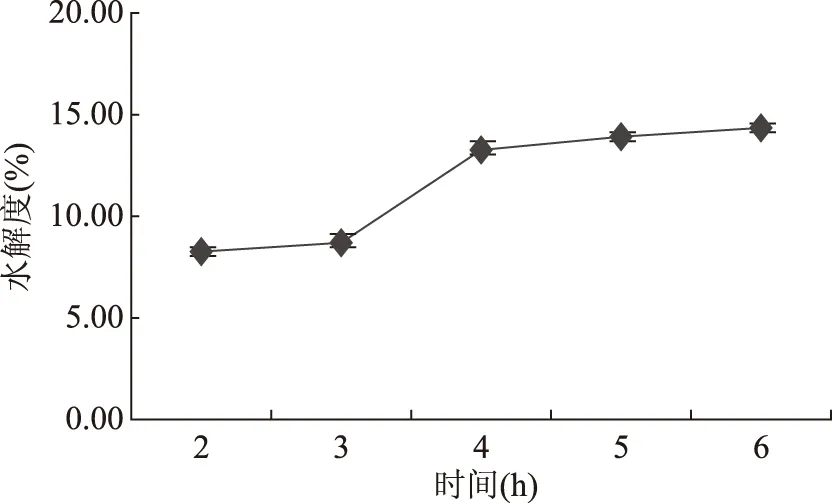
图4 时间对水解度的影响Fig.4 Effect of time on the degree of hydrolysis
2.2 响应面实验结果与分析
2.2.1 多元二次模型方程的建立及检验 从单因素实验结果可知,水解度随着酶添加量的增加而增加,在实际生产过程中酶添加量越多,势必会增加生产成本,所以在响应面中不考虑酶加量因素,而直接取最适宜的酶加量2400 U/g。选择对水解度影响最为显著的三个因素:温度(A)、pH(B)和时间(C)进行三因素三水平的响应面实验,实验设计如表1。中性蛋白酶水解藏羊血清蛋白的响应面分析实验根据Box-Behnken设计进行了17 组实验,其中5 组中心点重复实验,结果见表2。利用Design Expert 8.0采用中心组合实验 Box-Behnken设计方案,对 pH、温度、酶解时间三个工艺参数进行优化,获得二次回归方程如下:DH=15.42+0.78A+0.050B+1.38C-2.31A2-1.26B2-0.66C2-0.15AB-1.35AC-0.10BC运用响应面回归程序(Response Surface Regression,RSR)对17个实验点的响应值进行回归分析,得到回归模型的方差分析表3。
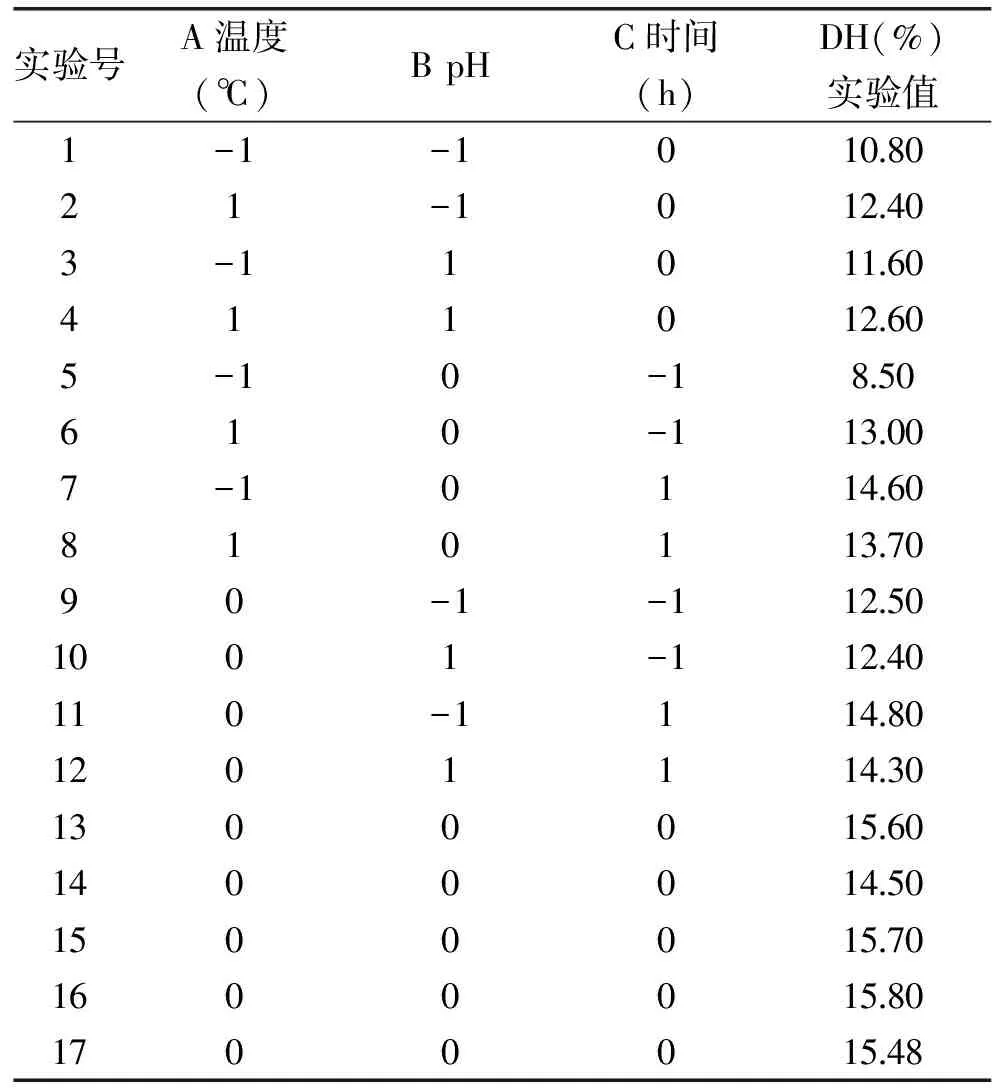
表2 Box-Behnken实验设计及其实验结果

表3 二次多项模型方差分析表
在回归方程系数显著性检验表4显示:A、C、A2、B2和AC这几个因素对水解度的影响显著,其中温度、时间对水解度的影响显著并且温度和时间的交互作用也对水解度的影响显著。

表4 回归方程系数显著性检验
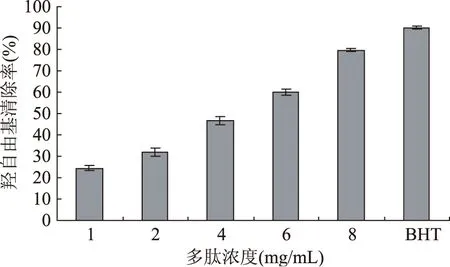
注: 2.2.2 响应面分析与优化 RSM的分析图是特定的响应值Y对应于因素A、B、C(A为反应温度;B为反应pH;C为反应时间)构成的一个三维空间的响应面图在二维平面上的等高线图,可以直观地反映出因素对响应值的影响,以及因素之间的相互作用,并且可以看出存在的极值条件应该在等高线的圆心处。等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则表示两因素交互作用不显著[13]。通过上述二次多项回归方程所作的响应曲面图及其等高线图见图5。通过该组动态图即可对任何两因素交互影响水解度效应进行分析与评价,并从中确定最佳因素水平范围。 图5 两因素交互作用对水解度的响应面图和等高线图Fig.5 Response surface and contour plots for theeffect of operating parameters on the degree of hydrolysis 图5(a)为固定时间为5h,温度和pH对水解度的三维响应面和二维等值曲线图,由图可知温度和pH的交互作用不明显。图5(b)为固定pH7、温度与时间对水解度影响的三维响应曲面和二维等值线图。从图中可见,温度和时间的交互作用较为显著,温度在40~48 ℃,反应时间在4~5.2 h范围内,与水解度呈正相关关系,水解度从8.5%上升至15.83%。此后水解度曲线趋于平缓,等值线的间距变宽,继续增加温度或延长反应时间对水解度的影响不大。图5(c)中为温度为50 ℃、时间与pH对水解度影响的三维响应曲面和二维等值线图,图中显示时间与pH的交互作用不显著。 2.2.3 模型验证实验 根据Box-Behnken实验所得的结果和二次多项回归方程,利用Design Expert 8.0软件获得了水解度最高时的各个因素的最佳水解条件为最优水解条件为温度50.27 ℃,水解时间为5.55 h,水解pH为6.78,在此水解条件下,水解度可达到15.91%。为了检验模型预测的准确性,在温度50 ℃,水解时间为5.5 h,水解pH为6.8下进行水解做了3平行实验所得结果分别为15.05%、15.44%和15.84%,平均值为15.44%,标准偏差(SD)=0.395%,可见该模型能较好地预测实际水解情况。 2.3 藏羊血清蛋白肽的抗氧化活性 2.3.1 DPPH自由基清除能力 由图6可知,藏羊血清蛋白的中性蛋白酶水解物对DPPH自由基有明显的清除作用,并且随着多肽溶液浓度的增大而增大,这说明藏羊血清蛋白多肽对DPPH自由基的清除能力在一定的浓度范围内有良好的量效关系。当多肽的浓度为8 mg/mL时对DPPH自由基清除率达到最大(76.06±0.74)%,而在相同的系统中1%的BHT的DPPH自由基清除率(98.40±0.43)%。多肽对DPPH自由基的IC50值为6.035 mg/mL。 图6 DPPH清除能力Fig.6 The scavenging ability of DPPH 2.3.2 羟自由基(·OH)清除能力 由图7可知,1%的BHT对所建体系的·OH清除率为(90.07±0.66)%,藏羊血清蛋白多肽浓度增大时,对·OH的清除作用明显增大。当多肽浓度为1 mg/mL时清除率为(24.51±1.37)%,2 mg/mL时清除率为(31.91±1.95)%,4 mg/mL时清除率为(46.70±1.85)%,6 mg/mL时清除率为(59.85±1.42)%,当多肽浓度达到8 mg/mL时清除率为(79.76±0.79)%,多肽对羟自由基的IC50值为3.555 mg/mL。 图7 羟自由基清除能力Fig.7 The scavenging ability of hydroxyl radical 图8 超氧阴离子清除能力Fig.8 The scavenging ability of superoxide radical 本研究通过单因素实验,确定了最适加酶量为2400 U/g,最适温度为50 ℃,最适pH为7,最适水解反应时间为5 h。以此为基础,并且以水解度为最终评价指标,通过三因素三水平的响应面分析法对蛋白酶水解蛋白的水解条件进行优化,得出最佳的水解条件为:温度50.27 ℃,水解时间为5.55 h,水解pH为6.78,在此条件下水解度可达到15.91%。并对最佳工艺条件下水解物的抗氧化活性进行分析,结果表明多肽的抗氧化活性和多肽的浓度在一定的浓度范围内有良好的量效关系,随着多肽浓度的增大,其抗氧化活性增加,当多肽浓度为8 mg/mL时,其DPPH清除率为(76.06±0.74)%,羟自由基清除率为(79.76±0.79)%,超氧阴离子清除率可达到(77.90±0.67)%。其对DPPH、羟自由基和超氧阴离子的半抑制浓度(IC50)分别为:6.035、3.555和2.872 mg/mL。本实验明确了藏羊血清蛋白肽的体外抗氧化功能,但其与BHT相比抗氧化能力有很大的差距,由于藏羊血清蛋白的中性蛋白酶水解物是一个复杂的混合物质,可能含有高抗氧化活性的成分,也可能含有无活性的或助氧化的成分,需要进一步的分离纯化。对于其具体起作用的功效成分和作用机理,以及相关功能性食品的研究与开发还有待于进一步研究。 [1]南京中医药大学.中药大辞典[M].第二版.上海:上海科学技术出版社,2006,3103-3104. [2]Lantzl EG,Lamsta L,Talback F,et al. Hemophines derived from hemoglobin have an inhibitory action on angiotensin converting enzyme activity[J]. Febs letters,1991,287:39. [3]任建东,施用晖,乐国伟,等.鹿茸血肽疏水性分离及抗氧化和ACE抑制作用的研究[J].天然产物与研究开发,2010,22:302-306. [4]刘骞,孔保华,刁静静.酶水解制备猪血浆蛋白抗氧化肽工艺参数的优化[J].食品工业科技,2009,30(2):166-173. [5]Adje EY,Balti R,Kouach M,et al. Obtaining antimicrobial peptides by controlled peptic hydrolysis of bovine hemoglobin[J].International Journal of Biological Macro Molecules,2011,49 (2):293-153. [6]何照范,张迪清.保健食品化学及其检测技术[M].北京:中国轻工业出版社,1997:141-142. [7]Gao DD,Li HX,Cao YS. Antioxidant activity of peptide fractions derived from cottonseed protein hydrolysate[J]. Journal of the science of food and agriculture,2010,90(11):1855-1860. [8]吴淳涛,童国忠,章卢超.石莼提取物抗氧化及抗菌活性研究[J].中国民族民间医药,2011:33-35. [9]欧晓峰,张建新,郭倩,等.复合酶法水解大麦虫蛋白制备酸性多肽及其抗氧化活性[J].西北农林学报,2010,19(2):189-193. [10]沈同,王镜岩.生物化学[M].北京:高等教育出版社,1990,353-354. [11]张俊英,王彩云,靳烨,等.酶水解乳清蛋白工艺条件的研究[J].农产品加工(学刊),2009,6:35-37. [12]郑云,蔡木易,范慰慰,等.蛋清白蛋白酶解工艺的研究[J].食品与发酵工业,2005,31(12):69-71. [13]余勃.枯草芽孢杆菌发酵豆粕生产大豆活性多肽的研究[D].南京:南京农业大学,2006:50-66. [14]高丹丹,李海星,常通,等.不同蛋白酶水解棉籽蛋白制备抗氧化多肽的研究[J].食品科技,2010,35(2):18-22. [15]陈建旭.灵芝水溶性蛋白与碱溶性多糖的提取和抗氧化性研究及灵芝浆的研制[D].广州:华南理工大学,2010. Preparation of antioxidant peptide by hydrolization of tibitan sheep serum protein by neutral protease GAO Dan-dan,LAN Jia-guo,ZHAO Pei-pei,CAO Hong (College of Life Science and Engineering,Northwest University for Nationalities,Lanzhou 730030,China) Tibitan sheep serum protein was hydrolyzed by neutral protease,the influences of the temperature,hydrolysis time,pH value and the substrate/enzyme ratio on the degree of hydrolysis of Sheep serum protein were investigated. On the basis of single factor tests and response surface methodology,the optimal working parameters were worked out and tested. The optimum hydrolysis parameters were as follows:when the amount of enzyme was 2400 U/g,hydrolyzing 5.5 hours at temperature 50 ℃ under pH6.8,and the degree of hydrolysis was 15.44±0.395% under the optimum conditions. The antioxidant activities of the hydrolysate was measured by the inhibiting effect on the scavenging ability of 1,1-diphenyl-2-pycrylhydrazyl(DPPH),hydroxyl radical and superoxide radical. The antioxidant activities increased with increasing concentrations of test samples. The peptides exhibited high scavenging ability of DPPH,hydroxyl radical and superoxide radical with an IC50value of 6.035,3.555 and 2.872 mg/mL respectively. tibitan sheep serum protein;neutral protease;hydrolysis;response surface;antioxidant activities 2014-10-11 高丹丹(1983-),女,博士,副教授,研究方向:食品生物技术,E-mail:gaodan0322@163.com。 TS254.9 B 1002-0306(2015)15-0229-06 10.13386/j.issn1002-0306.2015.15.039
注:*表示在5%的水平内显著(0.01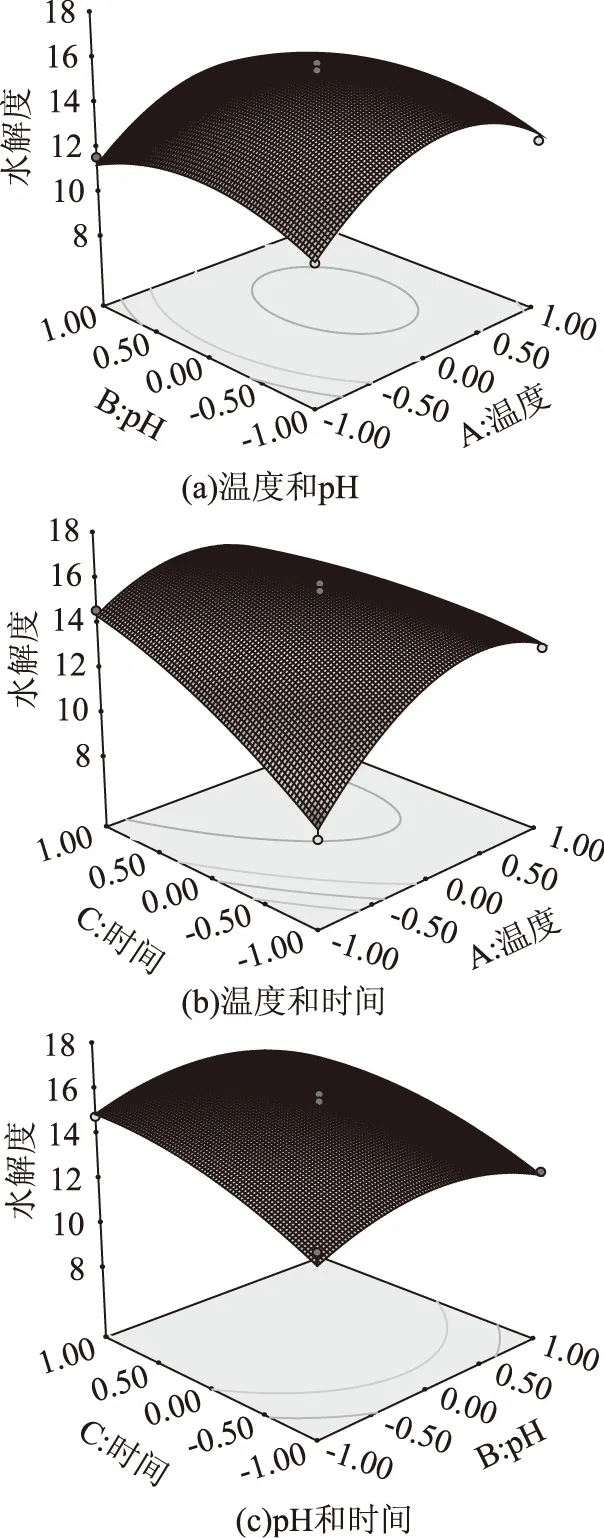


3 结论
